Заболеваемость сахарным диабетом (СД) неуклонно возрастает. В России, как и во многих странах, СД является социально значимым заболеванием, при этом пациенты с СД 2 типа (СД2) составляют 85–90% от общего числа лиц с СД. Заболевание ограничивает жизнь пациентов, приводит к ранней инвалидизации и летальности из-за развития сосудистых осложнений, которые и определяют тяжесть недуга и ущерб, причиняемый обществу [1]. Поэтому вопросы тактики лечения больных СД2 в настоящее время является одной из самых актуальных проблем современной медицины.
Важнейшим шагом в лечении пациентов с СД, направленным на снижение риска развития этих порой фатальных осложнений, служит достижение гликемического контроля.
Гипергликемия – это не только неотъемлемый метаболический признак СД, но и основное нарушение, обусловленное разными патофизиологическими механизмами, на коррекцию которых направлена сахароснижающая терапия. Успехи в области диабетологии связаны с инкретин-направленной терапией, благодаря которой стало возможным достижение эффективного контроля гликемии без риска гипогликемии [2].
К лекарственным средствам с инкретиновой активностью относятся ингибиторы дипептидилпептидазы-4 (ДПП-4). Ингибиторы ДПП-4 воздействуют на ведущий патофизиологический дефект СД2 – неадекватную секрецию инсулина β-клетками поджелудочной железы. Основная точка приложения действия – это фермент ДПП-4 (сериновая протеаза); ингибирование ДПП-4 замедляет деградацию эндогенных глюкагоноподобного пептида-1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП) [3, 4]. Инкретины играют важную роль в регуляции секреции и синтеза инсулина β-клетками. Инсулинотропные эффекты ГПП-1 и ГИП сходны и дополняют друг друга. Замедляя метаболизм инкретинов, тем самым пролонгируя взаимодействие инкретинов с собственными рецепторами и их физиологическое действие, ингибиторы ДПП-4 нормализуют и поддерживают секреторную активность β-клеток.
Продлевая активность эндогенных инкретинов, ингибиторы ДПП-4 обладают исключительно глюкозозависимым механизмом действия, благодаря чему имеют высокую степень безопасности в отношении гипогликемии, что крайне важно для пациентов с хронической болезнью почек, лиц пожилого возраста [5, 6].
По мнению C.F. Deacon, ингибиторы ДПП-4 – один из первых классов пероральных препаратов для лечения СД2, целенаправленно разработанных в качестве антигипергликемических препаратов, в то время как сахароснижающих эффект более традиционных таблетированных средств был обнаружен случайно [6].
Другим значимым эффектом ингибиторов ДПП-4 является направленность на дефекты α-клеток посредством уменьшения гиперглюкагонемии. Этот эффект опосредован повышением секреции инсулина и соматостатина, но не исключается и прямое воздействие ГПП-1 на секреторную функцию α-клеток через собственные рецепторы [2, 3]. Подтверждением прямого действия ГПП-1 на α-клетки поджелудочной железы является тот факт, что у больных СД 1 типа введение ГПП-1 также подавляло секрецию глюкагона и снижало уровень гликемии. Снижение концентрации глюкагона на фоне повышения уровня инсулина способствует уменьшению продукции глюкозы печенью, что в итоге приводит к уменьшению гликемии. Описанный эффект на функцию α-клеток также глюкозозависим [8, 9].
Ингибиторы ДПП-4 отличает сходная степень эффективности по сравнению с другими пероральными сахароснижающими препаратами в отношении снижения уровня гликированного гемоглобина (НbА1c). Этот класс препаратов обладает благоприятным профилем побочных эффектов, сходным с таковым у плацебо [7, 10]. Причем применение ингибиторов ДПП-4 не сопровождается развитием побочных эффектов (увеличение массы тела, гипогликемия, побочные эффекты в отношении желудочно-кишечного и урогенитального трактов), обычно ассоциирующихся с другими сахароснижающими средствами. Поэтому ингибиторы ДПП-4 все чаще применяют при инициации сахароснижающей терапии: в качестве монотерапии при невозможности применения метформина (противопоказания, непереносимость) или в комбинации с метформином, а также при интенсификации терапии при неудовлетворительном гликемическом контроле на фоне монотерапии метформином в качестве препаратов второй линии [9, 11]. Следует отметить, что ингибирование фермента ДПП-4 позволяет преодолевать некоторые проблемы, связанные с использованием аналогов рецептора ГПП-1, в частности режима введения (инъекции) и таких побочных эффектов, как тошнота и рвота [4, 7, 11].
С появлением группы ингибиторов ДПП-4 существенно расширились возможности терапии СД2. В связи с хорошей эффективностью, низким риском гипогликемий и появлением побочных эффектов и влиянием на массу тела, простотой применения и дозированием ингибиторы ДПП-4 получили широкое распространение [6, 10, 11]. Ингибиторы ДПП-4 существенно различаются по своим химическим и фармакокинетическим свойствам (табл. 1) и являются активно развивающимся классом сахароснижающих средств.

Клинические возможности алоглиптина
Алоглиптин – высокоселективный нековалентный ингибитор ДПП-4 (по химической структуре модифицированный пиримидиндион), который не подвергается интенсивному метаболизму (рис. 1). Его избирательность в отношении ДПП-4 более чем в 10 тыс. раз превосходит его действие в отношении других родственных ферментов, включая ДПП-2, ДПП-8 и ДПП-9 [12, 13]. Алоглиптин имеет длительный период полувыведения (12–22 часа), что обеспечивает стойкое ингибирование ДПП-4 при приеме один раз в сутки, подвергается ограниченному метаболизму в печени при участии ферментов CYP2D6 и CYP3A4В с образованием активного метаболита М-I (<1%), являющегося ингибитором ДПП-4, и неактивного метаболита M-II (<6%). Препарат выводится преимущественно в неизмененном виде почками (60–71% вещества) [13]. Наиболее важным для сахароснижающей активности ингибиторов ДПП-4 является ГПП-1, концентрация которого возрастает на фоне применения алоглиптина в 2–3 раза [18].

Эффективность и безопасность
Ранее в рандомизированных плацебо-контролируемых исследованиях была подтверждена клиническая эффективность и безопасность применения алоглиптина по сравнению с плацебо и другими сахароснижающими препаратами (метформин, препараты сульфонилмочевины, инсулин) при применении в разных режимах (монотерапия, двойная и тройная комбинированная терапия) [13]. При применении алоглиптина в виде монотерапии (в дозе 25 мг) разница в уровне HbA1c по сравнению с группой плацебо составляла -0,57 и -0,76% (соответственно через 12 или 26 недель лечения) [14, 15]. В целом, с учетом динамики на плацебо при добавлении алоглиптина в дозе 25 мг пациентам, не достигшим целевых значений гликемии на предшествовавшей терапии, снижение уровня HbA1c составило от -0,4 до -1,71% [13, 16].
Результаты мета-анализа 43 контролируемых исследований A. Capuano (n=10 467 пациентов) свидетельствуют о том, что на фоне приема алоглипина 43% больных СД2 достигли целевого уровня HbA1c (по сравнениюи с 37% на фоне применения вилдаглиптина, 38% – ситаглиптина и 38% – саксаглиптина) [17].
Исходя из прогрессирующего характера заболевания, заслуживает внимания длительность удержания сахароснижающего эффекта лекарственного средства. В исследованиях продолжительностью 104 недели было показано, что эффективность алоглиптина сохраняется на протяжении этого длительного времени [18]. Уникальность ингибиторов ДПП-4 состоит в потенциальной способности сохранять функцию β-клеток. В этом плане интерес представляет возможность ГПП-1 подавлять апоптоз, активировать неогенез β-клеток путем стимуляции дифференцировки клеток из дуктальных протоков поджелудочной железы и наконец пролиферацию β-клеток. Это в целом исключает воздействие на снижение β-клеточной массы, которое характеризует течение СД2 и требует интенсификации сахароснижающей терапии [3, 8]. В отношении ГИП известно, что его антиапоптотическое действие на β-клетки включает активацию CRE B (транскрипционного фактора, способного связывать CRE-последовательности ДНК и регулировать экспрессию генов) и протеинкиназы B [19]. Подобные механизмы могут иметь весомое значение в отношении долгосрочного сахароснижающего эффекта препаратов с инкретиновой активностью, что, несомненно, требует проведения дальнейших исследований в этом перспективном направлении.
Ввиду ограниченной эффективности монотерапии рациональность комбинации сахароснижающих препаратов – важнейшая составляющая успешного лечения СД2. С позиций эффективности и безопасности большой интерес представляет комбинация метформина и ингибитора ДПП-4, которая оказывает влияние на два ключевых патофизиологических механизма СД2, а также содружественный эффект на энтероинсулярную ось. Механизм действия ингибиторов ДПП-4 дополняет основные фармакологические эффекты метформина, которые включают снижение эндогенной продукции глюкозы печенью и улучшение чувствительности периферических тканей к инсулину [20]. Дополнительным аргументом в пользу применения такой комбинации является способность метформина усиливать секрецию ГПП-1, что в присутствии ингибиторов ДПП-4 приводит к дальнейшему повышению концентрации активного ГПП-1 [21].
Клиническая эффективность и низкий риск гипогликемии комбинации метформина и алоглиптина не вызывают сомнений и подтверждены результатами клинических исследований, в которых показано улучшение показателей НbА1c и отсутствие прибавки массы тела [22]. Комбинация алоглиптина и метформина обеспечивает снижение уровня HbA1c на 1,55%. Сочета-ние алоглиптина и метформина – препаратов с наиболее безопасным профилем с разным механизмом действия, взаимно дополняющих эффекты друг друга, воплотилось в создании эффективной фиксированной комбинации. Несомненно, упрощение схемы лечения, удобный режим дозирования представляют собой одну из эффективных стратегий лечения заболевания, сокращают возможность отклонений от режима приема и соблюдения конкретных дозировок препаратов. Важно, что такая комбинация характеризуется низким риском развития гипогликемий. Уместно напомнить, что применение метформина непосредственно не вызывает высвобождения инсулина, а в свою очередь ингибиторы ДПП-4 обладают глюкозозависимым сахароснижающим эффектом (т.е. оказывают влияние на β-клетки только при повышенном уровне гликемии). Причем в исследованиях доказано, что при применении алоглиптина улучшалась функция β- клеток и увеличивалась их масса, что свидетельствует о влиянии алоглиптина на пролиферацию β-клеток [37–40]. Кроме того, метформин и ингибиторы ДПП-4 нейтральны по влиянию на массу тела, что также служит существенным преимуществом этих препаратов и их комбинаций [17, 19].
Достаточно часто на практике используется комбинация метформина и препаратов сульфонилмочевины (ПСМ) с высоким сахароснижающим потенциалом, хотя прием последних нередко ассоциирован с прибавкой массы тела и увеличением риска гипогликемических эпизодов (табл. 2) [6]. Гипогликемии способствуют высокому риску развития кардиоваскулярной патологии, являясь пусковым фактором к активацию системы контринсулярной защиты. Эпизоды гипогликемии провоцируют желудочковые аритмии у пациентов с СД2 [23].
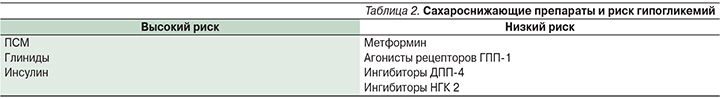
Пристального внимания заслуживает исследование ENDURE (Efficacy and Safety of Alogliptin Plus Metformin Compared to Glipizide plus Metformin in Patients With Type 2 Diabetes Melitus) – двухлетнее многоцентровое рандомизированное двойное слепое исследование, в котором сравнивали долгосрочную эффективность и безопасность комбинации метформина с алоглиптином (применяемым в 2 дозировках) и с глипизидом у пациентов, не достигших гликемического контроля на монотерапии стабильной дозой метформина [23]. Исследование интересно тем, что препаратом сравнения был глипизид – высокоэффективный ПСМ, а также длительным сроком наблюдения. К 104-й неделе уровень HbA1c снизился на -0,68%, -0,72 и 0,59% в группе алоглиптина 12,5 мг, в группе алоглиптина 25 мг и в группе глипизида соответственно; причем по эффективности алоглиптин 25 мг даже превосходил глипизид (р<0,05, рис. 2). Кроме того, оценивалась натощак концентрация глюкозы плазмы (ГПН). На протяжении всего периода лечения в группах алоглиптина уровень ГПН был ниже исходных значений, в то время как у пациентов, получавших глипизид, средний уровень ГПН был выше исходного уровня в период между 39-й и 52-й неделями лечения и оставался высоким до конца наблюдения. Концентрация ГПН снизилась на 0,05 и 0,18 ммоль/л в группе алоглиптина 12,5 мг и в группе алоглиптина 25 мг соответственно. В группе глипизида ГПН увеличился на 0,3 ммоль/л (p<0,001 при сравнении обеих групп алоглиптина с глипизидом).
Несмотря на небольшую дозу глипизида, принимаемого на протяжении всего исследования ENDURE, частота гипогликемии и отказа от продолжения терапии вследствие нее была выше в группе глипизида по сравнению с группами алоглиптина. В частности, у 23,2% пациентов, получавших терапию глипизидом, зафиксированы гипогликемические состояния. Напротив, риск гипогликемии на фоне терапии алоглиптином очень низок (у 2,5 и 1,4% пациентов группы алоглиптина 12,5 и 25 мг алоглиптина соответственно зарегистрированы гипогликемии). Действительно, сахароснижающий эффект ингибиторов ДПП-4 характеризуется строгой глюкозозависимостью, в то время как ПСМ стимулируют секрецию инсулина даже при низком уровне гипогликемии. Это различие механизма действия обусловливает низкий риск гипогликемии на фоне терапии ингибиторами ДПП-4 [6].
Среднее изменение массы тела составило -0,68, -0,89 кг у пациентов, получавших алоглиптин 12,5 и 25 мг соответственно. В группе ПСМ масса тела увеличилась на 0,95 кг (р<0,001 для обоих сравнений с глипизидом).
Для практики важно, что алоглиптин характеризуется эффективностью, сопоставимой с ПСМ, и очень низким риском развития гипогликемий, нейтральным влиянием на массу тела, что представляет собой значимое клиническое преимущество перед другими сахароснижающими препаратами. Однако при совместном применении алоглиптина с ПСМ или инсулином риск гипогликемии может увеличиваться вследствие присущих другим препаратам сахароснижающих свойств, в этой ситуации следует снизить дозы ПСМ или инсулина.
Кардиологическая безопасность в исследовании ENDURE оценивалась по частоте развития событий первичной конечной точки, которая включала сердечно-сосудистую смерть, нефатальный ИМ и нефатальный инсульт. По результатам исследования частота больших сердечно-сосудистых событий на фоне терапии алоглиптином и глипизидом на протяжении 104 недель была схожей.
Кардиоваскулярная безопасность алоглиптина
Кардиоваскулярные заболевания являются одной из значимых проблем для пациентов с СД. Учитывая сложные патофизиологические связи между СД2 и заболеваниями, связанными с атеросклерозом, особое значение для всех имеющихся в практике сахароснижающих средств приобретает не только их способность обеспечивать эффективный гликемический контроль, но и их влияние на сердечно-сосудистый риск у больных СД2 [25]. Среди больных СД2 распространенность ишемической болезни сердца в 2–4 раза, риск развития острого инфаркта миокарда в 6–10, а мозговых нарушений в 4–7 раз выше, чем среди лиц без диабета [26, 27]. Причем атеросклеротический процесс у больных СД2 начинается раньше, протекает тяжелее и имеет генерализованный характер [28].
Итак, чрезвычайно большое внимание следует уделять терапии пациентам с СД2 в сочетании с сердечно-сосудистой патологией. Наиболее глубоко вопросы кардиоваскулярной безопасности алоглиптина освещены в исследовании EXAMINE с участием пациентов (n=5380) с очень высоким сердечно-сосудистым риском (недавно перенесших острый коронарный синдром [ОКС]) [29].
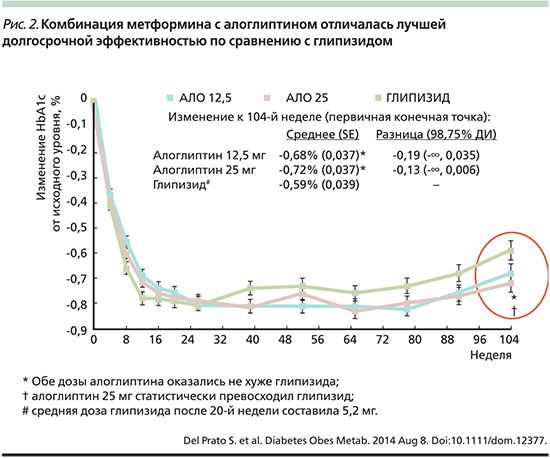
Плацебо-контролируемое исследование безопасности EXAMINE (Examination of Cardiovascular Outcomes With Alogliptin Versus Standard of Care) было посвящено изучению долгосрочного влияния алоглиптина на клинически значимые исходы (сердечно-сосудистая смерть, нефатальный инфаркт миокарда или нефатальный инсульт). В исследование были включены пациенты (алоглиптин, n=2701; плацебо, n=2679), перенесшие ОКС (острый инфаркт миокарда или госпитализацию по причине нестабильной стенокардии за 15–90 дней до рандомизации и получали любую сахароснижающую терапию, за исключением аналогов ГПП-1 и ингибиторов ДПП-4; уровень HbA1c при включении в исследование составлял 6,5–11%).
В группе алоглиптина частота развития событий первичной конечной точки составила 11,3% (305 событий) и была сопоставимой с 11,8% (316 событий) в группе плацебо (относительный риск [ОР]=0,96 с верхней границей одностороннего доверительного интервала [ДИ] – 1,16; рис. 3). Алоглиптин у пациентов с СД2 и ОКС не увеличивал риска общей и сердечно-сосудистой смерти по сравнению с плацебо.
Высокая внутрибольничная смертность от инфаркта миокарда при СД в первую очередь связана с более частым развитием застойной сердечной недостаточностью. Повышенный риск смерти у больных СД сохраняется в течение нескольких лет после перенесенного ОКС [28]. Поэтому информация была бы неполной без результатов подгруппового анализа: у пациентов без сердечной недостаточности, а также у пациентов с сердечной недостаточностью в анамнезе и/или с повышенным уровнем мозгового натрийуретического пептида (МНП) кумулятивная частота смерти от сердечно-сосудистых причин и госпитализаций по поводу сердечной недостаточности в группе алоглиптина была сопоставимой с плацебо (ОР=0,98, 95% ДИ – 0,82–1,21), а уровень МНП не отличался от исходного.
На фоне терапии алоглиптином также не отмечено увеличения риска развития панкреатита и рака подже-лудочной железы.
Нельзя не отметить преимущества алоглиптина как препарата, обеспечивающего не только эффективный и безопасный гликемический контроль, но и обладающего благоприятным сердечно-сосудистым профилем. Результаты исследования EXAMINE подтверждают профиль кардиоваскулярной безопасности алоглиптина для пациентов с высоким риском сердечно-сосудистых осложнений: у больных, недавно перенесших ОКС, частота больших сердечно-сосудистых событий не увеличивается при применении алоглиптина.
Все еще остается открытым вопрос о возможных плейотропных эффектах ингибиторов ДПП-4, особенно в отношении кардиоваскулярной системы.
С одной стороны, помимо сахароснижающей активности существуют данные о непосредственном влиянии ГПП-1 на сердечно-сосудистую систему, эффекты которого пролонгируются при применении ингибиторов ДПП-4. В частности, влияние ингибиторов ДПП-4 на ГПП-1 обусловливает улучшение сократительной функции миокарда у больных СД2 и сердечной недостаточностью [30].
С другой стороны, и через другие свои субстраты (факторы роста, хемокины, нейропептиды и вазоактивные пептиды) ингибиторы ДПП-4 могут оказывать кардиопротективное действие [30, 31]. Однако подобные механизмы ингибиторов ДПП-4 требуют уточнения.
Применение алоглиптина при длительном течении СД2 и в особых клинических ситуациях
Со временем масса β-клеток снижается и падает их способность секретировать инсулин, сопутствующая дисфункция α-клеток поджелудочной железы также затрудняет гликемический контроль. На этом этапе прогрессирования СД2, обсуждая эффективность применения ингибиторов ДПП-4 в комбинации с инсулином (с/без метформина), нельзя обойти вниманием способность ГПП-1 снижать секреции глюкагона, что разбиралось выше.
За счет подавления секреции глюкагона алоглитин оказывает сахароснижающий эффект у пациентов с «поздним» СД2, получающих инсулинотерапию. Согласно результатам клинических исследований, применение алоглитина может приносить дополнительную пользу пациентам, поскольку дает возможность уменьшать суточную дозу инсулина, что препятствует увеличению массы тела и повышает безопасность терапии в отношении гипогликемий [17, 18].
Нельзя обойти вниманием и применение алоглиптина пациентами пожилого возраста с СД2, наиболее уязвимыми в отношении гипогликемий. Согласно рекомендациям по выбору сахароснижающей терапии лицами пожилого возраста, предпочтение имеют препараты группы ингибиторов ДПП-4 как наиболее безопасные в отношении развития гипогликемии и возможности применения при любой стадии хронической болезни почек.
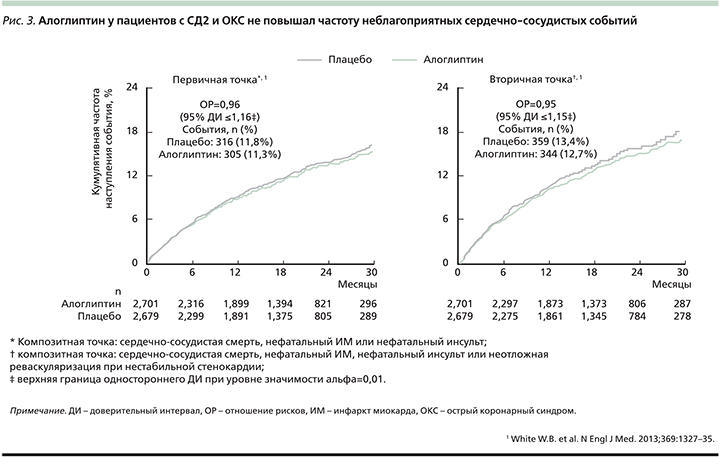
В отношении тактики ведения пациентов пожилого возраста с СД2 заслуживают внимания исследования, продемонстрировавшие эффективность и безопасность применения алоглиптина больными такой сложной категории [6, 34]. В частности, в рандомизированном активно контролируемом исследовании J. Rosenstock et al. приняли участие пациенты старшего возраста (65–90 лет; n=441) [35]. Все участники были рандомизированы в две группы, различавшиеся по назначенной фармакотерапии: алоглиптин в дозе 25 мг/сут или глипизид 5–10 мг/сут. К 52-й неделе лечения гипогликемии реже фиксировались в группе алоглиптина (рис. 4) по сравнению с группой глипизида при сходной степени улучшения уровня НbА1c (изменение уровня HbA1c к концу наблюдения -0,42% на алоглиптине и -0,33% на глипизиде). Более того, большее число пациентов достигли целевого уровня HbA1c≤7,0 и ≤6,5% на фоне терапии алоглиптином по сравнению с глипизидом. Терапия алоглиптином приводила к статистически значимому снижению массы тела в отличие от терапии глипизидом. Post hoc-анализ показал, что пропорция пациентов, достигших HbA1c≤7,0% без гипогликемии или прибавки массы тела была достоверно выше в группе алоглиптина по сравнению с таковой глипизида (24 по сравнению 13%; р<0,03) [36].
Заключение
В заключение следует отметить, что применение ингибиторов ДПП-4 стало общепринятой практикой при проведении фармакотерапии СД2.
Алоглиптин – эффективное сахароснижающее средство с низким риском гипогликемий, благоприятным сердечнососудистым профилем безопасности, нейтральным влиянием на массу тела и удобным применением. Чрезвычайно большое внимание следует уделять терапии пациентов с СД2 в сочетании с сердечно-сосудистой патологией, алоглиптин продемонстрировал благоприятный сердечно-сосудистый профиль безопасности даже для пациентов с очень высоким риском развития кардиоваскулярной патологии.



