Лекарственно-индуцированные интерстициальные поражения легких (ЛИИПЛ) являются одной из наиболее частых форм лекарственных пневмопатий и составляют около 3% в структуре всех интерстициальных заболеваний легких (ИЗЛ) [1, 2]. Среди лекарственных средств амиодарон – один из самых частых причиннозначимых препаратов, ассоциированных с развитием ЛИИПЛ [1, 3].
Амиодарон был синтезирован и внедрен в клиническую практику в 1960-е гг. первоначально как антиангинальное средство, позже был обнаружен его антиаритмический потенциал. До настоящего времени амиодарон является широко используемым антиаритмическим препаратом во всем мире в силу его высокой эффективности в лечении суправентрикулярных и желудочковых аритмий по сравнению с другими антиаритмическими средствами [4]. Кроме того, амиодарон обладает крайне низкой отрицательной инотропной активностью и минимальным проаритмогенным желудочковым эффектом, что обусловливает его преимущество при использовании пациентами с сердечной недостаточностью [5]. Вместе с тем почти 50-летняя история применения амиодарона сопровождается относительно высокой частотой побочных эффектов и затрудняет безопасное использование этого препарата в клинической практике.
В основе амиодарон-индуцированного поражения легких (АИПЛ) лежат механизмы прямого токсического действия препарата на пневмоциты либо гиперчувствительность, опосредованная иммунологическими реакциями [1, 6]. Прямая токсичность амиодарона обусловлена его выраженной липофильностью и нарушением нормального метаболизма эндогенных фосфолипидов, которые на фоне длительного приема амиодарона накапливаются в различных органах-мишенях: легких, глазах, щитовидной железе, печени, коже, нервной системе [7]. Побочные эффекты амиодарона составляют около 15% в течение первого года примене-ния и могут увеличиваться до 50% при более длительном его приеме [5]. С прогностической точки зрения пневмотоксичность – самый серьезный побочный эффект терапии амиодароном [1, 8].
Патогенетическим синонимом АИПЛ является термин «фосфолипидоз легких», что обусловлено способностью метаболитов амиодарона связывать липиды лизосом альвеолярных макрофагов, вызывать нарушение катаболизма фосфолипидов, которые откладываются в виде пластинчатых телец в альвеолах, приводя к замедлению диффузии газов через альвеолярную мембрану. Исследования последних лет доказывают возможность развития фиброза при «амиодароновом» легком [1, 3, 9].
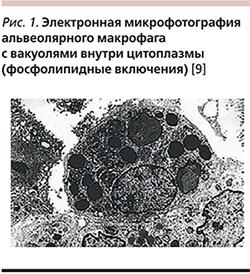 Характерным признаком АИПЛ слжит обнаружение пенистых альвеолярных макрофагов, содержащих два типа аномальных вакуолей, выявляемых при электронной микроскопии: маленькие пустые вакуоли и пластинчатые включения, представляющие собой крупные фаголизосомы, содержащие фосфолипиды – амиодаронфосфолипидный комплекс (рис. 1).
Характерным признаком АИПЛ слжит обнаружение пенистых альвеолярных макрофагов, содержащих два типа аномальных вакуолей, выявляемых при электронной микроскопии: маленькие пустые вакуоли и пластинчатые включения, представляющие собой крупные фаголизосомы, содержащие фосфолипиды – амиодаронфосфолипидный комплекс (рис. 1).
К особенностям фармакокинетики амиодарона можно отнести характерный для него профиль легочной токсичности, что во многом связано с очень длительным периодом полувыведения – в течение 6–12 месяцев. Поэтому для АИПЛ в большинстве случаев типично медленное начало, вялотекущее улучшение после отмены препарата, возможное развитие или рецидив симптомов после прекращения приема [1, 9, 10].
К факторам риска амиодароновой пневмотоксичности наиболее часто относят высокую кумулятивную дозу препарата, суточную дозу ≥200 мг, продолжительность терапии свыше 2 месяцев, пожилой возраст пациента, мужской пол, патологию легких, оксигенотерапию, любое серьезное хирургическое вмешательство и легочную ангиографию [11, 12]. Кроме того, амиодарон – это мощный ингибитор системы цитохрома, что следует учитывать при анализе лекарственных взаимодействий.
Хотя острое повреждение легких при приеме амиодарона в целом встречается редко, тем не менее оно может развиться через несколько дней после внутривенного введения высоких доз препарата. Случаи острого АИПЛ описаны после оперативных вмешательств на сердце или легких. Наркоз, оксигенотерапия и механическая вентиляция служат дополнительным фактором риска острого АИПЛ [1, 8, 9]. Оно манифестирует одышкой, тяжелой гипоксемией, картиной острого респираторного дистресс-синдрома (ОРДС), диффузными альвеолярными и интерстициальными затемнениями, выявляемыми при лучевой диагностике.
Хроническая форма «амиодаронового» легкого развивается примерно у 0,1% пациентов, получающих низкие дозы, и значительно чаще (до 50%) у больных, длительно использующих высокие дозы препарата [10].
Таким образом, АИПЛ относится к редким формам лекарственной дозозависимой пневмотоксичности, которая, как правило, развивается во временном интервале от нескольких недель до нескольких лет терапии данным препаратом (в среднем через 1–24 месяца). Клиническая картина характеризуется неспецифичными жалобами на сухой кашель, одышку разной степени выраженности, потерю массы тела, недомогание, умеренную лихорадку, иногда – плевральный болевой синдром. При аускультации часто обнаруживаются крепитация и влажные хрипы в легких. Среди лабораторных показателей возможны лейкоцитоз и увеличение уровня лактатдегидрогеназы, что может даже предшествовать клиническим симптомам [1, 10, 11].
Имидж-диагностика характеризуется билатеральными, часто асимметричными интерстициальными или альвеолярными инфильтратами, которые могут вовлекать все легочные поля, включая апикальные зоны. Компьютерная томография высокого разрешения (КТВР) позволяет визуализировать выраженную плотность и уменьшение объема чаще верхней доли правого легкого, а также контралатеральное снижение прозрачности. Иногда могут встречаться одиночные или множественные субплевральные участки поражения легочной ткани и соответствующее им утолщение плевры. Реже встречаются двусторонние апикальные образования по типу формирования неоднородных узлов [9, 13, 14].
Вероятность диагноза АИПЛ значительно возрастает при наличии документированной нормальной рентгенографии легких до назначения препарата и при развитии ИЗЛ на фоне терапии амиодароном или после ее прекращения. Безусловно, что при этом должны исключаться и другие потенциальные причины легочных изменений [2, 10]. АИПЛ может манифестировать несколькими вариантами поражения паренхимы: интерстициальными пневмониями, эозинофильными пневмониями, ОРДС, диффузными альвеолярными геморрагиями, узловой формой [1, 9, 15, 16]. В редких случаях в патологический процесс может вовлекаться плевра [17]. Наиболее частым вариантом «амиодаронового» легкого является интерстициальное поражение по типу организующейся и/или неспецифической интерстициальной пневмонии [1, 9, 18, 19].
Клиническое наблюдение 1
Пациент Н. 67 лет госпитализирован в пульмонологическое отделение с направительным диагнозом «диссеминированный процесс в легких неясной этиологии».
Жалобы на сухой приступообразный кашель, одышку при незначительной физической нагрузке, общую слабость, потливость, вечерние подъемы температуры до 38,6°С.
Из анамнеза заболевания: вышеперечисленные жалобы беспокоят в течение 3,5 месяцев. Дважды за этот период находился на стационарном лечении с диагнозом «двусторонняя полисегментарная пневмония, двусторонний малый гидроторакс». Получал антибактериальные препараты (цефтриаксон, сульперазон, кларитромицин, цефтаролин, ванкомицин, метронидазол), противогрибковый препарат флуконазол, проводимая терапия – без какого-либо клинического эффекта. Осмотрен фтизиатром, данных за туберкулез не выявлено.
Из анамнеза жизни: не курит и никогда не курил, в прошлом офисный служащий, профессиональных вредностей не было. В настоящее время пенсионер, проживает в квартире без кондиционера и признаков загрязнения плесневыми грибами, домашние животные и птицы отсутствуют. Ранее по поводу хронических заболеваний дыхательной системы не наблюдался. Травмы, операции отрицает. Туберкулезом, гепатитом не болел. Сопутствующая патология: ишемическая болезнь сердца, стенокардия напряжения, постоянная форма фибрилляции предсердий, нормоформа, хроническая сердечная недостаточность. Артериальная гипертензия 4-й стадии, риск 4. Постоянно принимает торасемид 2,5 мг, аторвастатин 20 мг, апиксабан 5 мг 2 раза, в сутки амиодарон 200 мг. Перечисленные препараты принимает около 2,5 лет.
При объективном осмотре кожные покровы обычного цвета, влажные, отеков нет, периферические лимфоузлы не пальпируются. Костно-суставная и мышечная системы без видимых изменений. Частота дыхания – 20 в минуту. При аускультации в легких дыхание везикулярное, в задненижних отделах крепитация с обеих сторон, единичные жужжащие хрипы. Тоны сердца аритмичные, приглушены, шумов нет. Частота сердечных сокращений (ЧСС) – 117 в минуту. Артериальное давление (АД) – 110/70 мм рт.ст.
По результатам пульсоксиметрии насыщение крови кислородом (SрО2) – 92% с десатурацией на физическую нагрузку до 83%.
При обследовании в предшествовавшие и настоящую госпитализации: в общем анализе крови (ОАК) лейкоцитоз – 11,4–17,6×109 л, палочкоядерный сдвиг однократно до 20%, СОЭ – 38–45 мм/ч. Общий анализ мокроты: слизистая, лейкоциты – 10–15 в поле зрения, единичные эритроциты, кислотоустойчивые микобактерии (КУМ) не обнаружены. В динамике эритроцитов нет. В посевах мокроты непатогенная флора. С-реактивный белок (СРБ) – 81–121 мг/л. Данных за гепатиты, ВИЧ-инфекцию не обнаружено. Лабораторный скрининг на системные заболевания соединительной ткани не выявил диагностически значимого повышения титра антител.
Спирометрия: объем форсированного выдоха за первую секунду (ОФВ1) – 88% от должного, форсированная жизненная емкость легких (ФЖЕЛ) – 77%, ОФВ1/ФЖЕЛ – 86%.
КТВР легких: полисегментарные инфильтративные изменения обоих легких по типу «матового стекла» с участками консолидации, медиастинальная лимфоаденопатия – 14–16 мм, буллы нижней доли слева, пневмосклероз, локальный кальциноз в области куполов диафрагмы (рис. 2). При сравнении с КТВР предыдущей госпитализации без существенной динамики.
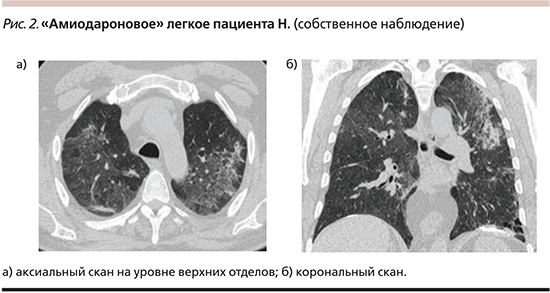
С учетом данных лекарственного анамнеза (длительный прием амиодарона), клинической картины (непродуктивный кашель и одышка при незначительной физической нагрузке), КТВР, свидетельствующей об интерстициальном характере поражения легких, соответствующем неспецифической интерстициальной пневмонии, спирометрии, указывающей на рестриктивные нарушения, и исключении других возможных причин ИЗЛ был установлен диагноз амиодарон-индуцированного ИЗЛ, подострое рецидивирующее течение. Дыхательная недостаточность (ДН) I–II.
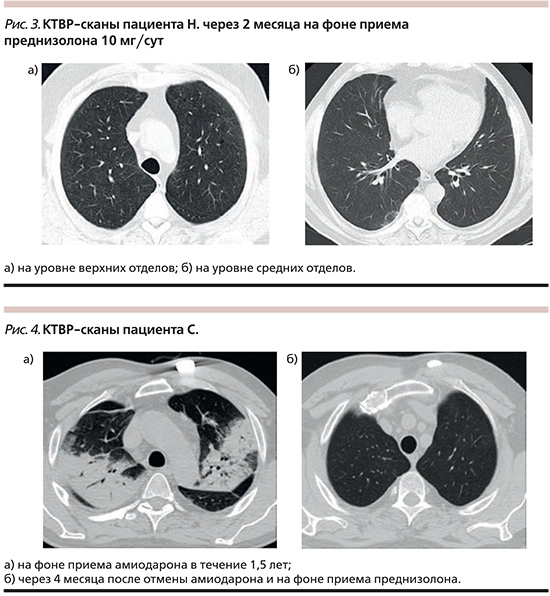
Пациенту был отменен амиодарон и назначена терапия преднизолоном перорально в стартовой дозе 0,5 мг/кг массы тела – 50 мг/сут с рекомендациями постепенного снижения дозы преднизолона. Пациент был выписан через неделю со значительной положительной клинико-функциональной и рентгенологической динамикой. Через 2 месяца на контрольном осмотре пациент жалоб не предъявлял. Параметры спирометрии со значительным улучшением: ФЖЕЛ – 96%, ОФВ1 – 104%, ОФВ1/ФЖЕЛ – 83%. SрО2 – 97% без десатурации на физическую нагрузку. КТВР в динамике: единичные склеротические тяжи в субплевральных зонах, буллы нижней доли слева (рис. 3).
Клиническое наблюдение 2
Пациент С. 64 лет госпитализирован (переведен из отделения торакальной хирургии) в пульмонологическое отделение с направительным диагнозом «облитерирующий бронхиолит». Жалобы на одышку при умеренной физической нагрузке, кашель в течение дня с отделением мокроты слизистого характера в небольшом количестве, общую слабость, выраженную потливость по ночам, повышение температуры до 38°С.
Из анамнеза заболевания: считает себя больным в течение 6 месяцев, когда впервые стал отмечать непродуктивный кашель, слабость, потливость, постепенно нарастающую одышку, периодически повышение температуры тела до 38,5°С. На фоне приема парацетамола отмечал некоторое снижение температуры тела. За последние 5 месяцев трижды госпитализирован в терапевтическое отделение с диагнозом «двусторонняя пневмония», антибактериальная терапия без клинико-рентгенологического улучшения. На КТВР легких в тот период отмечались (рис. 4а) участки консолидации в верхних долях обоих легких, средней и левой нижней долей, в прикорневых и кортикальных отделах неправильной формы с отчетливыми контурами. На фоне безвоздушной паренхимы видны просветы бронхов. Паратрахеальные и бифуркационные лимфоузлы увеличены до 11–13 мм.
В связи с неэффективностью длительной антибактериальной терапии консультирован фтизиатром, по рекомендации которого была проведена биопсия легкого. Результаты гистологического исследования: участки карнификации, лимфоидная инфильтрация интерстиция, поля макрофагальной пневмонии, наличие плотных белковых масс в просветах альвеол с реакцией альвеолярных макрофагов, воспалительная инфильтрация в стенках бронхиол с врастанием грануляционной ткани в просветы с наличием телец Массона. Заключение: облитерирующий бронхиолит с организующейся пневмонией.
Из анамнеза жизни: работал инженером, профессиональных вредностей не выявлено. В течение последних 10 лет пациента беспокоили приступы учащенного аритмичного сердцебиения, сопровождавшиеся внезапным затруднением дыхания, падением АД, продолжительностью от нескольких часов до суток, купировались самопроизвольно или бригадой скорой медицинской помощи. Два года назад пациенту выполнена радиочастотная аблация ганглионарных сплетений левого предсердия и кавотрикуспидального перешейка, имплантирован аппарат длительного суточного мониторирования ритма сердца. После операции сохранялись пароксизмы фибрилляции – трепетания предсердий продолжительностью до 20 часов в сутки 1–3 раза в 3 месяца, в связи с чем пациенту был назначен амиодарон. Последние 18 месяцев регулярно получал амиодарон 200 мг/сут, бисопролол 2,5, эналаприл 5, лозап 12,5 мг/сут.
При объективном осмотре сознание ясное, положение активное. Цвет кожи без особенностей, отеков нет. Кожные покровы влажные. Периферические лимфоузлы не пальпируются. Частота дыхания – 17 в минуту. При аускультации в легких дыхание ослабленное везикулярное. Тоны сердца ритмичные, ЧСС – 72 в минуту, АД – 115/70 мм рт.ст.
При обследовании в предшествовавшие и настоящую госпитализации: ОАК и биохимические показатели сыворотки без патологических отклонений, СРБ – 5 мг/л. В общем анализе мокроты лейкоциты единичные в поле зрения, КУМ не обнаружены. Данных за гепатиты, ВИЧ-инфекцию нет.
Спирометрия: ФЖЕЛ – 89%, ОФВ1 – 88%, ОФВ1/ФЖЕЛ – 75%. SрО2 – 93% с десатурацией на физическую нагрузку до 85%.
На основании клинических данных, лекарственного анамнеза (прием амиодарона – 18 месяцев), КТВР, морфологической верификации организующейся пневмонии и исключения других возможных причин ИЗЛ был установлен диагноз амиодарон-индуцированного ИЗЛ, подострое рецидивирующее течение. ДН I–II.
С первого дня госпитализации в пульмонологическое отделение пациенту отменен амиодарон и назначена терапия преднизолоном перорально в дозе 0,5 мг/кг массы тела – 45 мг/сут на 1 месяц с последующим постепенным снижением, выписан со значительной положительной клинической динамикой. При выполнении КТВР легких через 4 месяца после отмены амиодарона и снижении дозы преднизолона до 5 мг/сут отмечена значительная положительная динамика в виде исчезновения участков консолидации легочной ткани (рис. 4б).
На фоне отсутствия рецидивирующих респираторных симптомов и «рентгенологического выздоровления» преднизолон отменен, рекомендовано наблюдение у кардиолога, аритмолога.
Клиническое наблюдение 3
Пациент Р. 65 лет. При поступлении в пульмонологическое отделение предъявлял жалобы на приступообразный непродуктивный кашель днем и в ранние утренние часы, одышку при незначительной физической нагрузке (подъем на 2-й этаж), похудение на 3 кг за 6 месяцев.
Из анамнеза заболевания: в течение 2 лет беспокоит редкий кашель, в последние 6 месяцев кашель участился и стал более интенсивным как в дневное, так и в ночное время, нарастающая одышка, периодически испытывает свистящее дыхание. Дважды за последние полгода лечился с диагнозом «правосторонняя полисегментарная пневмония». В ОАК лейкоциты – 6,1–8,4×109 л, эозинофилы от 2,5 до 6,6%, в остальном формула без особенностей, СОЭ – 8–24 мм в час. Биохимические показатели крови без особенностей, СРБ – 3 мг/л. В цитологическом анализе мокроты лейкоциты – 10–12 в поле зрения, КУМ не обнаружены.
По данным рентгенографии органов грудной клетки, справа отмечено неравномерное снижение прозрачности легочной ткани за счет инфильтрации, на фоне которой просматривались мелкоочаговые тени. В связи с подозрением на диссеминированный туберкулез легких или опухоль правого легкого проведено обследование в областной туберкулезной больнице и онкологическом диспансере, где предполагаемые заболевания были исключены, а пациент направлен в пульмонологическое отделение с диагнозом «пневмония?» для дальнейшего обследования и лечения.
Из анамнеза жизни: пенсионер, работал водителем, экскурильщик, не курит 30 лет, индекс табакокурения – 15 пачка/лет. Из сопутствующей патологии страдает ишемической болезнью сердца, персистирующей формой фибрилляции предсердий, артериальной гипертензией. Длительное время (около 5 лет) ежедневно принимает бисопролол 2,5 мг, индапамид 2,5 мг, эналаприл 10 мг, варфарин 2,5 мг. В течение последних 8 месяцев принимает амиодарон 200 мг/сут.
При объективном осмотре сознание ясное, положение активное. Кожные покровы обычной окраски и влажности, отеков нет. Периферические лимфоузлы не пальпируются. При аускультации в легких дыхание ослабленное, везикулярное, «нежная» крепитация в базальных отделах с обеих сторон. Частота дыхания – 22 в минуту. SрО2 в покое 92% с десатурацией на физическую нагрузку до 88%. Тоны сердца ритмичные, ЧСС – 68 в минуту, АД – 150/80 мм рт.ст.
Спирометрия: ОФВ1 – 68% от должного, ФЖЕЛ – 74%, ОФВ1/ФЖЕЛ – 88%.
По данным КТВР, визуализируется неравномерное снижение воздушности паренхимы обоих легких (больше справа) по типу «матового стекла» с участками консолидации и мелкоочаговой тотальной диссеминацией, с уплотнением междолькового интерстиция, разнокалиберными сливными очаговыми инфильтратами (рис. 5).
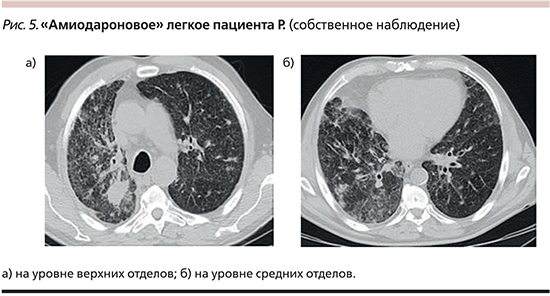
С учетом клинико-рентгенологических данных и лекарственного анамнеза (прием амиодарона – 8 месяцев), рестриктивных нарушений при спирометрическом исследовании и исключении других возможных причин интерстициального поражения легких был поставлен диагноз амиодарон-индуцированного ИЗЛ, подострое рецидивирующее течение. ДН I–II. Лечение: амиодарон отменен, назначен преднизолон перорально в суточной дозе 40 мг. При выписке пациента из стационара (через неделю применения преднизолона) отмечена значительная положительная динамика: кашель и одышка значительно уменьшились, SрО2 в покое 95%, показатели спирометрии увеличились: ОФВ1 – 75%, ФЖЕЛ – 80%, ОФВ1/ ФЖЕЛ – 85%. Пациенту рекомендовано продолжить прием преднизолона с последующим постепенным снижением дозы, КТВР легких в динамике через 3 месяца с последующим решением вопроса об отмене преднизолона.
Обсуждение
Ключевые признаки, на которые опирается диагностика АИПЛ, как уже отмечалось, включают [9]:
- возникновение или усиление одышки, кашля, снижения массы тела у пациента, принимающего ≥200 мг амиодарона в сутки на протяжении 6–12 месяцев;
- появление на «матового стекла» или ретикулярных изменений;
- отсутствие признаков сердечной недостаточности;
- исключение легочной инфекции и других ИЗЛ;
- обнаружение пенистых макрофагов в жидкости бронхоальвеолярного лаважа (непатогномоничный признак, но его отсутствие делает диагноз маловероятным);
- клиническое и рентгенологическое улучшение на фоне прекращения приема амиодарона.
В представленных нами наблюдениях во всех случаях установлен диагноз ИЗЛ, индуцированного амиодароном, на основании большинства указанных критериев, приведенных выше. Основополагающим признаком в полном соответствии с данными, приводимыми в литературе, является хронологическая взаимосвязь развития респираторных симптомов и терапии амиодороном. При этом продолжительность лечения амиодороном, инициирующим манифестацию клинических проявлений, может существенно варьироваться (см. таблицу).
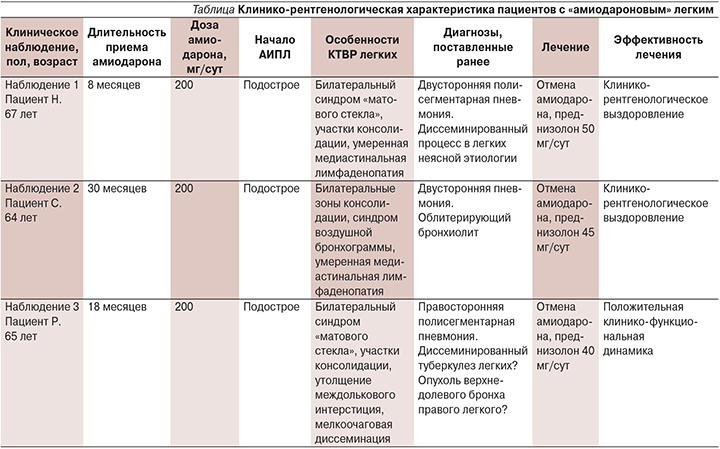
Другим, безусловно важным, критерием диагностики должно быть исключение альтернативной легочной патологии – ИЗЛ, обусловленной профессиональными и другими внешнесредовыми факторами, системными заболеваниями, инфекцией, что исключалось у наблюдаемых нами больных.
Наиболее распространенными вариантами АИПЛ, как уже упоминалось, являются организующаяся и неспецифическая интерстициальная пневмонии. Чаще отмечается острое или подострое течение, характеризующееся непродуктивным кашлем, плевральными болями, лихорадкой, одышкой, что клинически напоминает бактериальную пневмонию [9]. Отсутствие ответа на антибактериальную терапию в такой ситуации является одним из методов дифференциальной диагностики. Как видно из таблицы, все пациенты неоднократно находились на стационарном лечении с диагнозом «полисегментарная, или двусторонняя, пневмония». Данный факт отражает неспецифичность клинических проявлений ЛИИПЛ, в частности «амиодаронового» легкого, в связи с этим клиническая вероятность такого диагноза подтверждает необходимость детального анализа, в первую очередь лекарственного анамнеза.
Лучевые методы диагностики при АИПЛ, по данным литературы, чаще всего обнаруживают зоны консолидации, иногда с воздушными бронхограммами, а при сочетании с лимфоидной гиперплазией на КТВР выявляются септальные утолщения [1, 9, 20]. Представленные в таблице результаты имидждиагностики описанных клинических наблюдений с высокой степенью вероятностью свидетельствуют о формировании КТВР-паттернов неспецифической интерстициальной пневмонии и/или организующейся пневмонии. В клиническом наблюдении 2 клинико-рентгенологический диагноз амиодарон-индуцированной организующейся пневмонии подтвержден морфологическим исследованием.
Необходимо отметить, что при детальном анализе клинико-анамнестических данных и формировании своевременной настороженности в отношении высокой вероятности АИПЛ, а также с учетом характерных описаний КТВР-признаков организующейся пневмонии гистологической верификации диагноза можно было избежать. Особенно принимая во внимание, что любое торакальное вмешательство (торакотомия в представленном наблюдении) может сопровождаться значительным ухудшением течения или являться индуктором АИПЛ [16, 21].
И наконец, очень важным и даже подтверждающим диагноз АИЛП критерием является положительная клиническая динамика вплоть до полного выздоровления на фоне отмены амиодарона и лечения преднизолоном, что имело место и в наших наблюдениях.
Большинство авторов считают необходимым назначение системных глюкокортикостероидов (СГКС), которые позитивно влияют на разрешение «амиодаронового» легкого, поскольку только отмена препарата в большинстве случаев не сопровождается положительной динамикой легочных изменений [8, 16, 22]. Длительно же сохраняющиеся легочные нарушения, обусловленные амиодароном, как правило, трансформируются в необратимый легочный фиброз. С учетом фармакокинетических особенностей амиодарона продолжительность терапии СГКС должна составлять несколько месяцев с последующим постепенным снижением их дозы. Рецидив «амиодаронового» легкого при быстрой отмене СГКС может иметь более тяжелое течение и плохой ответ на повторную терапию СГКС [1, 6]. Одним из факторов риска рецидива АИПЛ в случае быстрого снижения дозы СГКС рассматривается избыточная масса тела/ ожирение [6], что объясняется высокой липофильностью препарата.
В целом летальность при «амиодароновом» легком составляет менее 10% у амбулаторных пациентов и бывает значительно выше (20–33%) у госпитализированных больных с поздним диагнозом [10] и достигает 50% при ОРДС, ассоциированном с амиодароном [23].
С целью профилактики и ранней диагностики ЛИИПЛ у больных, получающих амиодарон, рентгенография органов грудной клетки, а лучше КТВР должны быть выполнены до назначения препарата и регулярно проводиться каждые 12 месяцев в зависимости от дозы препарата [9]. Кроме того, необходимо проводить мониторинг функции внешнего дыхания, включая оценку диффузионной способности легких – самого раннего функционального признака ИЗЛ, особенно среди пациентов с факторами риска развития АИПЛ. Снижение диффузионной способности легких с нарастающей выраженностью за короткий период является самым ранним функциональным признаком «амиодаронового» легкого [11].
Заключение
Представленные клинические наблюдения свидетельствуют о недостаточной информированности врачей различных специальностей о возможном ЛИИПЛ на фоне приема амиодарона – препарата с известной пневмотоксичностью, что определяет низкий и поздний уровни диагностики лекарственных пневмопатий. Лекарственные пневмопатии являются диагнозом исключения. При подозрении на ЛИИПЛ требуется тщательное исключение возможных причин ИЗЛ, в первую очередь инфекционных поражений легочной ткани, любых экзогенных воздействий на дыхательную систему, отека легких и других поражений легочного интерстиция на фоне сопутствующей патологии, например при системных заболеваниях соединительной ткани, болезнях печени, кишечника, других органов и систем.
Необходимо отметить, что своевременный диагноз ЛИИПЛ в целом и АИПЛ в частности главным образом зависит от информированности и умения врачей анализировать анамнестические данные. В связи с этим чрезвычайно важно для клиницистов проявлять настороженность в отношении возможности лекарственной пневмопатии, чтобы своевременно ее распознать и прекратить использование подозреваемого «виновного» препарата во избежание необратимых последствий и неблагоприятного исхода заболевания.



