Введение
Определенные успехи в терапии бронхиальной астмы (БА) не исключают того, что это распространенное хроническое заболевание остается в числе глобальных проблем человечества [1]. В 2016 г. вышел в свет обновленный доклад программы «Глобальное бремя болезней», согласно которому число больных БА в мире составляет 339 млн человек, а расчетное число лет, прожитых с инвалидностью, составляет 13 млн, что с корректировкой на возраст на 3,6% выше, чем в предыдущее десятилетие [2]. В европейских странах распространенность диагностированной БА у взрослых составляет 5,8%, при этом 50% пациентов не имеют достаточного контроля заболевания [3].
Критерии оценки результатов лечения БА
Стандарты лечения БА, составляющие основу современных зарубежных и отечественных руководств, направлены на достижение основной цели терапии – поддержание полного контроля. Понятие контроля включает не только устранение ежедневных симптомов и ограничений физической активности, но и минимизацию будущего риска обострений БА и неблагоприятных исходов, а также уменьшение ограничения воздушного потока. При этом используемые методы, прежде всего медикаментозные, должны быть безопасными. Понятие степени тяжести также не потеряло своей актуальности. Степень тяжести определяется требуемым объемом терапии и активностью заболевания на фоне лечения. Фактически тяжелой можно считать БА, требующую терапии ступеней 4 и 5 (средние или высокие дозы ингаляционных глюкокортикостероидов – ИГКС в комбинации с β2-агонистами длительного действия – БАДД), согласно Глобальной стратегии по ведению БА GINA (Global Initiative for Asthma), или остается неконтролируемой, несмотря на эту терапию [1]. Существует доля больных БА, для которых возможность достижения полного контроля заболевания остается трудновыполнимой задачей, несмотря на применение максимального объема рекомендованной базисной терапии. В структуре всех больных БА доля таких пациентов не превышает 5–10%, но именно у них регистрируется самая высокая частота обострений, незапланированных визитов к врачу, обращений за неотложной медицинской помощью и госпитализаций. Именно рефрактерная к терапии БА поглощает около 50% всех ресурсов системы здравоохранения, затрачиваемых на заболевание в целом [4–7].

Термин «рефрактерная БА» может быть применим к тяжелой БА, характеризующейся сохранением клинических проявлений (табл. 1) на фоне применения максимальных доз ИГКС в комбинации с БАДД и/или системных КГС. К обязательным условиям ведения пациентов в такой ситуации относятся предварительное исключение альтернативного диагноза, устранение влияния сопутствующих заболеваний, предотвращение воздействия триггерных факторов, достижение высокой приверженности пациента назначенному лечению, улучшение техники ингаляций (рис. 1).

Причины неэффективности лечения БА
Первое, что необходимо сделать, если не удается взять под контроль симптомы заболевания, – это усомниться в правильности диагноза. Внушительный список состояний и заболеваний, симптомы которых перекликаются с симптомами БА, включает, но не ограничивается ими: обструктивные и воспалительные поражения верхних и нижних дыхательных путей, врожденная патология, новообразования, функциональный и психогенный варианты одышки, нейромышечная патология, застойная сердечная недостаточность. Следующим шагом после исключения альтернативного диагноза должен стать комплекс мер по выявлению и устранению различных факторов, включая сопутствующие хронические заболевания, которые могут негативно влиять на течение БА и препятствовать достижению полного контроля. Этот этап может потребовать значительных усилий и времени, поскольку среди таких факторов могут встретиться трудномодифицируемые. С другой стороны, за неэффективностью лечения БА могут скрываться вполне очевидные причины, такие как отсутствие у пациента приверженности назначенному лечению и нарушение техники ингаляционного маневра.
На приверженность пациента предписанному лечению, прежде всего ИГКС, могут влиять ранний дебют БА, статус курильщика, семейный характер заболевания. Исследования показывают, что наличие астматиков в ближайшем окружении ассоциируется с лучшей информированностью пациента о причинах заболевания, клинических проявлениях (включая возможные осложнения), важности регулярной терапии, что усиливает беспокойство о собственном здоровье, повышает приверженность лечению и в результате улучшает контроль БА [10]. Одной из ступеней на пути повышения мотивации пациента к выполнению врачебных рекомендаций является подбор препаратов в таком режиме и такой форме, которые бы вызывали как можно меньше желания нарушать предписанное лечение.
В реальной клинической практике, когда встречи пациента с врачом происходят редко, не проводятся регулярные тренинги по использованию ингаляторов (или не проводятся вообще) и редко объясняется важность соблюдения правил и режима приема препаратов, мы часто сталкиваемся с неэффективностью лечения. Оказывается, до 76% пациентов, пользующихся дозированными аэрозольными ингаляторами (ДАИ), и до 94% пользующихся порошковыми ингалятороми (ПИ) допускают по крайней мере одну техническую ошибку при каждом применении ингалятора, причем 25% из них никогда не обучались правилам использования устройства [11, 12]. Отсутствие выдоха перед ингаляцией, плохая координация вдоха с активацией ингалятора (в случае ДАИ), недостаточная/избыточная сила вдоха – вот основной, но неисчерпывающий перечень факторов, обусловливающих уменьшение дозы препарата (из максимально доступной выпущенной), способного проникнуть в дыхательные пути и оказать противовоспалительное или бронхолитическое действие.
Важность оценки течения сопутствующих заболеваний у больных БА определяется несколькими обстоятельствами. Во-первых, некоторые хронические заболевания через специфические патогенетические механизмы могут становиться одной из причин невозможности достижения контроля БА [13–20]. В этом случае необходимо постараться минимизировать негативное воздействие сопутствующего патологического процесса, проведя коррекцию его терапии. Во-вторых, необходимо помнить, что существует группа препаратов, применяемых для лечения различных заболеваний, способных поддерживать персистенцию симптомов БА за счет нежелательного бронхоконстрикторного эффекта. К таким препаратам относятся нестероидные противовоспалительные средства, неселективные β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента.
Безусловно в ряде случаев выполнение всех перечисленных задач представляется затруднительным, но в ином случае едва ли можно быть уверенным, что возможно достижение полного контроля при неконтролируемой БА только медикаментозными средствами.
Лечение БА
Во всех случаях основу лечения БА составляет медикаментозная, прежде всего ингаляционная, терапия. Международные (GINA, включая редакцию 2019 г.) и отечественные (Федеральные клинические рекомендации по диагностике и лечению БА, проект 2018 г.) рекомендации предлагают ступенчатый подход к лечению всех больных БА [1, 5]. Алгоритмы базисной терапии включают начальные низкие дозы ИГКС (как правило, в комбинации с БАДД) с последующим увеличением дозы ИГКС до достижения контроля. Дополнительной терапией на разных этапах могут быть антилейкотриеновые препараты, тиотропия бромид, биологические препараты.
С 2015 г. базисная бронхолитическая терапия на 4-й и 5-й ступенях лечения GINA может быть дополнена тиотропием бромидом в устройстве Респимат. По данным клинических исследований, эффективность тиотропия для пациентов не зависит от определенного фенотипа БА [21]. Такие факторы, как пол и возраст пациента, наличие или отсутствие атопии, уровень иммуноглобулина Е (IgE) в плазме, содержание эозинофилов в индуцированной мокроте, уровень оксида азота в выдыхаемом воздухе, длительность заболевания и индекс массы тела, не изменяют выраженности бронхолитического ответа при добавлении тиотропия к базисной терапии БА [22]. Более того, дополнительный контроллер позволяет снижать риск развития обострений БА, в т.ч. требующих назначения системных ГКС [23, 24]. Данные ключевых исследований у взрослых, позволивших включить тиотропий в программу лечения БА, представлены в табл. 2.
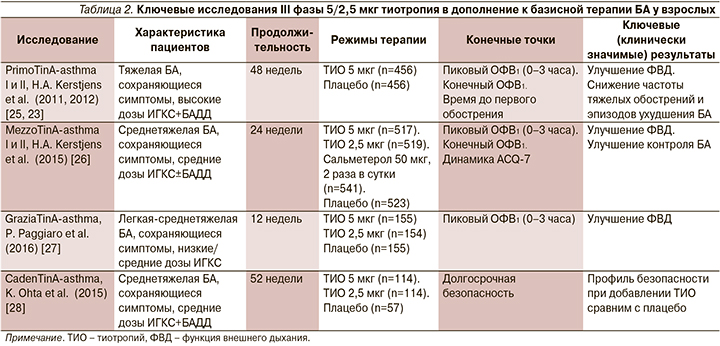
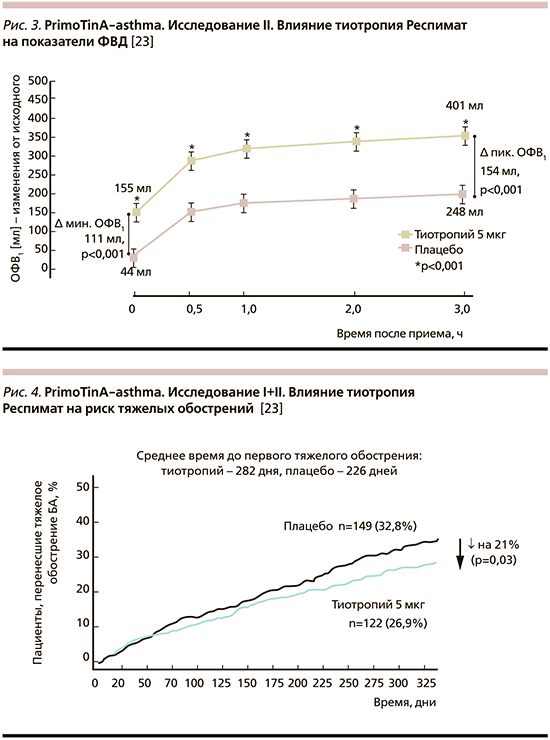
Серия исследований эффективности и безопасности тиотропия (в дозах 5 и 2,5 мкг в сутки) проводилась пациентам различного возраста и с различной степенью тяжести БА. Два зеркальных двойных слепых рандомизированных исследования PrimoTinA-asthma в параллельных группах включили 912 пациентов (по 456 в каждом) с неконтролируемой БА. Пациенты с длительно (не менее 5 лет) существующей БА 18–75 лет характеризовались сохраняющимися симптомами, несмотря на терапию высокими дозами ИГКС/БАДД (доза ИГКС в пересчете на будесонид ≥800 мкг/сут), ОФВ1<80% от должного с наличием не менее 1 тяжелого, требовавшего госпитализации или терапии системными ГКС обострения за предыдущий год. Период лечения и наблюдения составил 48 недель. Тиотропий Респимат в дозе 5 мкг/сут продемонстрировал достоверный результат в отношении всех первичных конечных точек, в т.ч. пикового значения ОФВ1 (измеренного через 3 часа после ингаляции исследуемого препарата), асаминимального значения ОФВ1 (предбронходилатационного, измеренного через 23 часа 15 минут – 23 часа 45 минут после ингаляции исследуемого препарата), времени до первого тяжелого обострения (рис. 2–4).

Еще одно парное двойное слепое рандомизированное плацебо-контролируемое в параллельных группах исследование MezzoTinA-asthma III фазы оценивало эффективность тиотропия Респимата. В исследование включались пациенты со среднетяжелой БА (диагностированной не менее 3 месяцев назад) в возрасте 18–75 лет с сохраняющимися симптомами на фоне приема средних доз ИГКС (в пересчете на будесонид 400–800 мкг/сут) в монотерпии или в комбинации с БАДД. В несколько лечебных групп были рандомизированы 2100 пациентов, в течение 24 недель получавших тиотропий Респимат в дозе 2,5 или 5 мкг/сут, плацебо или препарат активного сравнения сальметерол. Исследование подтвердило значимый эффект в отношении ФВД, а также показало достоверное улучшение контроля БА при добавлении к базисному лечению тиотропия. Это было установлено подсчетом числа пациентов, ответивших на терапию тиотропием в обеих дозах с улучшением более чем на ≥0,5 балла по ACQ по сравнению с плацебо (р=0,03). Сходная частота больных, ответивших на лечение, по данным ACQ, наблюдалась при сравнении тиотропия с салметеролом (р=0,004).
Переносимость тиотропия Респимат в сериях исследований PrimoTinA-asthma и MezzoTinA-asthma была сравнимой с плацебо. Высокий профиль безопасности применения тиотропия у взрослых и подростков с БА был продемонстрирован также в мета-анализе 13 рандомизированных клинических исследований (n=5121) [29].
С учетом накопленных данных эксперты Российского респираторного общества выделяют ряд факторов, определяющих выбор тиотропия Респимат в качестве дополнительного лечения БА (табл. 3). К таким факторам относятся отсутствие контроля БА при лечении на ступенях 3, 4 и 5, частые обострения, сочетание БА и хронической обструктивной болезни легких (ХОБЛ), фиксированная бронхиальная обструкция, признаки легочной гиперинфляции, ограничения по применению БАДД, курение, положительный бронходилатационный тест, преобладание ночных симптомов.

Заключение
Значительные усилия затрачиваются медицинским сообществом во всем мире на попытки достижения контроля БА и улучшения качества жизни пациентов. Наряду с особенностями течения заболевания, влиянием сопутствующих заболеваний, уровнем приверженности пациента всем медицинским и бытовым рекомендациям объем и качество медикаментозной терапии остается ключевым компонентом, определяющим возможность достижения контроля. Доказательная база антихолинергического препарата тиотропий в устройстве Респимат охватывает различные клинические и функциональные аспекты БА: увеличение показателей ФВД, уменьшение ежедневных симптомов, снижение риска обострений, улучшение качества жизни и контроля в целом. Эффективность и хорошая переносимость тиотропия позволяют использовать его при БА средней и тяжелой степеней независимо от фенотипа в качестве дополнения к терапии ИГКС/БАДД для модификации течения заболевания.



