Ранняя диагностика врастания плаценты (ВП) важна для своевременной маршрутизации беременной в крупный центр, специализированный по данной патологии, с возможностью мультидисциплинарного подхода к решению диагностических и лечебных задач, для уточнения диагноза, оценки рисков осложнений и определения индивидуализированной лечебной тактики [1–6].
Скрининг патологической плацентации включает обязательную оценку расположения плаценты относительно рубца на матке во время ультразвукового исследования (УЗИ) во II триместре беременности [7, 8]. Однако признаки ВП могут быть определены по данным УЗИ у 90% беременных с этой патологией уже в I триместре [9–11]. Недостатками опубликованных исследований являются малый объем выборок, неоднородность УЗ-признаков и гестационного возраста на момент исследования, включение только случаев с подтвержденным ВП, а также отсутствие информации о специфичности УЗИ.
Целью работы явилось изучение ценности УЗИ в 5–10 недель беременности для диагностики ВП у женщин с факторами риска.
Материалы и методы
Проведен ретроспективный анализ данных, накопленных проспективно у беременных, родоразрешенных в Перинатальном центре в структуре ГБУЗ «Краевая клиническая больница №2» Министерства здравоохранения Краснодарского края (ПЦ ГБУЗ «ККБ № 2») в 2017–2019 гг.
Анализ данных УЗИ, выполненных в 5–10 недель (до срока комбинированного скрининга I триместра), получен из электронной базы центра перинатальной диагностики ПЦ ГБУЗ «ККБ №2». Данные об исходе родов получены из архивированных историй родов ПЦ. Учитывали срок беременности на момент родоразрешения, наличие и глубину ВП согласно заключению гистологического исследования операционного материала.
Критерии включения: беременные; не менее 1 кесарева сечения (КС) и/или другой операции на матке в анамнезе; выполнено УЗИ малого таза в 5–10 недель беременности; родоразрешение в ПЦ ГБУЗ «ККБ №2».
Критерии исключения: отсутствие доступных анализу данных УЗИ до 11 недель беременности.
Данные о наличии УЗ-признаков ВП были введены в протокол проспективно во время первоначального УЗИ. Два специалиста УЗ-диагностики независимо, не имея данных об исходе беременности и гистологическом исследовании операционного материала при родоразрешении, анализировали описания и сохраненные изображения (при наличии) и распределяли в зависимости от наличия и сочетания анализируемых УЗ-признаков.
Показаниями к УЗИ до 11 недель беременности явились: уточнение срока беременности при нерегулярном менструальном цикле, вагинальные выделения крови, включая кровомазания, тянущие боли внизу живота; желание пациентки, другие. Во всех случаях выполнялась трансвагинальная эхография. Все УЗИ выполнялись на сканерах GE Voluson E6 (GE Healthcare) или Accuvix A30 (Samsung Medison) с эндокавитальными датчиками частотой 4,0–9,0 МГц. При выполнении допплеровского картирования соблюдался принцип безопасности ALARA, термический индекс безопасности (TIb) <1,0. Все случаи ВП верифицировали согласно классификации FIGO (клинически и гистологически) [12, 13].
Ретроспективный дизайн исследования не требовал информированного согласия пациенток на использование обезличенных данных в научных целях.
Соблюдался протокол STARD (Standards for Reporting of Diagnostic Accuracy Studies) для диагностических исследований [14].
Анализировали возможную связь между наличием ВП и глубиной инвазии и потенциальными предикторами, включая 5 УЗ-признаков (низкое положение плодного яйца (ПЯ) в полости матки, имплантация ПЯ на рубце, гиперваскулярный паттерн в миометрии в области имплантации по данным цветового допплеровского картирования, деформация наружного контура матки в области имплантации, ретрохориальная гематома) и 4 материнских клинических и демографических параметра (возраст, паритет, число КС, другие операции на матке) [15].
Статистический анализ
Статистический анализ выполнен по методологии Cali G. et al. (2018) [15]. Первоначально проводился одномерный статистический анализ с группировкой по категориям пациенток (без ВП, с ВП и по глубине инвазии): тест хи-квадрат (χ2) с поправкой Йейтса или точный критерий Фишера (в случае наличия в таблице сопряженности ожидаемых частот n<5) для категориальных параметров, t-критерий Стьюдента (для численных данных с нормальным распределением) и Mann–Whitney’s U-test (для численных данных, отклоняющихся от нормального закона). Оценка распределения производилась с помощью теста Shapiro–Wilk.
Число КС и число УЗ-признаков ВП были включены в анализ как в исчисляемом для каждого признака виде, так и после дихотомизации. Число КС методом дихотомизации разделили на 3 категории: 1) ни одного/одно, 2) два, 3) три и более; число УЗ-признаков – на 3 категории: 1) ни одного, 2) один, 3) два и более.
Далее проведен пошаговый логистический регрессионный анализ для выявления потенциальных независимых предикторов ВП (использовался метод исключения на основе расчета отношения правдоподобия). В качестве предикторов выступали следующие признаки: возраст, паритет, число КС, наличие других операций на матке. Оценка риска аномальной плацентации на основе УЗ-признаков была скорректирована с учетом влияния перечисленных предикторов. Все предикторы были протестированы для включения в окончательную модель, в которую были сохранены только значимые для одномерного анализа признаки.
Точность приближения модели к исходным данным (goodness-of-fit) проверялась тестом Hosmer–Lemeshow. При р>0,05 принималась гипотеза о согласованности модели. Предсказательная мощность проверялась ROC-анализом (area under the receiving-operating characteristics curve). В наборе данных пропущенные значения отсутствовали, поэтому в использовании метода замены отсутствующих значений не было необходимости.
Потенциальные возможности каждого УЗ-признака в диагностике ВП оценивались с помощью регрессионных моделей. Определяли чувствительность (sensitivity, Se), специфичность (specificity, Sp), отношение правдоподобия (positive and negative likelihood ratios, LR«+» и LR«-»), прогностическую ценность положительного и отрицательного тестов (positive and negative predictive values, PPV и NPV), а также отношение шансов (Odds Ratio, OR) и скорректированное отношение шансов при построении модели множественной регрессии (adjusted odds ratio, AjOR) с определением 95% доверительного интервала (confidence interval, CI). Статистическая значимость определялась двусторонним критерием на уровне p<0,05.
Анализ выполнен с использованием SPSS 26.0 (StataCorp, College Station, TX, USA, 2013).
Результаты
После применения критериев исключения в анализ вошла 181 пациентка с КС либо иной операцией на матке (20 беременных не имели КС в анамнезе) (рисунок).
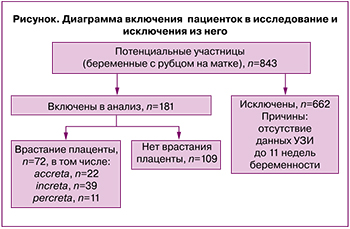
ВП подтверждено у 39,8% (95%CI 37,2–51,3%), в том числе placenta accreta – у 12,2% (95% CI 8,0–17,5%), increta – у 21,5% (95% CI 16,0–28,0%), percreta – у 6,1% (95% CI 3,3–10,3%). Сравнительный анализ изучаемых параметров в зависимости от наличия и глубины ВП представлен в таблице 1.
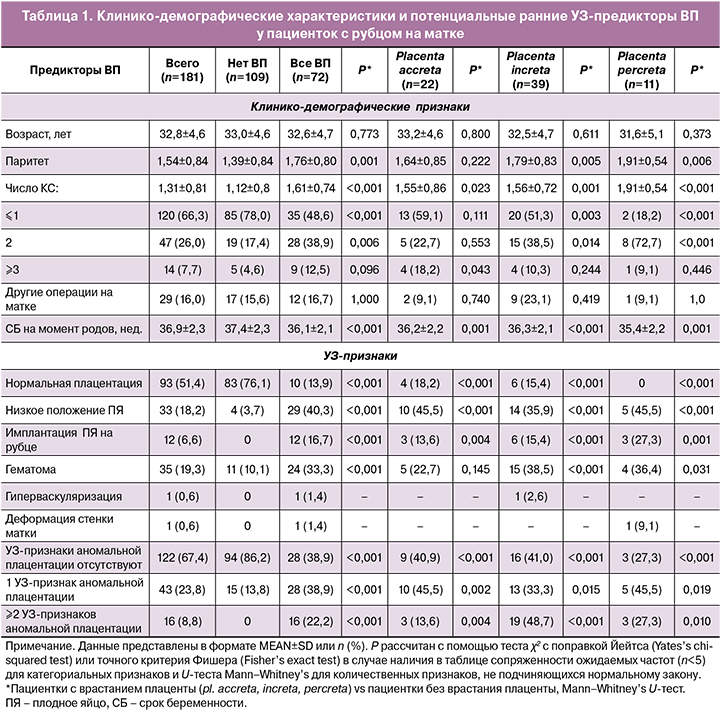
Сравнительный анализ не выявил возрастных различий между пациентками с ВП и нормальной плацентацией (32,6±4,7 vs 33,0±4,6; р=0,773). Беременные с ВП имели более высокий паритет (1,76±0,80 vs 1,39±0,84; p=0,001), большее число КС в анамнезе (1,61±0,74 vs 1,12±0,80; p<0,001), а также более низкий гестационный возраст на момент родоразрешения (36,1±2,1 vs 37,4±2,3; p<0,001). Разница сохранялась при стратификации по глубине ВП, за исключением placenta accreta, при сравнении по паритету (р=0,222) и при числе
КС≤2, что можно связать с малым числом наблюдений в группах с различной глубиной ВП. Наличие других операций на матке с какой-либо группой (ВП или нормальная плацентация) не ассоциировано.
Такие УЗ-признаки, как низкое положение ПЯ, расположение на рубце и ретрохориальная гематома в группе с ВП встречались значимо чаще по сравнению со случаями нормальной плацентации (табл. 1).
Согласно логистическому регрессионному анализу, увеличение числа родов и КС в анамнезе, сочетание аномальных УЗ-признаков (>1) были независимо ассоциированы с наличием ВП (табл. 2). Все включенные в выборку случаи с сочетанием ≥2 аномальных УЗ-признаков были ассоциированы с ВП. Статистически оценить риск ВП в сравнении с нормальной плацентацией при сочетании нескольких УЗ-признаков не представилось возможным, поскольку случаи данного сочетания в группе без ВП отсутствовали.
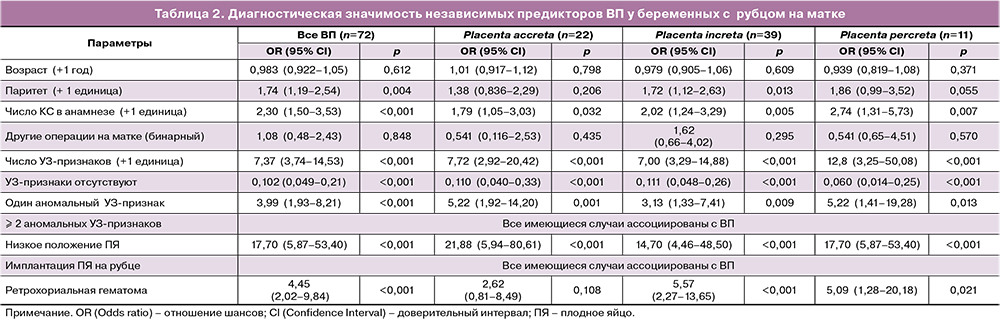
Для оценки ценности предиктора «≥2 УЗ-признаков аномальной плацентации» для ранней диагностики глубины инвазии плаценты был также применен метод логистической регрессии, но исключительно в выборке ВП. Анализ не выявил значимой дифференциации данного предиктора в зависимости от глубины врастания. Но следует отметить небольшое количество наблюдений, имевших такое сочетание признаков в выборке, что могло влиять на результаты (n=16, из них большую часть (n=10) составили случаи pl. increta). Ретрохориальные гематомы достоверно чаще описывались в протоколах УЗИ у пациенток с инвазивными формами ВП (pl. increta, р<0,001; pl. percreta, р=0,031) (табл. 2). Для диагностики pl. percreta наибольшую ценность представлял факт наличия хотя бы одного УЗ-признака аномальной плацентации, особенно низкое положение ПЯ (OR=17,70; 95% CI 5,87–53,40; р<0,001) (табл. 2).
Значение OR для переменной «один аномальный УЗ-признак» оказалось меньше, чем OR по отдельным УЗ-признакам аномальной плацентации (табл. 2) ввиду того, что положительные значения данной переменной охватывают все возможные УЗ-признаки аномальной плацентации, в том числе те, которые редко встречались в выборке (гиперваскуляризация места плацентации и деформация стенки матки).
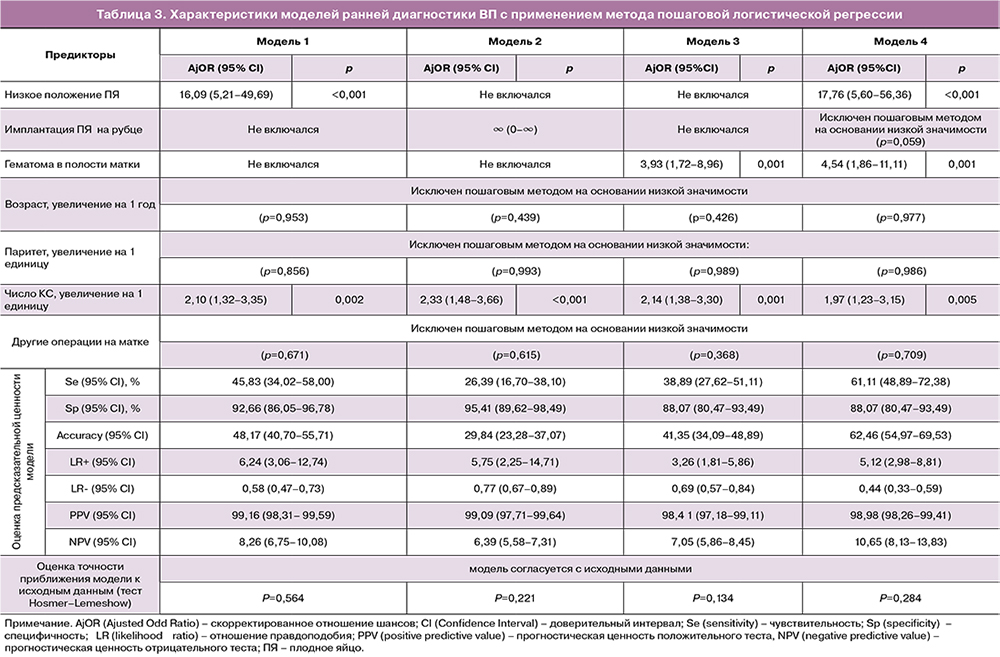
С помощью многомерного регрессионного моделирования были построены 4 экспериментальные модели диагностики ВП на основе УЗ-признаков аномальной плацентации по данным эхографии до 11 недель беременности под контролем влияния клинико-анамнестических данных (табл. 3). Сравнение диагностических параметров показало, что оптимальное соотношение уровня Se, Sp, PPV и NPV для ранней диагностики ВП имеет модель 4. Данная модель включает 2 УЗ-признака, а именно «низкое положение ПЯ» (AjOR=17,76; 95% CI 5,60–56,36; р<0,001) и наличие ретрохориальной гематомы (AjOR=4,54; 95% CI 1,86–11,11; р=0,001) с обязательным учетом влияния числа КС (табл. 3). Включение в диагностическую модель только одного УЗ-признака аномальной плацентации снижает чувствительность на 33% при включении признака «низкое положение ПЯ» (модель 1), в 2,3 раза – при включении признака «расположение ПЯ на рубце» (модель 2) и в 1,5 раза – при включении признака «ретрохориальная гематома» (модель 3). Такие признаки, как возраст, паритет и наличие в анамнезе иных операций на матке, не оказывали статистически значимого влияния на диагностические возможности модели. Все построенные модели согласуются с наблюдаемыми данными (тест Hosmer–Lemeshow) (табл. 3).
Обсуждение
О важности раннего УЗИ (до 8 недель беременности) для скрининга и диагностики патологической имплантации ПЯ заявляют многочисленные публикации [11, 16–22], однако большинство из них базируется на ретроспективных исследованиях [9, 10, 18].
В работе Cali G. et al. (2018) [15] получены более значимые параметры для диагностики ВП при выполнении УЗИ в 11–14 недель беременности у женщин, которые в III триместре имели предлежание плаценты. Однако известно, что большая часть случаев предлежания хориона/плаценты в I и II триместрах к III триместру имеет исход в нормальное положение плаценты [23, 24]. Таким образом, в данный анализ не попали случаи, когда в I триместре, возможно, имелись признаки аномальной инвазии, на основе которых мог быть сформирован ложноположительный диагноз, но исключенные при последующей оценке положения плаценты в III триместре.
Кроме того, диагностика ВП в конце I триместра, при уже реализовавшейся инвазии хориона, ограничивает возможности дифференцированного подхода к дальнейшему ведению пациенток. С одной стороны, прерывание такой беременности связано со значительными техническими трудностями обеспечения полного удаления ПЯ и надежного интраоперационного гемостаза [20, 22, 25, 26]. С другой стороны, женщине психологически сложнее дать согласие на прерывание беременности после завершения периода эмбриогенеза при сформировавшемся плоде.
Ранняя диагностика имеет критически важное значение, поскольку позволяет профилактировать серьезные последствия для репродуктивного здоровья женщины при прогрессировании этой беременности за счет маршрутизации в специализированный центр с выработкой индивидуализированной лечебной тактики. В популяции высокого риска прогностическая ценность любого скринингового теста будет выше, т.к. скринируемое состояние встречается чаще [27]. Известна работа Panaiotova J. et al. (2019) [28], когда при обследовании 1298 пациенток группы высокого риска ВП в 12–16 недель из 14 диагностированных случаев ВП при родоразрешении подтвердились 13. Таким образом, прогностическая ценность положительного теста УЗИ составила 92,9%. Такой результат был предопределен экспертным уровнем исследования, выполненного в стандартизированных условиях узким кругом специалистов (3 эксперта).
Оценка рисков дает возможность женщине принять аргументированное решение о вынашивании беременности либо ранней элиминации плодного яйца. Клинические работы демонстрируют значительно меньшее число осложнений при раннем прерывании беременности низкой имплантации [20–22, 25, 26]. Вероятно, это обусловлено тем, что процесс инвазии трофобласта с ремоделированием крупных сосудов миометрия в ранних сроках беременности еще не реализован в полной мере. Эта гипотеза находит подтверждение в недавних исследованиях, демонстрирующих, что низкая имплантация ПЯ в ранних сроках (<8 недель беременности) не имеет макроскопических УЗ-признаков инвазии в миометрий, которые присутствуют в 11–14 недель [29].
Наше исследование выявило высокий уровень согласия между специалистами в интерпретации УЗ-признаков. Ни в одном случае не было расхождений в оценке между врачами, проводившими УЗИ, и исследователями, выполнявшими повторный анализ данных сохраненных УЗ-изображений. В то же время при повторном анализе эксперты указали на присутствие дополнительных признаков рассматриваемой патологии у 13 (20,6%) женщин с ВП.
Сопоставимые результаты опубликованы в исследовании Cali G. et al. (2018) [15]. Авторами также не было обнаружено расхождений между интерпретацией данных УЗИ при первичном исследовании и повторной экспертизе двумя исследователями. В то же время анализ данных в другой работе [30] показал, что повторная оценка ранних УЗ-признаков ВП экспертами привела к снижению числа подозрений на ВП с 25 (5,4%) до 11 (2,4%), что повысило чувствительность с 75% (95% CI 34,9–96,8%) до 87,5% (95% CI 47,3–99,7%) и прогностическую ценность положительного теста – с 24,0 (95% CI 14,8–36,4) до 63,6 (95% CI 38,9–82,8) соответственно. Высокий уровень совпадений в нашей работе можно объяснить тем, что исследование выполнялось врачами центра перинатальной диагностики 3А группы, специализированного для ведения и родоразрешения пациенток с ВП с достаточным клиническим опытом выполнения таких исследований. В то же время наши данные доказывают, что сочетание нескольких УЗ-признаков повышает диагностическую точность модели. Таким образом, первичное заключение о патологической имплантации ПЯ в сроке до 11 недель беременности целесообразно верифицировать экспертным УЗИ и консультированием в максимально короткие сроки для определения дальнейшей клинической тактики.
Заключение
Низкое положение ПЯ по данным УЗИ в 5–10 недель беременности в сочетании с наличием гематомы в полости матки позволяют диагностировать ВП при прогрессировании беременности с отношением правдоподобия LR(+)=5,12 (95% CI 2,98–8,81); LR(-)=0,44 (95% CI 0,33–0,59); прогностической ценностью положительного теста 98,98 (95% CI 98,26–99,41); прогностической ценностью отрицательного теста 10,65 (95% CI 8,13–13,83) у женщин с ≥1 рубцом после КС, что позволяет рекомендовать данные показатели для селективного скрининга ВП в раннем сроке беременности.
Сильными сторонами исследования являются проспективный набор данных, позволивший включить в анализ пациенток с нормальным положением плаценты в III триместре беременности, поскольку в I триместре беременности невозможно точно предсказать предлежание плаценты к концу беременности; объективно признанные факторы риска ВП (наличие рубца на матке после КС либо иной операции на матке) позволили снизить риск ошибки при определении диагностических возможностей теста за счет оценки анализируемых параметров в группе, сформированной до выполнения теста, стратификация анализа по степени инвазии плаценты и оценка специфичности.
Ограничения: ретроспективный дизайн, исключение большого количества пациенток из исследования ввиду отсутствия сохраненных данных раннего УЗИ для ретроспективного анализа, отсутствие данных о стандартизации настроек допплеровского блока при выполнении исследования, невозможность оценки всех УЗ-признаков, наводящих на мысль о ВП, о которых сообщается в опубликованной литературе, при отсутствии сохраненных изображений. В исследование не вошли пациентки с беременностью, прервавшейся до срока жизнеспособности плода (выкидыши, беременность в рубце после КС, прерывание по желанию женщины, ВП с кровотечением до 22 недель беременности). Результаты применимы только к женщинам с предшествующим рубцом на матке. Однако известно, что ВП может возникать даже у женщин без классических факторов риска.
Клиническое значение данных раннего селективного УЗ-скрининга ВП у пациенток с рубцом на матке требует валидации масштабными проспективными исследованиями.



