Эктопический децидуоз – процесс, обозначающий очаговый децидуоподобный метаморфоз фибробластов, вызванный высоким уровнем прогестерона [1]. Впервые внематочная децидуализация была описана в 1887 г. Walker и имела место у пациентки с внематочной беременностью [2, 3], а децидуоз серозной оболочки описан в 1917 г. [4, 5]. Перитонеальная децидуализация встречается довольно редко и является результатом метаморфоза полипотентных стромальных клеток в ответ на действие прогестерона, вырабатываемого во время беременности желтым телом и синцитиотрофобластом [6, 7]. Отмечены случаи эктопического децидуоза вне беременности, возникшего в ответ на терапию эндометриоза препаратами прогестерона [8, 9]. Визуально чаще всего это мелкие очаги 0,1–0,3 см. Реже встречается процесс, представленный крупными или сливными очагами [6], легко кровоточащими, имитирующими распространение метастазов по брюшине [10–12]. Как известно, прогестерон стимулирует децидуализацию эндометрия, что является важнейшим условием для имплантации бластоцисты. Этот процесс сопровождается усиленной трансформацией стромальных клеток эндометрия в децидуальные, увеличением количества сосудов и повышенной секрецией желез спонгиозного слоя. Подобного рода изменения клеток стромы (фибробластов) иногда могут происходить за пределами репродуктивной системы: в тонкой и толстой кишке, аппендиксе, брыжейке, почечных лоханках и лимфатических узлах [4, 10, 13–16]. Возможной причиной такого рода трансформации является индуцированный прогестероном переход имеющихся полипотентных клеток в децидуоподобные, вызывающий диссеминированный эктопический децидуоз [12, 17]. Описаны случаи обнаружения децидуальных эктопий в коже, легких, печени, селезенке [10, 18–21], а также в шейке матки, яичниках, серозной оболочке матки, фаллопиевых труб [18, 22, 23], и их отличительные структурные признаки.
Перитонеальный децидуоз может имитировать диссеминацию по брюшине злокачественного процесса разной первичной локализации, обуславливая острый болевой синдром, вызванный внутрибрюшинными кровоизлияниями [24], острый аппендицит, гидронефроз и гематурию на фоне поражения почек [10, 11]. Описан случай массивного внутрибрюшного кровотечения, обусловленного перитонеальным эктопическим децидуозом, и примеры децидуоза у небеременных, как принимавших, так и не принимавших препараты прогестерона [25].
К сожалению, все это может приводить к гипердиагностике и излишней хирургической активности [14]. Известно, что любая диссеминация является причиной сверхнастороженности, так как внешний вид диссеминированного децидуоза напоминает метастатическое или туберкулезное поражение; поэтому морфологическая верификация – единственный способ установить правильный диагноз [5, 12, 26].
Мы хотели бы представить клиническое наблюдение диффузного перитонеального децидуоза, проявившегося клинической картиной острого живота с явлениями перитонита, а в отсроченном периоде вызвавшего нарушение пассажа мочи в результате развившегося правостороннего уретерогидронефроза.
Клиническое наблюдение
Первобеременная первородящая пациентка, 37 лет, поступила в Родильный дом № 25 филиал ГКБ № 1 им. Н.И. Пирогова г. Москвы с признаками угрозы преждевременных родов в сроке беременности 36 недель. Соматически не отягощена, в детстве перенесла ветряную оспу. Росто-весовые показатели в пределах нормы (рост 175 см, вес 65 кг). В течение 4 лет при регулярной половой жизни методы контрацепции не использовала, обследовалась по поводу бесплодия. В качестве прегравидарной подготовки принимала дидрогестерон 10 мг во вторую фазу цикла в течение 6 месяцев. Беременность наступила самостоятельно.
За время беременности пациентка была обследована согласно приказу № 1130. В I триместре принимала дидрогестерон до 12 недель, фолиевую кислоту, йодомарин. Во II триместре отмечалось незначительное повышение трансаминаз. III триместр протекал с клиническими проявлениями угрозы преждевременных родов. Общая прибавка веса составила 1,8 кг.
Беременность завершилась преждевременными родами через естественные родовые пути. Родилась живая недоношенная девочка массой 2670 г, длиной 49 см, с оценкой по шкале Апгар 8–8 баллов. Ранний послеродовый период протекал без особенностей. Пациентка находилась на совместном пребывании с ребенком.
На 2-е сутки после родов родильница пожаловалась на боли в эпигастрии с иррадиацией в правую подвздошную область, ухудшение общего состояния. При осмотре отмечались субфебрилитет, болезненность при пальпации живота, перитонеальные симптомы. По данным лабораторных анализов крови – выраженный лейкоцитоз 33×109/л с увеличением количества палочкоядерных форм. По данным ультразвукового исследования – незначительный по объему выпот в брюшной полости. С подозрением на острый аппендицит пациентка переведена в отделение реанимации ГКБ № 1 им. Н.И. Пирогова для обследования, наблюдения и возможного оперативного лечения.
В условиях реанимационного отделения отмечалось усиление болей, нарастание лейкоцитоза до 35×109/л, уровня белков острой фазы воспаления (C-реактивный белок) – до 50 мг/л. С целью диагностического поиска выполнена компъютерная томография (КТ), по результатам которой отмечалось наличие жидкости в левом латеральном канале брюшной полости, геморрагическое содержимое в полости матки; данных за острое хирургическое заболевание (аппендицит, перфорация полого органа) не было обнаружено.
Учитывая выраженный болевой синдром и синдром системной воспалительной реакции, проведена диагностическая лапароскопия. При ревизии брюшной полости и полости малого таза обнаружено: серозный выпот (около 200 мл); множественные просовидные кистозные образования максимальным диаметром 0,5 см на париетальной брюшине, в дистальной части большого сальника, в корне брыжейки тонкой кишки, в области терминального отдела подвздошной и сигмовидной кишки. Купол слепой кишки, червеобразный отросток, печень и желудок были интактны. Левые придатки плотно фиксированы плоскостными спайками к задней поверхности матки; на серозной оболочке матки, поверхности правого яичника и доступном обзору полюсе левого яичника визуализировались множественные мелкие просовидные высыпания, легко кровоточащие при контакте. Интраоперационный диагноз – карциноматоз брюшны, асцит. Произведена инцизионная биопсия большого сальника, участков париетальной брюшины (рис. 1–5).
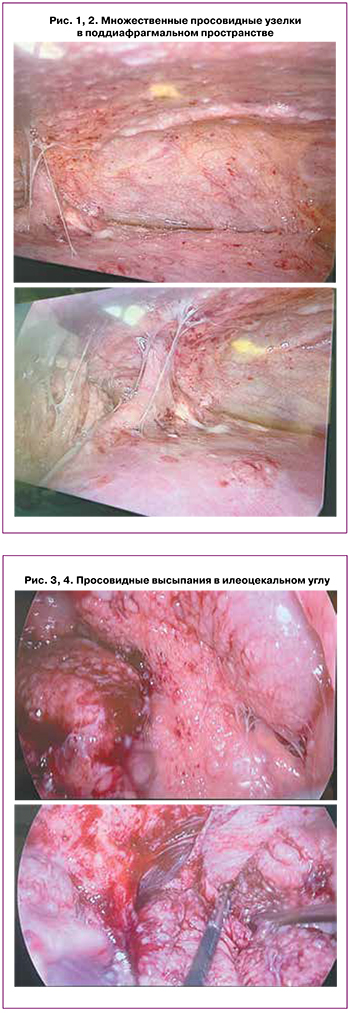
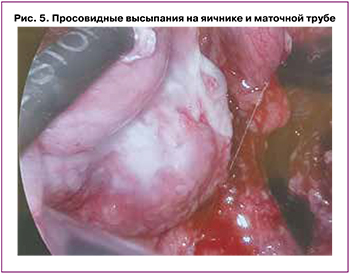
Начато подавление лактации. В рамках диагностического поиска взята кровь на онкомаркеры: уровень СА-125 превышал нормальные значения в 2 раза (68,8 ГЭ/мл), уровень СА-19-9 был в пределах референсных значений.
На 3-и сутки после родов выполнена эзофагогастродуоденоскопия, обнаружены признаки поверхностного антрум-гастрита; слизистая пищевода, желудка и луковицы 12-перстной кишки не изменена.
На 4-е сутки после родов проведена КТ брюшной полости с двойным контрастированием, обнаружено: межпетельно – свободная жидкость, геморрагическое содержимое в полости матки, расширение чашечно-лоханочной системы почки справа. Нарушения пассажа мочи не отмечалось. К этому времени (4-е сутки после родов) были готовы результаты морфологического исследования операционного материала: измененная ткань представляет собой эктопический децидуоз. Учитывая положительную динамику в состоянии пациентки, снижение уровня лейкоцитов до 19×109/л и белков острой фазы воспаления, умеренное количество серозного отделяемого по дренажу (дренаж удален), пациентка переведена из отделения реанимации для наблюдения и лечения в условиях отделения гинекологии.
На 6-е сутки после родов отмечено нарушение пассажа мочи, выполнено ультразвуковое исследование почек и экскреторная урография, обнаружен уретерогидронефроз справа (предположительно, вызванный механическим сдавлением/лимфаденопатией). Для обеспечения эвакуаторной функции почки произведена установка внутреннего мочеточникового стента справа.
На 7-е сутки после родов с лечебно-диагностической целью выполнена вакуум-аспирация содержимого полости матки – получено умеренное количество геморрагического содержимого, представленного децидуальной тканью, что подтверждено гистологическим исследованием. Уровень лейкоцитов снизился до 14×109/л, С-реактивного белка – 63 мг/л, уровень хорионического гонадотропина был незначительно повышен – 283 мМЕ/мл, что отвергало наличие трофобластической болезни.
На 9-е сутки после родов появились кашель, гипертермия до 38°С, лабораторные признаки воспаления. По данным КТ – признаки полисегментарной двусторонней пневмонии, гидроторакс, гидроперикард. Диагностирован COVID-19 методом полимеразной цепной реакции. В связи с этим пациентка переведена в отделение клинической обсервации, начата патогенетическая вируснейтрализующая терапия.
На 17-е сутки после родов появились интенсивные боли в эпигастральной области, правом подреберье (ВАШ – 6 баллов), тошнота, однократная рвота. С целью исключения панкреатита и острого хирургического заболевания выполнено определение уровней С-реактивного белка и альфа-амилазы, которые находились в пределах нормальных значений (2 мг/л и 12 ЕД/л соответственно) и КТ брюшной полости, которая выявила признаки тонкокишечной непроходимости в левой гипомезогастральной области. К концу суток абдоминальные симптомы купировались самостоятельно, состояние пациентки со стойкой положительной динамикой. Лабораторные показатели, включая β-хорионический гонадотропин и альфа-фетопротеин были в пределах референсных значений. Повторные анализы на CA-125, CA-19-9 и карциноэмбриональный антиген были в пределах нормы. На 21-е сутки после родов родильница была выписана под амбулаторное наблюдение.
Через 40 дней после установки (46-е сутки после родов) мочеточниковый стент был удален, состояние пациентки не вызывало опасений, лабораторные показатели в пределах нормы. Пациентка возобновила лактацию.
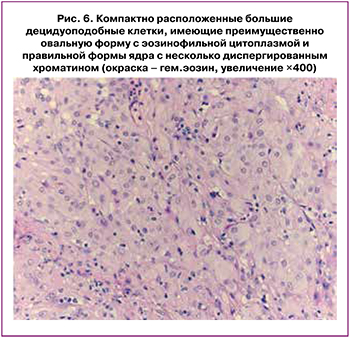
При морфологическом исследовании взятого при лапароскопии биоматериала определялись фрагменты фиброзной ткани и жировой клетчатки с множеством структурных изменений, которые в большей своей части были представлены большими децидуоподобными клетками овальной или округлой формы с просветленной эозинофильной, слабо гранулированной цитоплазмой. Ядра клеток имели преимущественно центральное расположение, округлую форму и диспергированный хроматин, митозы не определялись (рис. 6).
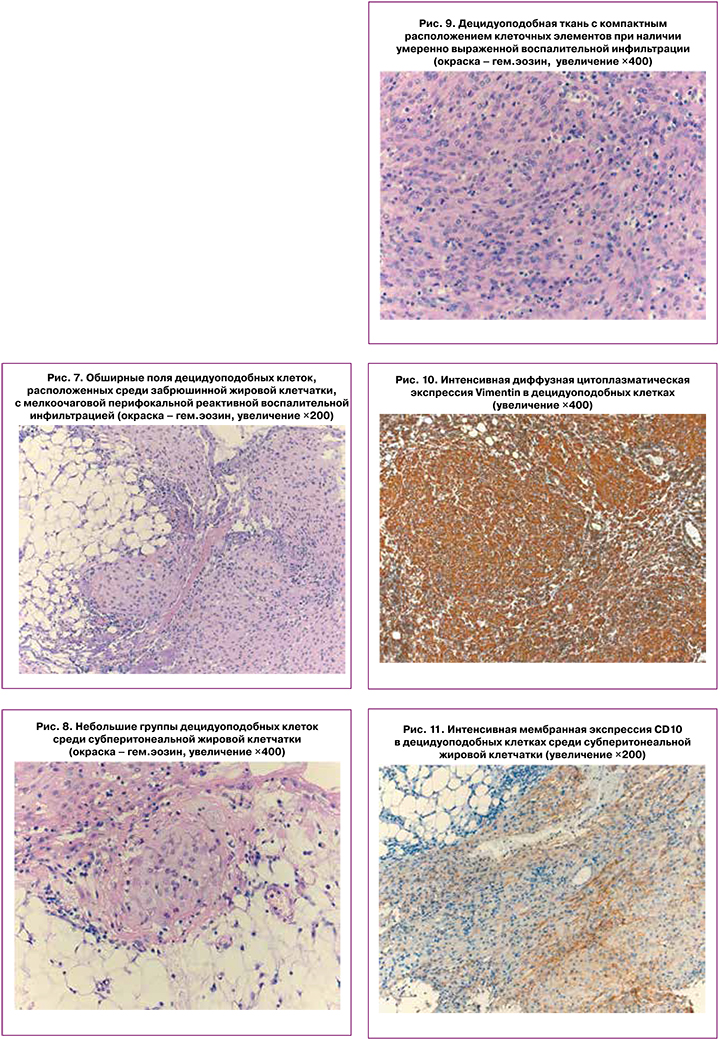
Децидуоподобные клетки формировали обширные солидные поля (рис. 7), а также разноразмерные кластеры, располагающиеся среди жировой клетчатки (рис. 8). В скоплениях децидуподобной ткани и перифокально имели место неравномерно очагово распределенные лимфоидные инфильтраты умеренной степени плотности, а также небольшое количество нейтрофилов и эозинофилов (рис. 9), что в совокупности могло соответствовать эктопическому децидуозу.
Для верификации гистогенеза и исключения возможности наличия новообразования проведено иммуногистохимическое исследование с применением широкой панели моноклональных антител.
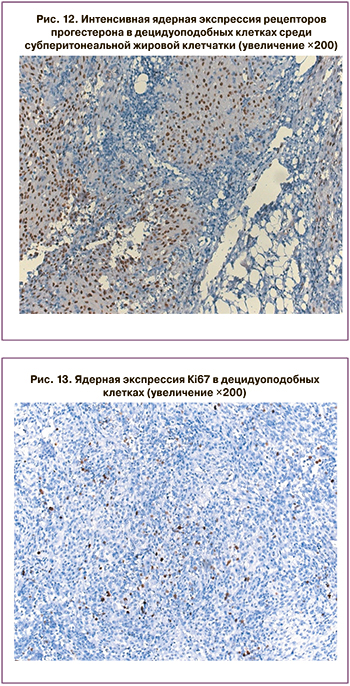
В исследованных клетках ткани определялась диффузная цитоплазматическая экспрессия Vimentin (рис. 10), мембранная экспрессия CD10 (рис. 11). Во всех ядрах имела место выраженная экспрессия рецепторов эстрогенов и прогестерона (рис. 12). При изучении Кi67 (рис. 13) в 10 полях зрения cредний показатель ядерной экспрессия приближался к 8%. Отсутствовала экспрессия Desmin, CК5/6, Mesothelin, CD99, CK7, PAX-8, Inhibin, CDX-2, CK20. На основании полученных данных были исключены злокачественная мезотелиома и метастазы карциномы.
Комплекс выявленных при патологогистологическом и иммуногистохимическом исследованиях структурных изменений биоптатов брюшины соответствовал диффузному эктопическому децидуозу, имитирующему перитонеальный карциноматоз. Материал, полученный из полости матки, соответствовал суткам послеродового периода.
Обсуждение
В приведенной статье описан случай эктопического децидуоза как случайной находки на диагностической лапароскопии у пациентки с клиникой острого живота, появившейся на 2-е сутки после самопроизвольных родов.
Эктопический децидуоз является доброкачественной трансформацией мезенхимальных клеток, в частности фибробластов, имеющих рецепторы к эстрогену и прогестерону вне репродуктивной системы, с их децидуоподобным метаморфозом. Эктопический децидуоз протекает бессимптомно, не требует вмешательства и является случайной находкой. Он возникает в основном во время беременности с полным регрессом в послеродовом периоде. При симптоматическом течении основными клиническими проявлениями являются острый болевой синдром и гемоперитонеум. Внешний вид этого процесса диктует необходимость биопсии, которая в свою очередь, может иметь серьезные неблагоприятные последствия из-за высокой кровоточивости участков децидуоза [16, 27].
Заключение
Эктопический децидуоз может скрываться под маской разных патологических состояний. Достоверная морфологическая верификация эктопического децидуоза, знание его патогенеза и клинических особенностей имеют важное значение для ведения таких пациенток. Это позволяет обеспечить правильный медицинский подход с выжидательной тактикой и благоприятным исходом.



