Введение
Лечение рака молочной железы (РМЖ) в настоящее время основано не только на распространенности болезни, но и на определении молекулярно-биологических подтипов этого заболевания. HER2-положительный подтип РМЖ (HER2+-РМЖ), на долю которого приходится 15–20% в структуре биологических подтипов, характеризуется гиперэкспрессией гена рецептора эпидермального фактора роста второго типа (ErbB2, HER2/neu) [1]. До появления таргетной терапии HER2+-РМЖ расценивался как один из самых агрессивных вариантов заболевания с плохим прогнозом [1, 2]. Рецептор HER2 является важным онкогеном и реализует свое действие через взаимосвя-занную активацию внутриклеточных сигнальных путей (PI3K/Akt/mTOR и Ras/Raf/MEK/ERK), что в конечном итоге приводит к неконтролируемому делению клеток. Особенностью рецептора HER2 является то, что он не имеет собственного специфического лиганда и его стимуляция возникает лишь после гетеродимеризации с другими рецепторами семейства HER [1, 2]. Внедрение в клиническую практику таргетной терапии, направленной на рецептор HER2, прежде всего моноклональных антител трастузумаба и пертузумаба, а также малых молекул – ингибиторов тирозинкиназы и первого конъюгата моноклонального антитела с химиопрепаратом – трастузумаба эмтанзина, позволило радикально изменить прогноз пациентов с HER2+-РМЖ не только по данным клинических исследований, но и в условиях реальной клинической практики [1, 3, 4]. Одним из наиболее ярких подтверждений тому служат недавно опубликованные данные ESME-MBC – французского многоцентрового наблюдательного исследования когорты пациентов с метастатическим РМЖ. Если для люминальных и трижды негативного подтипов РМЖ в период с 2008 по 2017 г. не отмечалось существенной динамики в медиане общей выживаемости, то для пациентов с HER2+-РМЖ, которым диагноз метастатического заболевания был установлен в 2008 и 2013 гг., она увеличилась с 39,1 месяца (36,2–46,5) до 58 (52,0–68,4) соответственно. Для пациентов с диагнозом метастатического HER2+-РМЖ, установленного в последующие годы наблюдения, медиана общей выживаемости в этом исследовании пока не достигнута [3]. Анализ данных регистра SONABRE (Нидерланды) показал, что внедрение в клиническую практику лечения пациентов с метастатическим HER2+-РМЖ пертузумаба и трастузумаба эмтанзина позволило увеличить медиану общей выживаемости с 22,7 месяца в 2008–2012 гг. до 40,9 в 2013–2017 гг. [4].
Увеличение продолжительности жизни пациентов с HER2+-РМЖ определило актуальность других аспектов, связанных с лечением этого заболевания, к которым относятся прежде всего вопросы долгосрочной безопасности терапии, качества жизни, а также возможность проведения терапии, которая может длиться годами вне специализированных онкологических лечебно-профилактических учреждений или более приближенно к месту проживания пациента. В соответствии с результатами опроса пациентов с метастатическим РМЖ, представленными на прошедшем в 2021 г. Ежегодном конгрессе ASCO, 86% опрошенных испытывали те или иные «болезненные» нежелательные явления на фоне лечения, 20% обращались за экстренной медицинской помощью или нуждались в госпитализации в связи с развитием нежелательных явлений и 43% опрошенных имели перерывы в лечении [5]. По данным исследования, проведенного во Франции, почти четверть пациентов со злокачественными опухолями, среди которых 20% были пациенты с РМЖ, предпочли оказание медицинской помощи в домашних условиях и еще 5% – в местном лечебно-профилактическом учреждении, что выявило значительную диспропорцию с возможностями оказания медицинской помощи за пределами специализированных медицинских учреждений в соответствующем регионе [6].
Двойная таргетная блокада пертузумаб+трастузумаб в терапии HER2+-РМЖ: доказательная база и место в клинических рекомендациях
На сегодняшний день общепризнанным считается факт, согласно которому внедрение в клиническую практику трастузумаба – моноклонального антитела, блокирующего рецептор HER2 путем связывания с его IV доменом, произвело в буквальном смысле революцию в лечении HER2+-РМЖ. Многочисленные исследования доказали эффективность этого препарата в улучшении выживаемости пациентов с ранним и метастатическим HER2+-РМЖ [7, 8]. Пертузумаб, являясь также моноклональным антителом, направленным на HER2, связывается с доменом II HER2-рецептора и блокирует димеризацию этого рецептора с другими рецепторами семейства HER, тем самым дополняя и усиливая действие трастузумаба [9]. В клинической практике препарат всегда применяется в комбинации с трастузумабом+/-химиотерапией (ХТ). Добавление пертузумаба к трастузумабу и стандартным режимам ХТ продемонстрировало клинические преимущества при лечении как раннего, так и метастатического HER2+-РМЖ. В исследовании NeoSphere применение комбинации пертузумаб+трастузумаб в составе схем неоадъювантной ХТ сопровождалось значимым увеличением частоты полных патоморфологических ответов как в первичной опухоли молочной железы, так и в лимфатических узлах [10]. В исследовании TRYPHAENA двойная блокада пертузумаб+трастузумаб в составе антрациклин-содержащих и безантрациклиновых схем неоадъювантной ХТ подтвердила благоприятный профиль кардиологической безопасности, показав низкую частоту развития клинически выраженной систолической дисфункции левого желудочка [11]. При этом частота полных патоморфологических ответов, которая в этом исследовании являлась вторичной конечной точкой, достигла 63% при применении 6 циклов режима пер-тузумаб+трастузумаб+карбоплатин+доцетаксел (TCHP) [11]. Добавление пертузумаба к стандартным схемам трастузумаб-содержащей адъювантной ХТ в исследовании APHINITY привело к статистически и клинически значимому увеличению выживаемости без рецидива инвазивного РМЖ у пациентов с высоким риском прогрессирования, определяемого наличием поражения лимфатических узлов [12]. В исследовании CLEOPATRA применение двойной блокады пертузумаб+трастузумаб в комбинации с доцетакселом в первой линии лечения метастатического HER2+-РМЖ сопровождалось достижением беспрецедентного показателя медианы общей выживаемости 56,5 месяцев (+15,7 месяца по сравнению с комбинацией трастузумаб+доцетаксел), при этом 37% пациентов пережили 8-летний рубеж наблюдения [13, 14]. Почти четверть (24%) пациентов в этом исследовании получали лечение пертузумабом и трастузумабом более 8 лет без признаков прогрессирования заболевания [13, 14]. В последующем эти данные были подтверждены в крупном пострегистрационном однорукавном исследовании PERUSE, где медиана общей выживаемости в общей популяции пациентов, получавших комбинацию пертузумаб+трастузумаб+таксан, составила 65,3 месяца, достигнув наибольших значений в подгруппе <65 лет, у пациентов без предшествовавшей терапии трастузумабом в (нео)адъювантном режиме и у пациентов без висцеральных метастазов: 70,0 (64,3–81,1), 73,5 (65,6–н/о) и 81,1 месяца (71,7–н/о) соответственно [15].
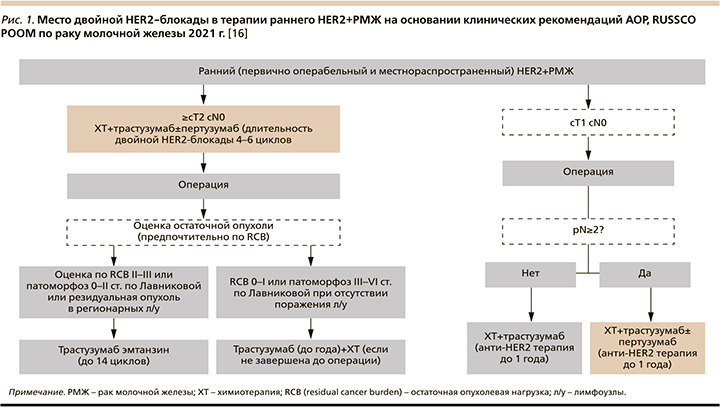
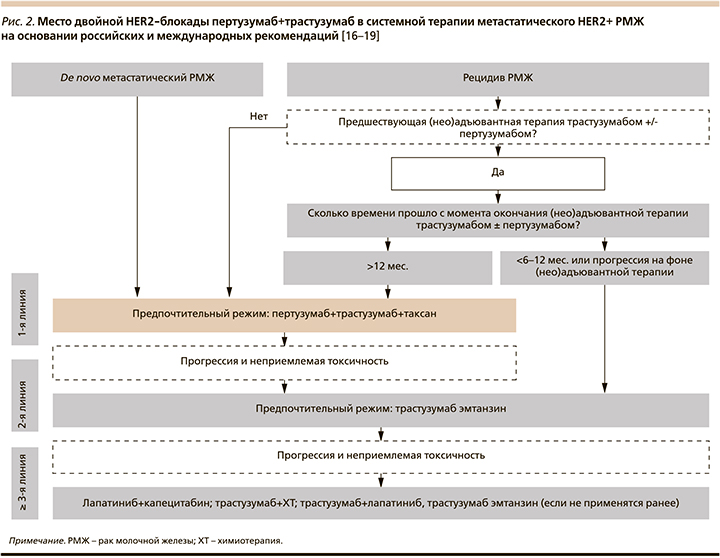
На основании проведенных клинических исследований было определено место двойной таргетной блокады пертузумаб+трастузумаб при системной терапии HER2+-РМЖ в российских и международных клинических рекомендациях (рис. 1, 2) [16–19]. Комбинация химиопрепаратов и двойной HER2-блокады с внутривенным введением пертузумаба и трастузумаба является стандартом неоадъювантной терапии пациентов с ранним HER2+-РМЖ при наличии поражения лимфатических узлов или при размере первичной опухоли >2 см [16]. Пациентам с первично операбельным HER2+-РМЖ, не получавшим неоадъювантной терапии, добавление пертузумаба к трастузумабу и стандартным схемам ХТ рекомендовано при наличии поражения лимфатических узлов [16]. У пациентов с метастатическим HER2+-РМЖ двойная таргетная блокада пертузумаб+трастузумаб в комбинации с таксанами является предпочтительным режимом терапии первой линии пациентов с de novo метастатическим раком, а также пациентов с рецидивом заболевания, если с момента окончания (нео)адъювантной терапии трастузумабом+/-пертузумабом прошло более 12 месяцев [16].
Сложности, связанные с внутривенным введением препаратов пертузумаб и трастузумаб
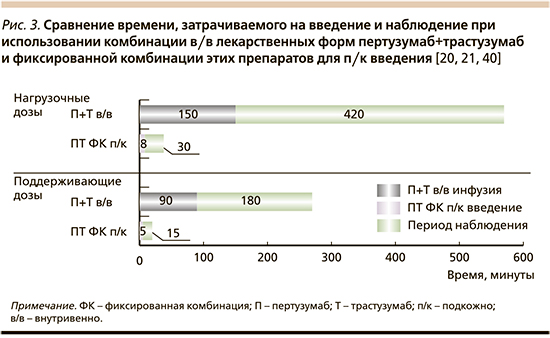
При внутривенном (в/в) пути введения препараты пертузумаб и трастузумаб вводятся последовательно один за другим в виде инфузий [20, 21]. Для первого курса терапии применяются нагрузочные дозы препаратов: для пертузумаба 840 мг вводят в течение 60 минут, для трастузумаба – 8 мг/кг в течение 90 минут. При последующем лечении используются поддерживающие дозы: для пертузумаба – 420 мг, для трастузумаба – 6 мг/кг, которые вводятся также в виде внутривенных капельных инфузий в течение 30–60 и 30–90 минут соответственно каждые 3 недели. После завершения каждой инфузии препарата пертузумаб рекомендуется наблюдение за пациентом в течение 30–60 минут. Также рекомендуется достаточно продолжительное наблюдение за пациентом после введения трастузумаба: в течение 6 часов после начала первой инфузии и в течение 2 часов после начала последующих инфузий (рис. 3). При этом продолжительность использования двойной блокады может варьироваться от 4–6 циклов при применении в составе режимов неоадъювантной терапии до 18 циклов в составе схем адъювантной терапии и в течение нескольких лет при применении в качестве первой линии лечения метастатического HER2+-РМЖ (так, в исследовании CLEOPATRA почти четверть пациентов получали комбинацию пертузумаб+трастузумаб более 8 лет) [9, 14].
Так, при в/в пути введения препаратов пертузумаб и трастузумаб может возникать ряд практических сложностей:
- Длительное время инфузии, наблюдения и пребывания в клинике (рис. 3). Подготовка и проведение в/в инфузий, а также время необходимого наблюдения после инфузии создают определенную нагрузку на системы здравоохранения в отношении времени и ресурсов [22].
- Для многократных внутривенных инфузий на протяжении длительного времени зачастую требуется установка системы постоянного венозного доступа и уход за ней, что может повысить затраты, а также риск инфекций, тромбоза и усугубить дискомфорт пациента [23–25].
- Каждая процедура установки системы для в/в введения может быть особенно обременительной для пациентов с плохим венозным доступом [25].
Разработка подкожных форм препаратов моноклональных антител
В связи с перечисленными проблемами разработка и внедрение в клиническую практику подкожных форм трастузумаба и комбинации пертузумаба и трастузумаба представляют собой очень значимую альтернативу. Создание данных форм препаратов стало возможным благодаря появлению рекомбинантной человеческой гиалуронидазы (rHuPH20) [26].
Подкожное (п/к) введение больших объемов жидкости обычно ограничено структурой и физиологией подкожного слоя. Этот слой содержит матрикс, состоящий из гиалуроновой кислоты (гиалуронан) и волокон коллагена. Он ограничивает объем жидкости, которую можно ввести, до <1,0 мл [27]. rHuPH20 представляет собой синтетическую версию человеческой гиалуронидазы – фермента, разрушающего гиалуронан, и используется для облегчения проникновения и диффузии вводимых под кожу жидкостей, в т.ч. и лекарственных препаратов [26, 27]. rHuPH20 уменьшает вязкость подкожного слоя ткани, временно расширяя локальное интерстициальное пространство, что позволяет вводить п/к бóльшие объемы. Структура кожи восстанавливается через 1–2 дня благодаря быстрому выведению rHuPH20 и высокой скорости обмена гиалуронана [24, 27].
Подкожная форма трастузумаба
Первой в клинической практике лечения РМЖ появилась подкожная форма трастузумаба (препарат Герцептин®) [28]. Исследование HannaH показало неменьший уровень сывороточной концентрации трастузумаба в форме п/к инъекции в цикле 7 (перед введением препарата в цикле 8), неменьшую эффективность и профиль безопасности, сходный с таковым препарата трастузумаб для внутривенного введения [29]. В исследовании PrefHer было показано, что большинство пациентов (86%) предпочли трастузумаб в форме п/к инъекции (вводимый медицинским работником с помощью ручного шприца) препарату трастузумаб для в/в введения [30]. Причины предпочтений включали экономию времени и меньше боли, дискомфорта и побочных эффектов.
В исследовании PrefHer также было показано, что большинство (81%) медицинских работников были в большей степени удовлетворены использованием трастузумаба в форме п/к инъекции по сравнению с препаратом трастузумаб для в/в введения. В некоторых странах подкожная форма трастузумаба может вводиться медицинскими работниками в домашних условиях или в непрофильных лечебно-профилактических учреждениях как часть программы «flex care» (гибкая медицинская помощь) для пациентов с РМЖ [31]. Такие программы были разработаны и внедрены в Великобритании, Бельгии, Испании, Италии и Франции [32–37].
Фиксированная комбинация препаратов трастузумаб и пертузумаб для п/к введения
Фиксированная комбинация пертузумаба и трастузумаба для п/к введения (препарат Фесго®) – это первый онкологический препарат, объединяющий два моноклональных антитела, пертузумаб и трастузумаб, в одном готовом к использованию флаконе, предназначенный для п/к введения [38–40].
Фиксированная комбинация содержит те же антитела, что и в одобренных лекарственных формах препаратов пертузумаб и трастузумаб, и представляет собой комбинацию фиксированных доз. Это означает, что для расчета доз не требуется учитывать массу тела (нагрузочная доза объемом 15 мл содержит 1200 мг пертузумаба/600 мг трастузумаба; поддерживающая доза объемом 10 мг содержит 600 мг пертузумаба/600 мг трастузумаба). Лекарственная форма фиксированной комбинации пертузумаба и трастузумаба для п/к введения содержит 2000 ЕД/мл рекомбинантной человеческой гиалуронидазы для возможности п/к введения больших объемов.
Эффективность и безопасность фиксированной комбинации пертузумаба и трастузумаба для п/к инъекций изучены в исследовании FeDeriCa [41]. FeDeriCa – это рандомизированное исследование III фазы с двумя группами лечения, в котором оценивали фармакокинетику, эффективность и безопасность фиксированной комбинации пертузумаба и трастузумаба для п/к введения по сравнению с комбинацией пертузумаб+трастузумаб для в/в введения у пациентов с ранним HER2+-РМЖ в рамках неоадъювантной и адъювантной терапии [41]. Допускалось применение либо 4 курсов доксорубицин+циклофосфамид в дозоуплотненном режиме с 12 последующими еженедельными введениями паклитаксела (получили 48% пациентов), либо 4 курсов доксорубицин+циклофосфамид и 4 курсов доцетаксела каждые 3 недели (получили 52% пациентов). Исследование достигло первичной конечной точки: Ctrough – концентрация пертузумаба перед циклом 8 в составе фиксированной комбинации для п/к введения, соответствовала критерию «не уступает» по отношению к Ctrough пертузумаба при в/в введении. Вторичная фармакокинетическая точка также была достигнута: Ctrough трастузумаба перед циклом 8 в составе фиксированной комбинации для п/к введения соответствовала критерию «не уступает» по отношению к Ctrough трастузумаба при в/в введении. Частота полных патоморфологических ответов в первичной опухоли и лимфатических узлах (tpCR, total pathologic complete response) при терапии фиксированной комбинацией составила 59,7%, что соответствовало частоте при терапии внутривенными формами пертузумаба и трастузумаба (59,5%) и данным других исследований, в которых изучалась комбинация пертузумаб+трастузумаб+ХТ в неоадъювантном режиме [10, 11, 41]. Профиль безопасности фиксированной комбинации пертузумаба и трастузумаба для п/к введения соответствовал профилю безопасности пертузумаба и трастузумаба при в/в введении и данным предыдущих исследований, в которых изучалась комбинация [10–14, 41]. Локальные реакции в месте введения фиксированной комбинации были нечастыми и имели низкую степень тяжести, что было сопоставимо с данными, полученными в исследовании с подкожным трастузумабом [29]. В настоящее время исследование продолжается для оценки отдаленных исходов (выживаемость без событий, выживаемость без рецидива инвазивного РМЖ и общая выживаемость).
В международном рандомизированном перекрестном исследовании II фазы PHranceSCa оценивали предпочтения в отношении фиксированной комбинации пертузумаба и трастузумаба для п/к введения и комбинации пертузумаб+трастузумаб для в/в введения у пациентов с ранним HER2+-РМЖ, завершивших комбинированное неоадъювантное лечение в составе пертузумаб+трастузумаб+ХТ и перенесших хирургическое вмешательство [42]. По результатам исследования 85% пациентов (136/160; 95% доверительный интервал: 79, 90%) предпочли фиксированную комбинацию пертузумаба и трастузумаба для п/к введения, и лишь 14% (22/160) пациентов отдали предпочтение в/в введению препаратов. Среди пациентов, которые выбрали подкожную форму, 93% отметили «очень высокую» или «высокую» степень удовлетворенности препаратом. Большинство медицинских работников в исследовании отметили, что переключение с в/в введения пертузумаба и трастузумаба на фиксированную комбинацию для п/к введения может способствовать экономии времени и ресурсов при приготовлении и проведении инъекции. Фиксированная комбинация пертузумаба и трастузумаба для п/к введения в целом переносилась хорошо, профиль безопасности был сопоставимым с предыдущими исследованиями, в которых комбинация пертузумаб+трастузумаб изучалась при в/в введении [10, 42]. Показатели безопасности, полученные в исследовании PHranceSCa, поддерживают результаты, продемонстрированные в регистрационном исследовании FeDeriCa [41, 42].
Фиксированная комбинация пертузумаба и трастузумаба для п/к введения получила регистрацию в США и Европейском Союзе в 2020 г. [38, 39].
В США в разгар пандемии COVID-19 для обеспечения непрерывности оказания медицинской помощи было запущено многоцентровое исследование, в котором фиксированная комбинация пертузумаба и трастузумаба для п/к введения вводится пациентам на дому медицинскими работниками. В исследование планируется включить 400 пациентов с ранним HER2+-РМЖ, которые после окончания внутривенной ХТ будут продолжать лечение фиксированной комбинацией пертузумаба и трастузумаба для п/к введения в домашних условиях до завершения 18 циклов введения в соответствии с рекомендациями. Первичной конечной точкой данного исследования является оценка безопасности фиксированной комбинации, вводимой в домашних условиях [43]. Предполагается, что введение подкожной формы препарата на дому уменьшит число визитов пациентов в лечебно-профилактические учреждения и тем самым будет способствовать снижению риска заражения COVID-19.
В России фиксированная комбинация препаратов пертузумаб и трастузумаб для п/к введения была зарегистрирована под торговым наименованием Фесго® 23 августа 2021 г. [40]. Показания к применению фиксированной комбинации препаратов пертузумаб и трастузумаб для п/к введения идентичны показаниям к применению пертузумаба для в/в введения и приведены в таблице.

С учетом зарегистрированных показаний к применению, а также на основе результатов клинических исследований фиксированная комбинация пертузумаб+трастузумаб для п/к введения может быть рассмотрена как предпочтительная (по отношению к внутривенным формам пертузумаба и трастузумаба) опция при применении в составе схем комбинированной терапии раннего (первично операбельного и местно-распространенного) и метастатического HER2+-РМЖ по тем же показаниям, что и препарат пертузумаб для внутривенного введения. При этом основные преимущества от применения фиксированной комбинации можно ожидать при применении препарата пациентами, которые завершили курс ХТ (как в адъювантном режиме, так и особенно при лечении метастатического заболевания) [31, 44]. В связи с этим необходимы дальнейшие усилия для разработки механизмов обеспечения пациентов таргетными препаратами в амбулаторно-поликлинических условиях, например, на уровне центров амбулаторной онкологической помощи. Вместе с тем и в случае комбинирования двойной HER2-блокады пертузумаб+трастузумаб с внутривенной ХТ применение фиксированной комбинации в соответствии с результатами проведенных исследований имеет преимущества, заключающиеся в экономии времени и ресурсов, уменьшении пребывания пациента в стационаре, а также в повышении удовлетворенности пациентов лечением [34, 44]. Безусловно, применение подкожных форм имеет большое значение и решает проблему введения препаратов пациентам, имеющим проблемы с венозным доступом.
Заключение
Двойная HER2-блокада с использованием пертузумаба и трастузумаба, применяемых внутривенно, вот уже на протяжении нескольких лет является стандартом лечения пациентов как с ранним, так и с метастатическим HER2+-РМЖ. Применение этих препаратов в комбинации с ХТ доказанно улучшает показатели выживаемости пациентов не только в клинических исследованиях, но и по результатам изучения реальной клинической практики. Фиксированная комбинация пертузумаба и трастузумаба для п/к введения, недавно зарегистрированная в России, имеет ряд преимуществ перед в/в введением препаратов и потенциально может приводить к увеличению удовлетворенности пациентов лечением, а также к экономии ресурсов здравоохранения. Таким образом, в руках клиницистов появляется новая перспективная опция для лечения пациентов с HER2+-РМЖ. Внедрение в практику фиксированной комбинации пертузумаба и трастузумаба для п/к введения дает дополнительный импульс для развития стационар-замещающих технологий, улучшения качества системной терапии больных HER2+-РМЖ и увеличения доли пациентов, получающих таргетные препараты в соответствии с действующими стандартами и рекомендациями.



