Как известно, состояние иммунной системы и резистентность к различным заболеваниям, в т. ч. болезням полости рта (ПР), во многом зависят от питания человека. В литературе последних лет имеются убедительные доказательства влияния микробиоценоза слизистых оболочек на мукозальный ответ и как следствие – реализацию воспаления [12]. Оценка местного иммунитета представляет большой клинический интерес для изучения протективных свойств слизистых оболочек, в т. ч. ПР.
Отмечают, что низкие уровни секреторных иммуноглобулинов предрасполагают к развитию воспалительных реакций инфекционной этиологии, а значительное их повышение с большой вероятностью может свидетельствовать о наличии активного воспалительного процесса [7].
Секреторный иммуноглобулин А (sIgA) является основным иммуноглобулином всех биологических
секретов (слюны, секретов слезной и молочной желез, пищеварительного и респираторного трактов) и выполняет защитную функцию на слизистых оболочках. Концентрация sIgA у детей раннего возраста существенно ниже, чем у взрослых, что является одной из причин большей восприимчивости
этой категории пациентов к развитию инфекционного воспаления, в т. ч. заболевания твердых тканей зубов инфекционной этиологии – кариеса зубов (КЗ).
Открытия последних лет демонстрируют важную роль грудного молока в формировании здоровой микрофлоры (МФ), развитии врожденного и приобретенного иммунитета. Вскармливание материнским молоком является “золотым” стандартом питания ребенка первого года жизни.
Грудное молоко содержит ряд факторов, обладающих защитными свойствами, среди которых наиболее хорошо изучены бактерии (одни из наиболее часто выделяемых – Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium bifidum, Bifidobacterium catenualatum, Bifidobacterium breve,
Bifidobacterium adolescentis [9]), иммуноглобулины, лактоферрин, лизоцим и некоторые другие. Олигосахариды женского молока обладают выраженным пребиотическим эффектом – они стимулируют рост бифидобактерий в толстой кишке, что ведет к торможению развития патогенной и условнопатогенной флоры.
В отсутствие естественного вскармливания выбор адаптированной молочной смеси становится одним из ключевых факторов формирования здоровья ребенка, в т. ч. и профилактики КЗ.
В настоящее время установлено, что Lactobacillus rhamnosus является естественным антагонистом Streptococcus mutans, играющего ключевую роль в инициировании кариозного процесса. Смеси NAN 3 и 4, содержащие L. rhamnosus в сочетании с оптимальным углеводным комплексом, представленным лактозой и мальтодекстрином (с низким декстрозным эквивалентом), могут стать одним из возможных средств снижения риска развития КЗ на протяжении первых лет жизни ребенка [4, 13].
МФ ПР в норме представлена различными видами микроорганизмов. Известно, что нарушение баланса
между МФ и местным иммунитетом формирует благоприятные условия для развития КЗ. Его возникновение связывают также с микроорганизмами, образующими налет на поверхности зубов, где главную роль играют бактерии S. mutans.
В настоящее время общепризнанно, что заболевания твердых тканей зубов очень тесно связаны с нарушением нормального микробиоценоза ПР.
Состав МФ зависит от слюноотделения, консистенции и характера пищи, а также от гигиены ПР, состояния тканей, органов ПР и наличия соматических заболеваний. Начальная колонизация ПР стрептококками (главным образом S. mutans, S. salivarius) и далее актиномицетами определяет дальнейшее разнообразие микробного пейзажа. В основном формирование здоровой МФ РП завершается к 4 годам [10].
Хорошо известна важная роль иммунной системы слизистых оболочек и ассоциированной с ними лимфоидной ткани в осуществлении барьерного и иммунорегуляторного гомеостаза макроорганизма. Поверхности слизистых оболочек покрыты слоем эпителиальных клеток и слизью, предотвращающими попадание экзогенных антигенов в организм. Эпителиальные клетки формируют физический барьер
за счет движения ресничек, продукции слизи, секреции молекул с антибактериальной и цитолитической активностью. В совокупности эти врожденные механизмы в ассоциации с нормальной МФ обеспечивают первую линию защиты против возбудителей инфекционных заболеваний, чужеродных анти- и аллергенов.
Ключевое положение в коррекции нарушений МФ, согласно последним исследованиям, занимают пробиотики – препараты, содержащие живые микроорганизмы, которые при естественном способе введения в адекватных количествах оказывают благоприятное действие на физиологические
функции и биохимические реакции организма через оптимизацию его иммунологического статуса [2, 3].
Наиболее важным свойством пробиотических бактерий является обеспечение колонизационной резистентности, т. е. защиты от проникновения во внутреннюю среду организма как бактерий, так и токсических продуктов различного происхождения. В комплексе механизмов колонизационной резистентности важную роль играют антагонистическая активность пробиотической культуры, ее
способность колонизировать слизистую оболочку, а также формировать адекватный мукозальный иммунитет [1, 11].
Действие пробиотиков не сводится к простому заселению желудочно-кишечного тракта. Их влияние более сложно и многопланово. Они стимулируют иммунные реакции (увеличивают титр антител, макрофагальную активность, количество Т-киллеров, продукцию интерферонов, концентрацию
IgA и т. д.).
Пробиотическими штаммами с подтвержденной на сегодня эффективностью, прежде всего у детей раннего возраста, являются B. lactis BB-12, L. rhamnosus GG и Streptococcus thermophiles. Доказано, что прием B. lactis BB-12 достоверно увеличивает уровень продукции IgA у детей раннего воз-
раста [6]. Следует отметить важность видоспецифичности штаммов, каждый из которых необходимо применять в строго определенном возрасте.
Известно несколько работ по использованию продуктов с пробиотиками для профилактики КЗ у детей [5, 8], однако в России мы не встретили ни одного исследования о применении адаптированных молочных смесей с пробиотиками в профилактике КЗ, в т. ч. кариеса раннего детского возраста.
В связи с высокой восприимчивостью детей раннего возраста к развитию инфекционного воспаления ПР и КЗ нами было изучено влияние включения в диету адаптированной молочной смеси, содержащей пробиотики, на уровень sIgA слюны и состав биопленки зубов у детей раннего возраста.
Материал и методы
Исследование проводилось в специализированном Доме ребенка № 14 ЮЗАО Москвы. Под наблюдением находились 53 соматически здоровых ребенка в возрасте от года до 4 лет. Двадцати семи детям в рацион питания была введена адаптированная молочная смесь, содержащая пробиотики, 26 детей составили группу сравнения. Наблюдение за детьми проводилось в течение 3 месяцев.
Основная группа в зависимости от возраста была поделена на две подгруппы: дети до 1,5 лет и старше 1,5 лет. Первые получали адаптированную молочную смесь NAN 3, вторые – NAN 4 (согласно инструкции производителя). Дети получали питание молочной смесью в дополнение к обычной диете 1 раз в день – во время полдника (в 16.00), по инструкции (7 мерных ложек порошка на 210 мл воды). Группа сравнения в то же время получала молочные продукты, не содержавшие пробиотики.
И в основной группе, и в группе сравнения раз в месяц проводились контролируемые уроки гигиены ПР.
Перед началом исследования были проведены собрания с медицинским персоналом и воспитателями детского дома, на которых были освещены задачи исследования, основные принципы профилактики стоматологических заболеваний среди детей младшего возраста, правила ухода за зубами.
Оценка пораженных кариесом зубов проводилась при помощи индекса КПУ, оценка индекса гигиены (ИГ) – по методу Федорова–Володкиной.
Уровень иммуноглобулинов в слюне определяли методом радиальной иммунодиффузии по Манчини в модификации Е.В. Чернохвостовой дважды: до введения смеси и через 3 месяца от начала приема. Учитывали, что концентрация sIgA в слюне здоровых детей составляет от 70 до 250 × 10-3 г/л
Изучение основной пародонтопатогенной, кариесогенной и резидентной МФ проведено с помощью
бактериологических и молекулярно-биологических исследований с применением мультиплексной полимеразной цепной реакции.
Результаты и обсуждение
Изучение основных параметров стоматологического статуса наблюдаемых детей показало высокую распространенность и интенсивность кариеса временных зубов на фоне неудовлетворительного состояния гигиены ПР. Распространенность КЗ в основной группе и группе сравнения была соответственно 80 и 79 %. Интенсивность КЗ по индексу КПУ составила в группе сравнения 2,6, в основной группе – 2,4. У детей чаще отмечалось поражение кариесом временных верхних передних резцов и первых верхних и нижних моляров. Следует отметить, что через 3 месяца в обеих группах наблюдения данные показатели не изменились.
Исходное значение ИГ у всех детей было неудовлетворительным. Значение ИГ в группе сравнения =
2,4; в основной группе = 2,5. Следует отметить выраженную положительную динамику изучаемого параметра в процессе исследования в обеих группах детей. Возможно, это объясняется повышением мотивации к проведению гигиенических мероприятий персоналом, ухаживающим за детьми, регулярными контролируемыми уроками гигиены. Так, через 3 месяца значение ИГ в группе сравнения составило 1,3, в основной группе – 1,1. Таким образом, редукция изучаемого параметра составила соответственно 45,9 и 56,0 %; необходимо отметить более выраженное улучшение ИГ в группе детей,
получавших пробиотики, – на 10,1 % выше по сравнению с контролем.
В результате проведенного обследования было установлено, что уровень sIgA в слюне изначально был снижен более, чем у половины детей (в 55 % случаев), и не превышал 65 × 10-3 г/л (при норме от 70 × 10-3 г/л), а у 45 % соответствовал возрастным показателям и не имел отклонений от нормальных величин, причем у детей основной группы указанные показатели составили 61 и 39 %, а у детей группы сравнения – 47 и 53 % соответственно. Детей с повышенным уровнем sIgA в слюне в нашем исследовании не было (рис. 1)
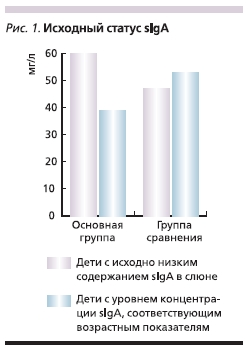
При анализе уровня sIgA в слюне в динамике нами была отмечена взаимосвязь между исходным уровнем этих показателей и последующим изменением их концентрации. Направление количественных изменений концентраций иммуноглобулинов в слюне зависело от их исходных значений, поэтому для анализа полученных данных все обследуемые нами пациенты были разделены на подгруппы в зависимости от этих значений: дети с исходно низким содержанием sIgA в слюне и с
концентрацией, соответствующей возрастным показателям. Очевидно, что исходно средние значения концентрации sIgA в слюне по подгруппам достоверно различались (р < 0, 05).
При анализе данных о концентрации sIgA в слюне через 3 месяца от начала приема смеси NAN нами в основной группе и в группе сравнения рассматривались те же подгруппы пациентов: с низким и соответствующим возрастным нормам уровнями sIgA в слюне. Достоверность различий между средними показателями в подгруппах сохранялась, однако в основной группе наблюдалось статистически значимое повышение содержания sIgA в слюне у 62 % пациентов с исходно низкими его значениями (у подавляющего большинства детей – до средневозрастных значений), у 38 % пациентов низкий
уровень sIgA сохранялся. В подгруппе с исходно нормальными концентрациями sIgA статистически значимых изменений этого показателя отмечено не было, и он сохранялся на возрастном уровне у всех детей, за исключением одного пациента, у которого отмечено значительное снижение концентрации
sIgA в слюне.
В группе сравнения у пациентов с исходно низкими значениями sIgA в слюне у 66 % детей отмечено снижение этого показателя до еще более низкого уровня, а у 34 % пациентов динамики не наблюдалось. Иными словами, восстановления содержания sIgA в слюне не было отмечено ни у одного пациента. В подгруппе с нормальным содержанием sIgA в слюне у 50 % пациентов сохранялись значения этого показателя, соответствующие возрастной норме, у половины отмечена отрицательная динамика, причем у 30 % детей имело место снижение sIgA ниже допустимых значений, а у 20 % – повышение sIgA значительно выше возрастной нормы, что может свидетельствовать о присоединении
инфекционного процесса (рис. 2).
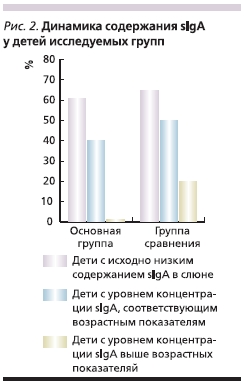
Таким образом, в результате включения в диету детей раннего возраста смеси NAN с пробиотиками концентрация sIgA в слюне приблизилась к средневозрастной норме у 62 % пациентов с изначально недостаточной концентрацией этого иммуноглобулина, в то время как в группе контроля такой тенденции не было отмечено ни у одного ребенка. Отрицательная динамика содержания sIgA в слюне на фоне диетотерапии замечена только у одного пациента основной группы и у 63 % детей группы сравнения.
Интересные данные были получены нами при анализе микробиологического статуса обследованных детей. Исходно у детей группы сравнения (рис. 3) выделен широкий спектр микроорганизмов, в целом характерный для возрастной группы от года до 4 лет, соответственно возрасту прорезывания
временных зубов.
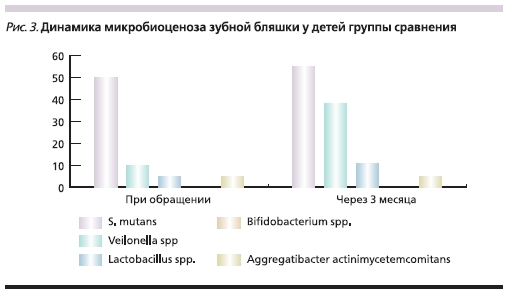
У половины включенных в исследование детей выделен основной кариесогенный вид – S. mutans. Степень обсемененности им была значительной – 106 КОЕ. На долю второй по значимости кариесогенной группы – актиномицетов – приходилось 15 % находок. Представители лактобациллярной флоры были обнаружены у 5 % детей группы сравнения, а бифидобактерии – ни в одном случае. Основные антагонисты кариесогенной флоры (Veillonella spp., Streptococcus salivarius,
Corinebacterium spp.) выделялись значительно реже – у 5–15 % детей.
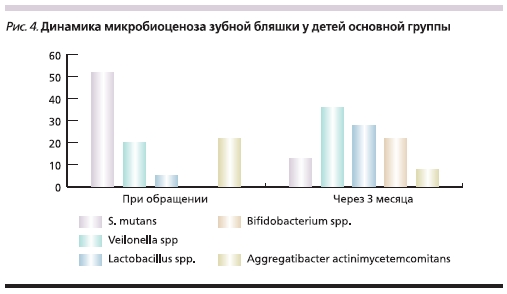
Через 3 месяца после начала применения молочных смесей NAN у детей основной группы были отмечены существенные изменения в составе МФ по сравнению с группой сравнения (рис. 4). При этом S. mutans выделялся только у 14,2 % пациентов, т. е. наблюдалось статистически достоверное снижение обсемененности этим микробом по сравнению с исходными данными (58 %) и контрольной
группой (52 %). Примерно в 3 раза увеличивалась частота обнаружения микробов-антагонистов – Veillonella spp. (до 34,2 %) и S. salivarius (до 52,6 %). Кроме того, отмечено появление фузобактерий (10,5 %), которые ранее не обнаруживались. Данная динамика микробиоценоза ПР безусловно расценивалась нами как положительный результат.
Статистически достоверно на фоне приема смесей NAN 3 и 4 увеличивалась частота выделения лакто- и бифидобактериальной флоры, что свидетельствует об успешной колонизации биопленки зубов штаммами молочнокислых бактерий. Так, выделение лактобактерий составилo 28,6 % (против 10,5 % в группе сравнения), а бифидобактерий – 21,4 % (в отсутствие в определяемом количестве в группе сравнения). Количественная обсемененность данными видами составила 106 КОЕ.
Среди детей группы сравнения (не получавших смесь, обогащенную пробиотиком) основной кариесогенный вид – S. Mutans – через 3 месяца наблюдения выделяли в половине случаев. Степень обсемененности данным видом была значительной – 106 КОЕ. На долю второй по значимости кариесогенной группы – актиномицетов – приходилось 15 % находок. Лактобациллярная флора была обнаружена только у 5 % детей группы сравнения, а бифидобактерии – ни в одном случае (рис. 4). Антагонисты кариесогенной флоры (Veillonella spp., S. salivarius, Corinebacterium spp.) среди детей группы сравнения выделялись значительно реже (5–15 %), чем в основной группе.
Таким образом, в ходе изучения влияния включения в диету детей раннего возраста адаптированной молочной смеси NAN, содержащей пробиотики, было показано ее положительное модулирующее влияние на уровень sIgA слюны и состав биопленки зубов, что может предупреждать развитие КЗ.
Выводы
Впервые проведенное в России исследование по изучению роли пробиотиков в профилактике стомато-
логических заболеваний среди детей раннего возраста показало их высокую эффективность по всем изучаемым параметрам. Назначение смеси NAN с пробиотиками индуцирует оптимальный местный синтез sIgA на слизистых оболочках ПР. При исходно низком уровне sIgA в слюне применение смеси
NAN с пробиотиками позволяет повышать его концентрацию до оптимальных значений.
Применение адаптированной молочной смеси с пробиотиками приводит к достоверному снижению обсемененности бактериями кариесогенной флоры при одновременном увеличении количества ее антагонистов.
Результаты проведенного исследования будут способствовать разработке новых подходов к профилактике КЗ у детей.



