Известно, что наличие неиммунной водянки плода значительно повышает перинатальную заболеваемость и смертность [1].
При выявлении неиммунной водянки плода важным является определение причины, приведшей к развитию данного осложнения, потому что именно этиология определяет дальнейшую тактику ведения беременности и возможность проведения внутриутробного лечения [2]. В случаях курабельности заболевания возможно антенатальное проведение этиопатогенетической и симптоматической терапии, что позволяет пролонгировать беременность как можно ближе к доношенному сроку, а в части случаев – уменьшить или полностью купировать явления неиммунной водянки плода [3].
На основании рекомендаций по ведению беременных с неиммунной водянкой плода ведущих мировых сообществ [2–4], а также клинико-диагностических возможностей ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» был сформирован и внедрен в клиническую практику внутренний протокол обследования беременных женщин с данной патологией плода.
Мы полагаем, что данный подход позволит улучшить перинатальные исходы и значительно сократить финансовые расходы на лечение и выхаживание детей с неиммунной водянкой.
Цель исследования – оценить эффективность применения алгоритма обследования при неиммунной водянке плода на основании частоты антенатально установленных причин и исходов беременности.
Материалы и методы
Исследование проводили на базе акушерских и неонатальных отделений ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» (далее – Центр).
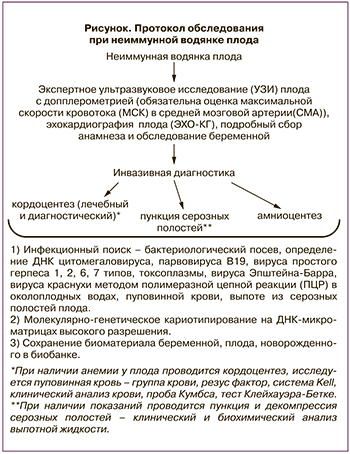 В Центре с 2018 г. был принят протокол по ведению пациенток с неиммунной водянкой плода (рисунок), целью которого является определение причины, приведшей к развитию данного осложнения.
В Центре с 2018 г. был принят протокол по ведению пациенток с неиммунной водянкой плода (рисунок), целью которого является определение причины, приведшей к развитию данного осложнения.
В соответствии с поставленной целью в исследование были включены беременные женщины с неиммунной водянкой плода, родоразрешенные в Центре с 2015 по 2020 гг. (n=45), пациентки разделены на 2 группы. В 1-ю группу (n=30) вошли беременные с неиммунной водянкой плода, антенатально обследованные и в части случаев получившие внутриутробное лечение (проспективная группа с 2018 по 2020 гг.); во 2-ю группу (n=15) – антенатально не обследованные и не получившие внутриутробного лечения (ретроспективная группа с 2015 по 2018 гг.). Отбор беременных проводился на перинатальном консилиуме Центра.
До 2018 г. антенатального обследования и внутриутробного лечения при неиммунной водянке плода не проводилось. Оценивались только данные экспертного УЗИ плода, в части случаев – данные эхокардиографии (Эхо-КГ). Беременные из 2-й группы поступали в Центр только для родоразрешения.
Всем пациенткам было проведено экспертное УЗИ плода. Оценивались следующие параметры: наличие и вид структурной патологии плода, количество серозных полостей с выпотом, объем выпота, наличие и степень гипоплазии легких, компрессии сердца, наличие, толщина и распространенность отека мягких тканей плода, а также количество околоплодных вод и толщина плаценты. Допплерометрически измерялась МСК в СМА плода, усиление которого больше 1,505 МоМ являлось признаком анемии [5]. После 20–22 недели проводилась Эхо-КГ плода на аппарате VOLUSON S8 с целью определения структурной или функциональной патологии сердца, клапанов и магистральных сосудов, наличия выпота в полости перикарда и его объема, а также ряд параметров, оценивающих функциональное состояние сердца плода. Необходимо отметить, что оценка МСК в СМА и Эхо-КГ плода во 2-й группе проведена не всем пациенткам.
После госпитализации в Центр проводились подробный сбор соматического и акушерско-гинекологического анамнеза, тщательный физикальный осмотр. При сборе анамнеза беременной важное внимание было уделено выявлению аутоиммунных и гематологических заболеваний (в особенности талассемии), перенесенных инфекционных заболеваний, особенно сопровождавшихся подъемом температуры во время беременности. Данные факторы могли являться причинами развития неиммунной водянки плода.
С момента госпитализации беременной в стационар и до родоразрешения за состоянием плода проводили динамический ультразвуковой, допплерометрический и кардиомониторный контроль.
Описание антенатального обследования в 1-й группе
При отсутствии противопоказаний проводился диагностический амниоцентез. В части случаев при наличии показаний одномоментно проводились и лечебные мероприятия. Так, при анемии у плода – кордоцентез с переливанием эритроцитной массы, обедненной лейкоцитами и тромбоцитами (ЭМОЛТ); торакоцентез, лапароцентез, установка торако-амниотического шунта с целью декомпрессии серозных полостей. В случае кордоцентеза с переливанием ЭМОЛТ оценивался уровень гемоглобина, гематокрита до и после переливания. При проведении торакоцентеза, лапароцентеза и установки торако-амниотического шунта выпотная жидкость из серозных полостей подвергалась клиническому и биохимическому анализу с целью выяснения природы выпота. Весь биологический материал плода направлялся на вирусологическое и микробиологическое исследование, а также подвергался биобанкированию.
Молекулярно-генетическое кариотипирование проводилось на ДНК-микроматрицах высокого разрешения (Cytoscan 750К, Affymetrix). ДНК выделялась из свежей цельной крови или амниотической жидкости с помощью набора PureLink Genomic DNA Kit (Invitrogen, США).
Поиск инфекционных факторов проводился методом полимеразной цепной реакции (ПЦР). Выделение ДНК из образцов клинического материала проводили при помощи набора ПРОБА-ЦИТО (ООО НПО «ДНК-Технология», Россия) согласно инструкции. Амплификацию специфических фрагментов ДНК инфекционных агентов проводили с помощью коммерческих комплектов реагентов ООО НПО «ДНК-Технология» (Россия) в режиме «реального времени» на приборе «ДТ-964» (ООО НПО «ДНК-Технология», Россия).
Постнатальное обследование на наследственные болезни обмена веществ проводилось методом тандемной масс-спектрометрии. Показаниями для его проведения являлись случаи идиопатической неиммунной водянки или клинико-лабораторные проявления, характерные для заболеваний этой группы.
В зависимости от выявленной этиологии и клинических проявлений неиммунной водянки плода применялись следующие методы фетального воздействия:
- этиопатогенетическая терапия: антиаритмическая терапия, внутриутробное переливание эритроцитной массы, противовирусная терапия, иммуноглобулинотерапия, антибиотикотерапия, интерстициальная лазерная коагуляция сосудов, питающих крестцово-копчиковую тератому;
- симптоматическая терапия: амниоредукция, торакоцентез, лапароцентез, торако-амниотическое шунтирование, трансплацентарная кардиотоническая терапия дигоксином, введение кортикостероидов.
Во 2-й группе постнатальное обследование проводилось индивидуально по показаниям. В случае множественных пороков развития и признаков дизэмбриогенеза по заключению врача-генетика проводилось кариотипирование.
В обеих группах в случае мертворождения или неонатальной смерти проводилась аутопсия.
Статистическую обработку полученных данных проводили с помощью программы IBM SPSS Statistica 22. Использовались непараметрические методы статистического анализа. Для описания количественных данных оценивались медианы и интерквартильный размах (Ме, (Q1;Q3)). Сравнение между группами по качественным признакам осуществлялось с помощью критерия χ2. Статистическую значимость различий между группами по количественным признакам оценивали по значению p-value теста Манна–Уитни. При величине p≤0,05 отличие принимали за статистически значимое.
Результаты и обсуждение
Анализ соматического, акушерско-гинекологического анамнеза беременных и течения данной беременности не выявил статистически значимых различий между группами (р≥0,05) (табл. 1).
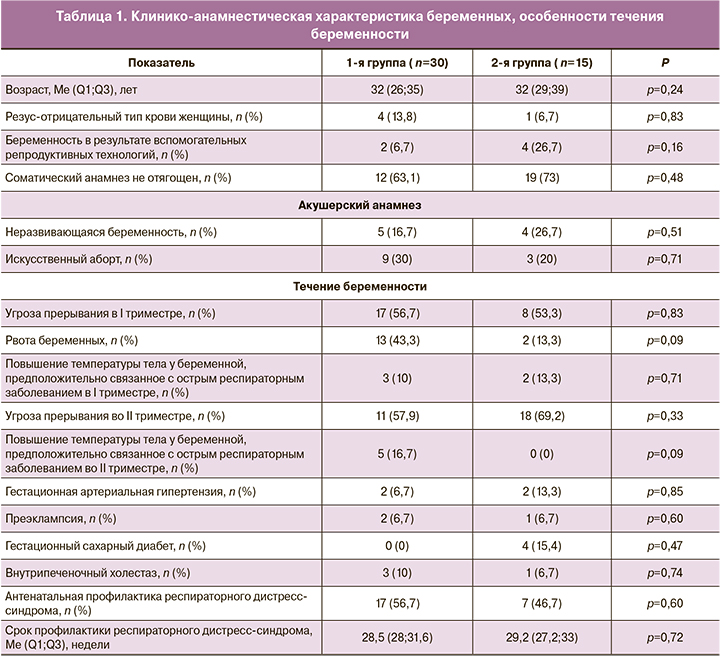
В зависимости от данных УЗИ, Эхо-КГ плода, антенатального и постнатального обследования все случаи были распределены в одну из 14 категорий заболеваний (табл. 2), предложенных C.Bellini et al. (2015) [6].
В 1-й группе на основании протокола обследования этиология неиммунной водянки плода антенатально установлена в 83,3% (25/30) случаев, а 16,7% (5/30) случаев отнесены к идиопатической категории. Проведенное постнатальное обследование подтвердило антенатально установленные причины. Во 2-й группе этиология антенатально была установлена в 60% (9/15) случаев (на основании УЗИ плода), а в 26,7% (4/15) случаев – постнатально. Постнатально в данной группе были выявлены следующие причины неиммунной водянки плода: в 1 случае – герпетическая инфекция, в 1 – синдром Нунана, в 1 – трисомия по 18 хромосоме и в 1 случае – хилоторакс.
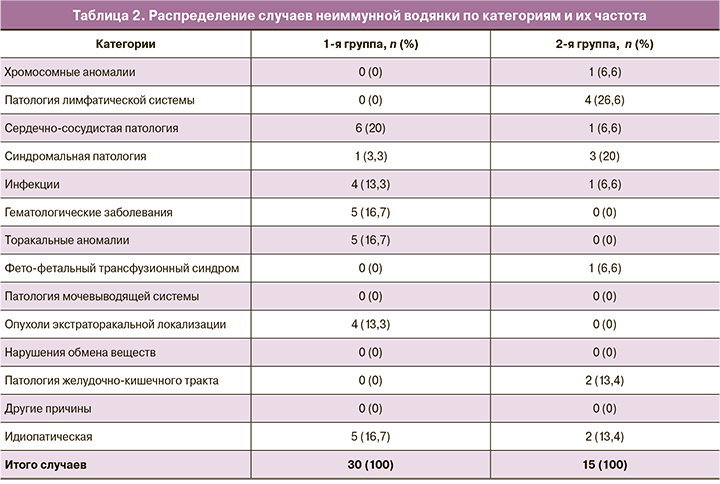
Частота встречаемости врожденных пороков развития (ВПР) плода статистически значимо не различалась между группами: в 1-й группе – 33,3% (10/30) против 46,7% (7/15) во 2-й группе (р=0,58). Среди ВПР в 1-й группе встречались кистозно-аденоматозный порок развития легкого (КАПРЛ) – 13,3% (4/30), крестцово-копчиковая тератома (ККТ) – 13,3% (4/30), тератома переднего средостения – 3,3% (1/30). Структурные пороки и их частота, выявленные по данным УЗИ, представлены в таблице 3. Расхождений в диагнозах (ВПР) на антенатальном и постнатальном этапах выявлено не было в обеих группах.
К категории сердечно-сосудистой патологии в 1-й группе отнесены случаи нарушений ритма сердца у плода и изолированные ВПС: в 13,3% (4/30) – тахиаритмии, в 3,3% (1/30) – атриовентрикулярная блокада (АВ-блокада) и в 3,3% (1/30) – синдром гипоплазии левых отделов сердца с рестриктивным овальным окном. АВ-блокада у плода была следствием аутоиммунного заболевания беременной (синдром Шегрена, ревматоидный артрит); были обнаружены антитела к SSA (Ro) в высоких титрах и антиядерные антитела. После прохождения через плаценту материнские антитела к SSA (Ro) и антиядерные антитела перекрестно реагируют с L-типами кальциевых каналов в клетках сердца у плода, вследствие чего возникает замедление атриовентрикулярной проводимости (АВ-блокада). Во 2-й группе к данной категории отнесен случай тахиаритмии у плода – 6,7% (1/15).
ВПС встречались как изолированно, так и в сочетании с ВПР. В 1-й группе ВПС были антенатально выявлены в 23,3% (7/30) случаев, основная доля которых приходилась на дефект межжелудочковой перегородки (ДМЖП) – 16,7% (5/30). ДМЖП изолированно встречался в 3,3% (1/30) случаев, а в сочетании с ВПР – в 13,3% (4/30): в 6,6% (2/30) – при ККТ, в 6,6% (2/30) – при КАПРЛ. В 6,6% (2/30) наблюдались комбинированные ВПС (синдром гипоплазии левых отделов сердца с рестриктивным овальным окном, ДМЖП и коарктация аорты, ДМЖП). Во 2-й группе ВПС антенатально были выявлены в 40% (6/15) случаев, из них в 33,3% (5/15) был диагностирован ДМЖП. В большинстве случаев ДМЖП наблюдался в сочетании с ВПР и с другими ВПС: в 6,7% (1/15) – с кистозной гигромой шеи, в 6,7% (1/15) – с патологией аорты и аортального клапана и ВПР центральной нервной системы, в 6,7% (1/15) – в составе комбинированного порока сердца (гипоплазия левого желудочка, коарктация аорты, ДМЖП), и в 6,7% (1/15) – с ВПР центральной нервной системы. Изолированно ДМЖП наблюдался в 6,7% (1/15) случаев.
В 1-й группе молекулярно-генетическое кариотипирование проводилось на ДНК-микроматрицах высокого разрешения на биологическом материале плода – анеуплоидий выявлено не было. Во 2-й группе кариотипирование проводилось постнатально по показаниям – выявлен 1 случай трисомии 18 хромосомы у новорожденного с множественными ВПР.
Важная роль в диагностике отводится оценке МСК в СМА плода [5]. Так, анемия у плода в 1-й группе была выявлена в 26,7% (8/30), при этом в 10% (3/30) анемия была обусловлена инфекционными агентами – в 2 случаях парвовирусом В19, в 1 случае цитомегаловирусом. Во 2-й группе антенатальная оценка МСК в СМА проводилась не во всех случаях, и при рождении в 27,3% (3/11) случаев по данным клинического анализа крови была диагностирована врожденная анемия тяжелой степени и потребовала коррекции в раннем неонатальном периоде. Из них в 2 случаях анемия наблюдалась у новорожденных с множественными пороками развития, и в 1 случае – у новорожденного с врожденной герпетической инфекцией, которая также была диагностирована постнатально.
Таким образом, в 1-й группе, где проводилось антенатальное обследование, спектр причин неиммунной водянки плода был шире и содержал не только пороки развития плода, но и инфекционные и гематологические причины. Структура причин неиммунной водянки плода во 2-й группе антенатально представлена только лишь пороками развития плода, и только более детальное постнатальное обследование позволило уточнить и дополнить этиологическую структуру путем диагностики инфекционных, хромосомных, синдромальных, гематологических факторов. Своевременное выявление причины неиммунной водянки плода позволило бы изменить тактику ведения беременности в данной группе.
После обследования в 1-й группе на основании этиологии и клинических проявлений был применен дифференцированный подход к внутриутробному лечению – в 56,7% (17/30) случаев были применены различные методы внутриутробного лечения. Примененные фетальные вмешательства представлены в таблице 4.
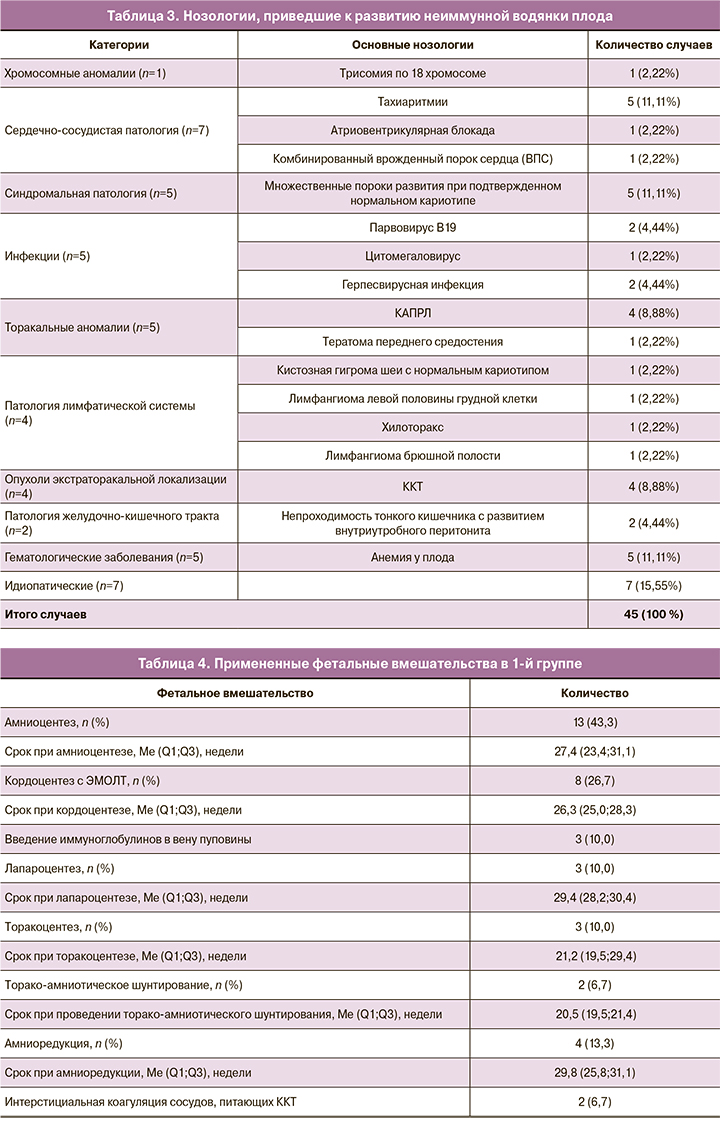
Тахиаритмии и явления декомпенсации сердечной деятельности у плода являлись показанием к назначению трансплацентарной медикаментозной терапии [7–9]. Антиаритмическая терапия проводилась дигоксином и соталолом с одновременным назначением препаратов калия.
Важным признаком, характеризующим тяжесть внутриутробной сердечной недостаточности, является недостаточность трикуспидального клапана [9]. В 1-й группе данный признак выявлен в 56,7% (17/30) случаев, из которых в 43,3% (13/30) проводилась терапия дигоксином.
Длительность, кратность и эффективность методов внутриутробного лечения определялась в динамике на основании данных УЗИ и Эхо-КГ плода.
Основные характеристики при рождении представлены в таблице 5. Признаки водянки имели чаще новорожденные из 2-й группы, по сравнению с 1-й группой – 15/15 (100%) новорожденных против 19/30 (63,3%) (р=0,02). Наиболее успешно внутриутробный регресс явлений неиммунной водянки плода наблюдался на фоне применения этиопатогенетической терапии тахиаритмий и анемий у плода.
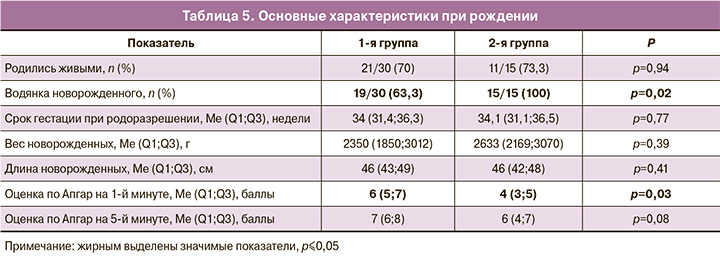
Частота живорождений статистически значимо не отличалась между группами – 70% (21/30) в 1-й группе против 73,3% (11/15) во 2-й группе (р=0,94). Однако частота неонатальной смертности была статистически значимо выше во 2-й группе по сравнению с 1-й группой – 73,8% (8/11) против 23,8% (5/21) (р=0,002). Таким образом, общая выживаемость в 1-й группе составила 53,3% (16/30), тогда как во 2-й группе – 20% (3/15).
Заключение
Необходимо отметить, что внедрение протокола обследования привело к увеличению выявляемости причин неиммунной водянки плода на антенатальном этапе, особенно тех причин, которые не связаны с пороками развития у плода. Данный протокол позволил более детально оценить морфологическое и функциональное состояние плода, провести лечебные мероприятия, а также оценить их эффективность. Дальнейшая работа в этом направлении позволит аргументированно принимать обоснованное решение о тактике ведения беременности с учетом прогноза для жизни плода и новорожденного.



