Введение
Появление нового класса лекарственных препаратов – блокаторов PD1 и CTLA4 – открыло поистине новые горизонты в практике онкологов. В течение последних 5 лет нет, пожалуй, ни одного онкологического конгресса, съезда или конференции, на которых бы не обсуждали новые достижения и успехи, связанные с различными режимами применения блокаторов PD1 в комбинациях и в монотерапии, в расчетных дозах или в плоской дозе в первой или последующих линиях. Проблема первичной резистентности к иммунотерапии обсуждается так же широко, как и неоспоримые и яркие клинические успехи на фоне ее применения, а работ, посвященных поискам маркеров резистентности или чувствительности, становится все больше.
Тем не менее по мере внедрения иммуноонкологических лекарственных препаратов (блокаторов PD1 в первую очередь) в широкую клиническую практику у практикующих врачей накапливается опыт клинических ситуаций, который, на наш взгляд, незаслуженно обходят вниманием организаторы международных конференций.
Данные ситуации можно охарактеризовать как неожиданно бурный рост опухолевой массы после начала иммунотерапии, который приводит к ухудшению общего состояния больного и бесспорно является признаком истинного прогрессирования заболевания, но не псевдопрогрессированием, механизмы которого связаны с увеличением доли иммунной инфильтрации опухолевых узлов.
Это явление, которое в узком кругу специалистов получило название «гиперпрогрессирование», чрезвычайно непросто отличить от естественного течения заболевания, которое также может сопровождаться этапом бурного роста опухоли. Поэтому, по всей видимости, не все специалисты в области клинической онкологии готовы высказаться относительного того, действительно ли это явление существует.
В данном обзоре литературы мы проанализируем некоторые известные аргументы «за» и «против» существования такого явления.
Клинический случай 1
Пациентка А.М.Б. 42 лет, женщина. С детства имела множество пигментных пятен на теле (некоторые врожденные), на волосистой части головы – гигантский врожденный невус (занимает практически всю волосистую часть головы).
В 2016-го и мае 2018 г. по месту жительства проведено иссечение узловых образований волосистой части головы. Пациентка отметила продолженный рост образования, появление новых узловых образований волосистой части головы, а также увеличение лимфоузлов шеи слева.
В одной из клиник 10.07.2017 было выполнено хирургическое лечение в объеме иссечения меланомы кожи головы с пластикой дефекта местными тканями, шейная функциональная лимфодиссекция слева (I–V). Гистологическое исследование № 29774/2018 (пересмотр в НМИЦ онкологии им. Н.Н. Блохина): в готовом препарате три фрагмента лимфатического узла с метастазами веретено- и эпителиоидноклеточной меланомы без прорастания капсулы.
При дообследовании, по данным компьютерной томографии грудной полости от 29.06.2018, очагово-подобные уплотнения в S4 правого легкого и S9 левого легкого (0,5 и 0,2 см соответственно) расценены как метастазы. По данным ультразвукового исследования (УЗИ) от 07.08.2018, в затылочной области на границе волосистой части визуализировался лимфатический узел размером 0,7×0,6 см с нечеткими, неровными контурами пониженной эхогенности. Выше, примерно на 2 см – конгломерат размером 1,7×0,9 см из двух узлов аналогичной структуры. В левой сосцевидной области – аналогичный узел размером 0,9×0,8 см. В мягких тканях волосистой части головы в затылочной области слева на фоне послеоперационной деформации и отека визуализировался узел 0,4 см с нечеткими контурами пониженной эхогенности. Уровень лактатдегидрогеназы (ЛДГ) на момент обращения был ниже верхней границы нормы (ВГН). По данным молекулярно-генетического исследования, мутаций в опухоли в генах BRAF, NRAS, CKIT не обнаружено.
На приеме в НМИЦ онкологии им. Н.Н. Блохина 09.08.2018 рекомендовано дообследование и терапия блокатором PD1 в монорежиме. Терапия была выбрана с учетом малой распространенности заболевания, отсутствия каких-либо симптомов, отсутствия активирующих мутаций в генах BRAF, CKIT, а также доступности лекарственного препарата в регионе проживания.
С 13.08.2018 по 24.09.2018 получила 4 введения ниволумаба 208 мг (3 мг/кг) внутривенно капельно с интервалом 2 недели. После первого же введения отметила рост узлов на шее слева. Эффект был расценен как псевдопрогрессирование, терапия продолжена. По данным ПЭТ-КТ (позитронно-эмиссионная компьютерная томография), в режиме все тело с 18 ФДГ, от 26.08.2018 (перед 2-м введением) распространенность болезни с учетом уточнения была существенно больше, также отмечено поражение печени, яичников, лимфоузлов средостения, множественные очаги в легких, а также рост уровня ЛДГ выше 1,5 ВГН.
Терапия продолжена в прежнем режиме. После каждого последующего введения пациентка отмечала увеличение объемов опухоли, что подтверждалось и объективными данными (рис. 1). На консилиуме было принято решение присоединить к терапии блокатором PD1 полихимиотерапию.
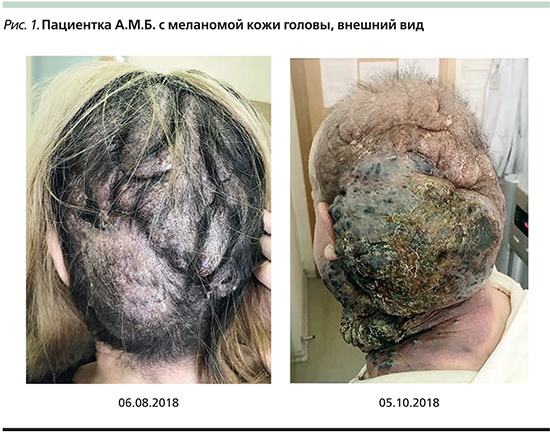
Первый цикл химиотерапии (ХТ) по схеме паклитаксел 175 мг/м2 день 1+карбоплатин (AUC=6) день 1 выполнен 03.09.2018 – без эффекта. Наблюдался продолженный рост опухоли в мягких тканях волосистой части головы и шеи, дисфагия 3–4-й степеней. Биопсия опухоли мягких тканей шеи выполнен 25.09.2018, выявлены мелкие фрагменты опухоли (эпителиоидноклеточной пигментной меланомы); 28.09.2018 установлена пункционная гастростома. В настоящее время пациентка получает паллиативное лечение по месту жительства, ниволумаб и ХТ отменены.
Клинический случай 2
Пациент Н.С.А. 65 лет, мужчина.
В декабре 2003 г. по месту жительства иссечена меланома кожи передней брюшной стенки, Гистологически – меланома кожи (без дополнительного уточнения). Там же проведен курс адъювантной иммунотерапии в течение года. Наблюдался в НМИЦ онкологии им. Н.Н. Блохина. В июле–августе 2007 г. отметил уплотнение в зоне послеоперационного рубца. При контрольном обследовании в НМИЦ онкологии им. Н.Н. Блохина по УЗИ выявлено образование 1,1×1,0 см – метастаз, других проявлений заболевания не выявлено. 10.10.2007 проведено иссечение рецидива в области послеоперационного рубца передней брюшной стенки. Послеоперационный период без осложнений. Гистологически – метастаз меланомы. В феврале 2008 г. при контрольном обследовании выявлены увеличенные паховые лимфоузлы слева; 20.02.2008 – операция Дюкена слева, в одном из трех лимфоузлов – метастаз меланомы. Проведено динамическое наблюдение. В июле 2017 г. выявлено прогрессирование заболевания: метастаз в мягких тканях передней брюшной стенки – единственное проявление заболевания, нормальный уровень ЛДГ.
С 04.08.2017 по 17.11.2017 выполнено пять введений пембролизумаба. После каждого введения пембролизумаба отмечено увеличение размера таргетного очага, что было расценено как псевдопрогрессирование. При двух последовательных инструментальных измерениях на компьютерной томографии 27.10.2017 и 24.11.2017 отмечено убедительное прогрессирование заболевания в виде бурного роста метастатического узла (рис. 2).
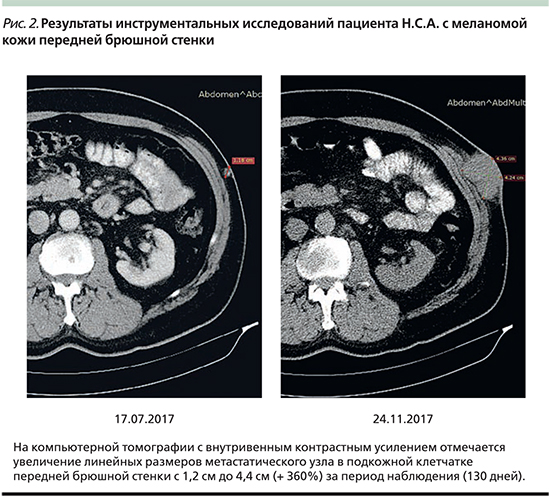
Пятого декабря 2017 г. выполнено иссечение метастатического узла мягких тканей передней брюшной стенки. По данным гистологического исследования: внутрикожный метастаз эпителиоидноклеточной беспигментной меланомы, опухолевый узел выбухает под кожу и образует на ней бляшковидные образования по 0,5 см в диаметре серовато-черного цвета. Какой-либо значимой лимфоидной инфильтрации не обнаружено.
При обследовании 10.01.2018 выявлен метастаз в лимфатическом узле левой подмышечной области размером 3,1×1,6 см, метастазы в печени. Цитологическое заключение № 2018/120 – метастаз беспигментной меланомы.
В опухоли выявлена мутация в гене BRAF V600E.
C января 2018 по апрель 2018 г. – терапия дабрафенибом 150 мг 2 раза в сутки и траметинибом 2 мг 1 раз в сутки. На фоне приема отмечен кратковременный эффект в виде уменьшения размеров конгломерата в подмышечной области, далее отмечено прогрессирование заболевания в виде увеличения метастазов в печени, лимфоузлах, рецидив в послеоперационном рубце на коже живота, увеличение уровня ЛДГ до 7 ВГН. Далее пациент получил полихимиотерапию (паклитаксел 175 мг/м2 день 1+карбоплатин AUC=6) с кратковременным эффектом, планировалось начало терапии ипилимумабом. Однако на фоне ХТ, несмотря на частичный ответ по висцеральным очагам, отмечено появление метастазов в центральной нервной системе. Пациенту проведена стереотаксическая радиотерапия на метастазы в головном мозге, что, однако, не позволило стабилизировать его состояние, и 25.08.2018 пациент умер при явлениях прогрессирования заболевания.
Эти два клинических случая, а также ретроспективная серия наблюдений (будет опубликована отдельно) подтолкнули нас к изучению вопроса гиперпрогрессирования (ГП) на фоне применения современных иммунотерапевтических препаратов.
Феномен ГП опухолей различных локализаций и его описание в литературе
Понятие гиперпрогрессирования –относительно новое в онкологической практике, и не все специалисты разделяют мнение относительного того, что ингибиторы PD1/PDL1 могут вызывать ускорение опухолевого роста. Так, например, в ходе дискуссии на одной из клинических секций SMR-2018 (Манчестер, 24–27.10.2018) автор (И.В. Самойленко) не нашел в аудитории специалистов, которые бы высказались в поддержку явления ГП при меланоме и высказывая лишь мнение о естественном скоротечном течении болезни.
Немногочисленные научные публикации на этот счет подразумевают под ГП ускорение роста опухоли (увеличение размеров таргетных очагов) не менее чем в 2 раза по сравнению с ранее наблюдавшейся скоростью [1–3].
Одним из пионеров изучения этого явления безусловно следует считать S. Champiat из Института Густава Русси (Франция), которая проанализировала данные проводимых исследований, предложила критерии ГП и обнаружила, что из 131 пациента у 12 (9%) имеются признаки ГП [2].
В связи с этим следует рассмотреть еще одно понятие, которое ввиду объективных причин не слишком широко используется в онкологической практике – скорость роста опухоли (СРО) [4]. СРО представляет собой изменение суммы размеров таргетных очагов за единицу времени (1 месяц). При появлении новых очагов их размеры не суммируются с размерами таргетных очагов. Иначе говоря, для определения СРО потребуется минимум два измерения размеров опухоли на протяжении времени, если же требуется определить изменение СРО, потребуется не менее трех измерений размеров опухоли.
Предполагается, что СРО приблизительно одинакова у одного пациента и если лечение эффективно, то она замедляется, а если лечение неэффективно, то она остается прежней. Однако если допустить, что лечебное воздействие будет нести вред, то СРО увеличится (рис. 3) [4]. В настоящее время в литературе нет устоявшейся величины изменения СРО, которая бы отделяла ГП от естественного течения болезни на фоне неэффективного или малоэффективного лечебного воздействия. Большинство авторов склоняются к увеличению СРО на 50% от исходной в течение первого месяца терапии.
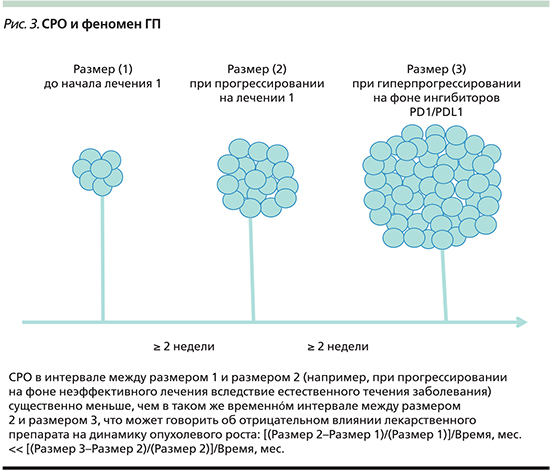
Наиболее крупная работа на этот счет выполнена R. Ferrara et al. из Института Густава Русси (Франция) [3]. Авторы проанализировали характер течения заболевания у 406 больных, получавших терапию по поводу немелкоклеточного рака легкого (НМРЛ) в 4 онкологических центрах Франции во второй и более линиях. Определив ГП как увеличение СРО на 50% и более при первой оценке, R. Ferrara et al. пришли к выводу, что ГП может наблюдаться у 13,6% больных этой когорты. При этом псевдопрогрессие наблюдалось у 19 (4,7%) больных. Интересно, что у 6 из 19 больных, у которых явления прогрессирования сменились частичным или полным ответом (псевдопрогрессирование), исходный паттерн прогрессирования сотвествовал критериям ГП.
Авторы также пришли к выводу, согласно которому ГП серьезно ухудшает прогноз заболевания. Пациенты, у которых в течение первых 6 недель после начала терапии блокаторами PD1/PDL1 наблюдалось ГП, имели значимо худшие показатели общей выживаемости (ОВ) по сравнению с пациентами, у которых было зарегистрировано прогрессирование заболевания, но без признаков ГП: медиана ОВ – 3,4 месяца (95% доверительный интервал [ДИ] – 2,8–7,5 месяца) по сравнению с 6,2 (95% ДИ – 5,3–7,9 месяца); относительный риск [ОР]=2,18 (95% ДИ – 1,29–3,69; р=0,003) [3]. Следует также отметить, что среди 59 пациентов, получалвших только ХТ, у 3 также были отмечены признаки ГП, однако в этом случае различий в выживаемости пациентов с прогрессированием заболевания и ГП выявить не удалось [3].
Важную работу опубликовали G. Lo Russo et al. из Национального института опухолей (Милан, Италия) [5]. Авторы предложили свои критерии ГП, которые позволяют применять их к больным, получающим блокаторы PD1/PDL1 в первой линии, поскольку ранее описанные критерии, связывающие ГП с изменением СРО, не позволяли применять их в отношении больных, у которых нет радиологической оценки на предыдущей линии лечения. G. Lo Russo et al. выделяют 5 признаков ГП: 1) время до отказа от лечения (по любым причинам) – менее 2 месяцев; 2) увеличение суммы наибольших диаметров таргетных очагов на 50% и более от исходного при первой радиологической оценке; 3) появление не менее 2 новых очагов в органе, в котором уже исходно были опухолевые очаги; 4) появление метастазов в новом органе, ранее не вовлеченном в опухолевый процесс; 5) клиническое ухудшение до ECOG (Eastern Cooperative Oncology Group)≥2 в течение 2 месяцев от начала лечения.
В случае если у пациента с прогрессированием заболевания по шкале RECIST 1.1 (Response evaluation criteria in solid tumours) соблюдаются не менее 3 из 5 критериев, авторы расценивали эту ситуацию как ГП, в случае если соблюдается менее 3 критериев, но при этом имеется прогрессирование по шкале RECIST 1.1, клиническая ситуация расценивалась как прогрессирование без ГП.
По данным G. Lo Russo et al., из 187 больных НМРЛ у 32 (21%) был зарегистрирован ответ на лечение, у 42 (27,7%) – стабилизация, у 39 (25,7%) – прогрессирование и у 39 (25,7%!) – ГП. Медиана ОВ составила 8,7 месяца в группе пациентов с прогрессированием и 4,4 месяца в группе пациентов с ГП.
В другой работе, также посвященной вопросам ГП у больных НМРЛ, J.S. Kurman et al. оценивали частоту этого явления до 20% у лиц старшего возраста (65 лет и старше) и только как 5% – у лиц молодого возраста (менее 65 лет) [6]. Авторы из Японии предостерегают от неоправданного отказа от проведения терапии PD1-ингибиторами пожилым больным раком легкого, т.к. по данным их серии наблюдений в большинстве случаев ГП могла быть скорректирована ХТ и глюкокортикостероидами [7].
Сообщения о случаях ГП при применении блокаторов PD1/PDL1 появляются и при других локализациях злокачественных новообразований. Так, например, E. Saada-Bouzid et al. из различных онкологических учреждений Франции сообщают о 10 случаях ГП среди 34 больных плоскоклеточным раком головы и шеи, которые получали пембролизумаб или ниволумаб [8]. Эта работа также содержит интересные методические подходы к определению ГП и кинетики опухолевого роста, однако не проливает свет на молекулярные механизмы этого явления.
Описание отдельных клинических случаев встречается также и для более редких локализаций: так, например, у 77 больных меланомой прямой кишки с минимальными проявлениями болезни в легких был зарегистрирован висцеральный криз после 4 инфузий пембролизумаба, а спустя 6 месяцев после начала терапии пациент умер при явлениях прогрессирования заболевания [9].
Также имеются сообщения о ГП у больных раком желудка, в частности, после проведения паллиативной лучевой терапии. T. Ogata et al. сообщают о том, что лучевая терапия может стать фактором риска возникновения ГП [10].
Напротив, на сегодня очень мало описанных случаев ГП при применении блокаторов PD1/PDL1 больными раком почки и уротелиальным раком [11]. В когорте из 8 больных уротелиальным раком, изученной S. Champiat et al., у 2 (25%) были признаки ГП [2].
Также на сегодняшний день немного случаев ГП описано для метастатической меланомы кожи.
Иммунологические или молекулярные механизмы ГП
Иммунологические или молекулярные механизмы этого явления в настоящее время активно изучаются.
Ряд работ указывает на то, что за ускорение опухолевого роста может быть ответствен белок PD1, который иногда экспрессируется на поверхности опухолевых клеток. PD1 представляет собой поверхностный белок, появление которого на поверхности CD8+-T-лимфоцита индуцируется через 48 часов после презентации антигенов [13]. Также PD1 экспрессируется на поверхности NK-, B-клеток, моноцитов и опухолевых клеток [14, 15]. При взаимодействии белка PD1 на поверхности CD8+-Т-лимфоцита с одним из его лигандов PDL1/PDL2 происходит ингибирование PI3K/AKT/mTOR и RAS/RAF/MEK/ERK сигнальных путей, что приводит к подавлению пролиферации и снижению выживаемости Т-лимфоцитов [14, 16]. Однако влияние взаимодействия PD1 на поверхности опухолевых клеток со своими лигандами до сих пор остается малоизученным. Согласно данным The Cancer Genomic Atlas, экспрессия PD1 на поверхности опухолевых клеток определяется при раке печени, яичек, карциноиде, уротелиальном раке, меланоме кожи [17].
В одной из ранних работ, изучавшей роль экспрессии PD1 на поверхности клеток меланомы в ответ на анти-PD1-препараты, был показан протуморогенный эффект экспрессии PD1 [18]. Обработка опухолевых клеток, экспрессирующих PD1 как анти-PD1- так и анти-PDL1-антителами, оказывала противоопухолевое действие, что было связано со значительным снижением количества фосфорилированного p-S6K [18]. Схожие данные были получены на клеточных линиях гепатоцеллюлярного рака, экспрессирующих PD1 [19]. Таким образом, были описаны противоположные эффекты стимуляции PD1 на CD8+-T-клетках и опухолевых клетках (в частности, гепатоцеллюлярного рака).
Однако в одной из более поздних работ было показано, что экспрессия PD1 на поверхности клеток НМРЛ оказывает онкосупрессорное действие [20]. В этой работе биоптат опухоли легкого был получен от пациента, у которого позднее развилась ГП. Было показано, что клетки НМРЛ экспрессируют PD1. Далее авторы изучили биологическую роль экспрессии PD1 на мышиной клеточной линии рака легкого M109. Нокаут гена или блокада PD1 с помощью антител повышает жизнеспособность опухолевых клеток, в то время как повышенная экспрессия и воздействие рекомбинантного PDL1 снижают жизнеспособность опухоли. В этой работе показано, что блокада PD1 ускоряла рост ксенографта M109 у иммунодефицитных мышей за счет как усиления пролиферации, так и уменьшения явлений апоптоза. Таким образом, авторы, по их мнению, смогли доказать потенциальную возможность участия опухолевого PD1 и его блокады в феномене ГП [20]. Тем не менее, на наш взгляд, требуется больше исследований в этой области, прежде чем мы сможем сделать окончательные выводы.
Потенциальная роль генетических особенностей опухоли в развитии ГП изучалась в ряде работ. В работе, выполненной в медицинском колледже Висконсина, 4 из 5 пациентов с ГП удалось выполнить дополнительный анализ опухолевого материала. Наиболее часто у них выявляли амплификацию MDM2/MDM4 (50%), амплификацию EGFR (25%) и амплификацию еще нескольких генов, расположенных на хромосоме 11q13 -CCND1, FGF3, FGF4, FGF19 (75%). [21]
В другой более крупной работе, опубликованной сотрудниками университета Калифорнии, частота случаев ГП составила 6 из 155 (критериями были время до наступления прогрессирования менее 2 месяцев, увеличение размеров опухоли более 50% от исходного и ускорение темпа прогрессирования более чем в 2 раза) [12]. По данным авторов, у всех 6 пациентов с ГП была выявлена MDM2/MDM4. После начала монотерапии анти-PD1/PDL1 у 4 из этих больных существенно выросли размеры опухоли (от 55 до 258%), выявлены новые крупные метастазы и существенно ускорился опухолевый рост (в 2,3; 7,1; 7,2 и 42,3 раза по сравнению с двумя месяцами до начала иммунотерапии). В многофакторном анализе альтерации MDM2/MDM4 и EGFR коррелировали с TTF<2 месяцев. У 2 из 10 пациентов с альтерациями EGFR также наблюдалась ГП (увеличение размеров опухоли на 53,6 и 125%) [12].
Другие авторы важную роль отводят составу иммунного опухолевого микроокружения. Так, в одной из работ показано, что во всех образцах опухолевой ткани больных, у которых позднее развилась ГП, была выявлена инфильтрация M2-подобными CD163+CD33+PD-L1+-эпителиодными макрофагами. Накопление опухоль-ассоциированных макрофагов (TAM) наблюдалось даже в мышиных моделях, когда опухолевые узелки иммунодефицитной мыши заселяли клетками рака легкого человека и ксенографтами, полученными от пациента. В этих моделях опухолевый рост ускорялся при введении анти-PD1, но не анти-PD1 F(ab)2-фрагментов. Одним из объяснений феномена ГП заболевания, по версии G. Lo Russo et al., является взаимодействие между Fc-фрагментом ниволумаба и FcγRIIb-рецептором на поверхности макрофагов, что способствует приобретению макрофагами более агрессивной протуморогенной активности [5].
В работе из Испании, представленной в 2018 г., важную роль в предсказании ответа на лечение авторы отводят т.н. стареющим CD4+-клеткам (Tsen) [22, 23]. В исследование были включены 34 больных НМРЛ. При уровне Tsen ниже 40% частота объективного ответа на лечение блокаторами PD1/PDL1 больных НМРЛ составляла 0%, у всех больных было отмечено прогрессирование заболевания к 9-й неделе. Напротив, у больных с уровнем Tsen выше 40% частота объективного ответа достигала 38,9%, а выживаемость без прогрессирования к 12-й неделе составляла 44%. Кроме того, повышение уровня Tsen после первого цикла лечения всегда сопровождалось ГП или отсутствием ответа на лечение, в то время как снижение уровня Tsen коррелировало с возникновением ответа на лечение. ROC-анализ продемонстрировал точность взаимосвязи измерений Tsen с клиническим ответом на лечение (R = 0,84; р = 0,006), при пороговом исходном уровне Tsen < 57,7% это показатель имеет 100%-ную специфичность и 75%-ную чувствительность идентификации больных НМРЛ, не отвечающих на лечение блокаторами PD1/PDL1 [22].
На уровне клинического случая описан интересный феномен увеличения доли моноцитов (HLADR+, CD33+, CD14+) и CD16+-моноцитов (HLADR+, CD33+, CD14+, CD16+) у пациента с ГП на фоне меланомы прямой кишки по сравнению со здоровым донором. Более того, моноциты пациента и CD16-позитивные моноциты имели более высокую интенсивность сигнала PDL1 по сравнению со здоровым донором. Также было выявлено, что доля иммуносупрессивной популяции клеток CD33+/HLADR-/CD15+/CD14- была выше у пациента с ГП по сравнению со здоровыми донорами [9].
Заключение
Первого октября 2018 г. было объявлено о награждении Нобелевской премией в области физиологии и медицины докторов J.P. Allison и T. Honjo за открытия в области терапии злокачественных новообразований путем ингибирования негативной иммунной регуляции. Открытия, сделанные учеными в начале 1990-х – начале 2010-х гг., открыли по-настоящему новую страницу в истории терапии злокачественных новообразований, и тысячи жизней были если и не спасены совсем, то продлены благодаря этим открытиям.
Накапливаются новые данные, которые безусловно требуют дополнительной проверки и дополнительных исследований, что, по нашему мнению, позволит применять модуляторы иммунного синапса еще более эффективно и безопасно. Мифы о ГП опухолей на фоне блокаторов PD1/PDL1 пока находят слабое подтверждение в научной литературе, тем не менее это не позволяет вычеркнуть этот феномен из поля нашего внимания.



