Введение
В настоящее время функциональные гастроинтестинальные расстройства (ФГИР) рассматривают как наиболее распространенную патологию желудочно-кишечного тракта (ЖКТ). В определение ФГИР, данное Римскими критериями-IV, добавили раздел «Интестинальное микроокружение и функциональные гастроинтестинальные расстройства», который объединяет наши знания о микробиоте, питании, важные не только для понимания процессов, происходящих в ЖКТ, но и для воздействия на эту компоненту ФГИР [1]. Из всех гастроэнтерологических жалоб, с которыми больные обращаются к специалистам, на долю симптомов функциональной диспепсии (ФД) приходится 20–40%, что дает основание отнести их к классу социально значимых заболеваний [2]. Согласно результатам популяционных исследований, проведенных в Северной Америке, Европе и Австралии, общая распространенность симптомов ФД среди населения колеблется от 7 до 41% и составляет в среднем около 25% [3].
Патогенетические звенья ФД включают нарушения секреции соляной кислоты, расстройства гастродуоденальной моторики и изменение висцеральной чувствительности. У разных больных ФД в качестве ведущих звеньев патогенеза могут выступать различные факторы [4]. Так, у пациентов с болевым вариантом заболевания основным фактором следует считать гиперсекрецию соляной кислоты. При постпрандиальном дистресс-синдроме таким фактором могут служить изменения моторики желудка и двенадцатиперстной кишки. Важную роль в возникновении ФД может играть инфекционный фактор. Ретроспективные исследования показывают, что у многих пациентов с ФД в анамнезе есть предшествовавшие развитию заболевания эпизоды пищевой токсикоинфекции (т.н. постинфекционная ФД) [4]. Согласно результатам обследования 150 больных, перенесших острый инфекционный гастроэнтерит, постинфекционная ФД возникает у 20% пациентов [5]. Полагают, что этот вариант протекает с нарушением аккомодации фундального отдела желудка, обусловленным дисфункцией NO-зависимых нейронов, а также с замедлением эвакуации из желудка [6]. В Римских критериях-IV приведены новые патофизиологические факторы ФД, отсутствовавшие в прежней версии: воспаление слизистой оболочки двенадцатиперстной кишки низкой степени активности, повышение проницаемости и увеличение содержания эозинофилов в слизистой двенадцатиперстной кишке [7]. Вместе с тем для более точной оценки патогенетической роли указанных изменений необходимо проведение дальнейших исследований.
В соответствии с новой дефиницией ФГИР в настоящее время рассматриваются как состояния, в основе которых лежит дисрегуляция оси «головной мозг–ЖКТ». Ось «головной мозг–ЖКТ» представляет собой двунаправленную разветвленную коммуникационную сеть, которая посредством нейроиммунноэндокринных медиаторов осуществляет мониторинг и интеграцию функций ЖКТ, реализует связь эмоциональных и когнитивных центров с ЖКТ (в плане его функциональной активности), координирует местные адаптивные реакции к стрессовым факторам любого рода [8, 9]. В свою очередь висцеротопические афферентные воздействия воспринимаются головным мозгом и оказывают влияние на ощущения боли, настроение и поведение человека. Под контролем этой разнонаправленной оси протекают все основные процессы, происходящие в ЖКТ: моторика, секреция, активность размножения кишечной флоры, всасывание, миграция флоры, микроциркуляция, местная иммунная защита, пролиферация клеток [10, 11].
В последнее время большое внимание в развитии ФГИР уделяют кишечной микробиоте [12]. Еще в 2006 г. R. Goodacre было введено понятие «суперорганизм», под которым понимается сообщество человека и населяющих его микроорганизмов [13], причем доля собственно человеческих клеток в нем составляет всего лишь 10%, а 90% принадлежат бактериям [14]. Биологическое равновесие между человеком и микробной флорой, сложившееся в результате эволюции, служит своеобразным индикатором состояния макроорганизма, которое реагирует на различные патологические процессы в организме и любые изменения в окружающей среде [15].
Микробиота кишечника включает около 400 различающихся между собой типов бактерий, объединенных в три энтеротипа:
- с преобладанием Bacteroides;
- с преобладанием Prevotella;
- с преобладанием Ruminococcus.
Состав бактерий в различных отделах ЖКТ весьма вариабелен. На сегодняшний день установлено, что в микробиотопе кишечника доминируют некультивируемые и ранее не определявшиеся бактерии родов Firmicutes (60–80%) и Bacteroides (15–30%) [16]. Среди бактерий-комменсалов, культивированных из ЖКТ, более 99,9% являются облигатными анаэробами, из которых к доминирующим представителям относятся Bacteroides, Bifidobacterium, Eubacterium, Lactobacillus, Clostridium, Fusobacterium, Peptococcus, Peptostreptococcus, Escherichia и Veillonella [17]. Каждый человек уникален по составу микробиоты. Он широко варьируется в популяции и зависит как от генетических факторов, так и от особенностей питания [18, 19]. Так, например, при преобладании в рационе мясных продуктов в микробиоте выявляется значительное количество Faecalibacterium prausnitzii, а у людей, употребляющих много растительной пищи, – Bacteroides [20]. Низкокалорийная диета приводит к значительному снижению численности Firmicutes и к росту численности Bacteroides [21]. В ряде работ показано, что изменение микробиоты под влиянием диеты вызывало нарушение моторики двенадцатиперстной и тощей кишки [22].
Популяционный состав и численность микроорганизмов варьируются на протяжении пищеварительного тракта, поскольку разные его отделы различаются по условиям рН, скорости прохождения химуса, доступности нутриентов, окислительно-восстановительному потенциалу. В рамках ЖКТ биотоп делится на ярусы – отделы и микробиотопы: полостной, пристеночный, эпителиальный. Относительно стабильный количественный и видовой состав полостных микроорганизмов на определенном ярусе поддерживается механизмами аутостабилизации. Наиболее богата микрофлорой толстая кишка: до 60% от сухой массы фекалий составляют микроорганизмы. На сегодняшний день известно, что микрофлора слизистой оболочки кишечника существенно отличается от микрофлоры просвета кишечника и каловых масс [23]. Пристеночный микробиотоп представлен слизистыми наложениями (слизистый гель, муциновый гель), гликокаликсом, расположенным над апикальной мембраной энтероцитов и поверхностью самой апикальной мембраны. Способность к аппликации в пристеночном микробиотопе определяет суть транзиторности или индигенности бактерий. Эубиотические бактерии участвуют в создании колонизационной резистентности организма, что является уникальным механизмом системы противоинфекционных барьеров. Пристеночная микрофлора на 99% представлена неспорообразующими анаэробными и факультативно анаэробными бактериями (бифидо- и лактобактерии, бактероиды, молочнокислые стрептококки и др.). Просветная или транзиторная микрофлора входит в состав фекальной микрофлоры. Ее основные представители – это аэробные и факультативно аэробные микроорганизмы, в основном представители семейства Enterobacteriaceae.
О микробиоте тонкой кишечки известно мало, что объясняется малодоступностью этого отдела ЖКТ для исследований [24, 25]. Культуральные исследования показывают, что в тонкой кишке значительно меньше бактерий по сравнению с толстой кишкой, а их концентрация значительно нарастает в направлении от двенадцатиперстной кишки к дистальному отделу подвздошной кишки. В основном это грамположительные аэробы в проксимальном отделе и грамотрицательные/грамположительные анаэробы и факультативные анаэробы в терминальных отделах подвздошной кишки.
Многочисленные данные свидетельствуют о вовлеченности нарушений кишечной микрофлоры в патогенез ряда заболеваний [26–28]. Установлено влияние микробиоты на формирование нормальной моторной функции кишечника и возможная роль нарушений микробиоты в развитии сенсорномоторной дисфункции кишечника и функциональных патологических состояний, таких как синдром раздраженного кишечника [29–31].
Многие исследователи считают, что кишечные бактерии могут влиять на патогенез функциональных гастроинтестинальных расстройств за счет как метаболических возможностей внутрипросветной микробиоты, так и взаимодействия микробиоты слизистой оболочки с иммунитетом организма-хозяина. Вместе с тем в настоящее время мало работ о связи изменений в микробиоте кишечника с ФД. Нарушение моторики ЖКТ при постпрандиальном дистресс-синдроме является одним из основных этиологических факторов. По нашему мнению, изменение микробиоты при ФД может происходить и под влиянием диеты, которой придерживаются пациенты. Важен не только общий характер модели диеты, но и относительные количества конкретных компонентов (углеводы, белки, жиры, клетчатка) и кратковременные изменения в рационе, в том случае если они будут достаточно существенными, которые также могут влиять на изменения кишечной микробиоты [32]. Это в свою очередь вызывает нарушение моторики двенадцатиперстной и тощей кишки и вновь оказывает влияние на микробиоту кишечника. При этом вследствие нарушений двигательной функции тонкой кишки пищевой химус задерживается в ее верхних отделах, что способствует миграции бактерий из нижних отделов кишки в расположенные выше, а также повышению их ферментативной активности. Таким образом, изменения во взаимодействии между кишечной микробиотой и факторами организма хозяина (возраст, диета, генетические особенности) могут иметь важное значение для патофизиологии ФД. Эти факторы в свою очередь могут быть связаны с изменениями патофизиологических путей, связанными с гомеостазом, включая барьерную, нейромоторную и сенсорную функции, а также ось «головной мозг–ЖКТ». Например, двусторонняя передача сигналов между микробиотой и эпителием кишечника регулирует выделение слизи, а также других факторов защиты, участвующих в регуляции микробиоты. Однако клиническое значение этих данных окончательно не установлено, в связи с чем продолжаются исследования, ставящие своей целью расширение имеющихся знаний в этой области.
Целью настоящего исследования стало выявление особенностей кишечной микробиоты у пациентов с функциональной диспепсией.
Методы
Обследованы 70 пациентов с диагнозом ФД, из них 37 женщин и 33 мужчины. Возраст больных варьировался от 21 до 56 лет, средний возраст составил 44 года. Диагноз «функциональная диспепсия» полностью соответствовал Римским критериям-IV и верифицирован результатами лабораторно-инструментального обследования, на основании которых была исключена органическая патология. Проведено исследование образцов анализа кала и крови всех пациентов. Исследование метаболитов микроорганизмов в крови и кале проведено методом газовой хроматографии (ГХ) и масс-спектрометрии (МС) на хромато-масс-спектрометре АТ 5973 D фирмы Agilent Technologies, США (Осипов Г.А., 2010).
На сегодняшний день метод газовой хроматографии масс-спектрометрии микробных маркеров (ГХ-МС) наиболее практичен и универсален, т.к. применяется для исследования микробиоценозов любых органов и локализаций [33]. В отличие от широко применяемых методов диагностики ГХ-МС указывает на целый спектр микроорганизмов, которые традиционно не учитываются, в результате чего пациент остается недообследованным. Метод основан на выявлении присутствия микроорганизмов по специфическим для них химическим веществам – маркерам из числа жирных кислот (ЖК), альдегидов и стеринов, входящих в состав их клеточной стенки. Суть анализа состоит в извлечении высших ЖК из образца, подлежащего исследованию (клинический материал: кровь, моча, фекалии и пр.), в разделении их на хроматографе в капиллярной колонке высокого разрешения и анализе состава в динамическом режиме на МС [34]. Для диагностики дисбиотических сдвигов тонкой кишки методом ГХ-МС исследуют кровь, а транзиторной (внутрипросветной) микрофлоры толстой кишки методом ГХ-МС – кал.
В результате исследования определены концентрации метаболитов широкого спектра микроорганизмов в плазме крови и кале. Диагностически значимыми показатели считались, если численность микроорганизмов была изменена вдвое по сравнению с нормой. Статистическая обработка полученных результатов выполнена по программам, включенным в пакет MS «Excel», с использованием библиотеки статистических функций. Для установления связи между показателями использовался корреляционный анализ (коэффициент корреляции Спирмена). Статистически значимыми считались различия, при которых уровень статистической значимости (p) был ниже 0,05, что является стандартным уровнем статистической значимости для биомедицинских исследований.
Результаты исследования
У пациентов с ФД выявлены дисбиотические изменения в составе как полостной, так и пристеночной микробиоты кишечника. В частности, среди представителей пристеночной микробиоты тонкой кишки обнаружен избыточный рост анаэробных бактерий родов Ruminococcus spp. – 54%, Eubacterium spp. – 81%, Clostridium spp. (Cl. propionicum) – 64% и Klebsiella spp. – 81% (рис. 1). Наличие Helicobacter pylori обнаружено в 11% случаев.
В полостной микробиоте выявлено больше по сравнению с референтными значениями анаэробных бактерий родов Eubacterium – 69%, Clostridium (Cl. difficile) – 80%, Bacteroides (B. fragilis) – 66%, Butyribrio – 54% (рис. 2), а также аэробных бактерий рода Rhodococcus – 66%.

Кроме того, в образцах исследуемого материала были обнаружены вирусы простого герпеса (у 78% в кале и у 97% в крови), вирус Эпштейн–Барр (у 15% в кале, у 48% в крови), цитомегаловирус у 36% в кале и у 43% в крови.
В образцах крови и кала выявлен избыточный рост грибов родов Candida spp., Aspergilles spp. и Mycromyces spp. (рис. 3).
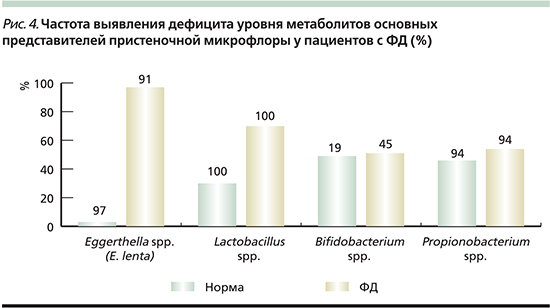
В пристеночной микробиоте обнаружено сниженное по сравнению с референтным уровнем количество бактерий родов Eggerthella spp. (E. Lenta – 97%, Propionobacterium spp. (P. jensenii, P. freudenreihii) –54%, Lactobacillus spp. – 70%, Bifidobacterium spp. – 51% (рис. 4). Характер дефицита состава полостной микробиоты выявил сниженное количество бактерий родов Fusobacterium spp. – у 66%, Bifidobacterium spp. – у 63%, Enterococcus spp. – у 78%.
Поскольку метод МС микробных маркеров дает представление о качественном и количественном составе просветной и пристеночной микробиоты, проведено сравнение уровня микробных маркеров основных представителей микрофлоры кишечника в образцах кала и крови. Для установления связей между показателями проведен корреляционный анализ. Корреляционных связей между результатами количественного определения лактобактерий в кале и крови пациентов не найдено, но обнаружена статистически значимая корреляционная связь средней силы (ρ=0,460) между результатами определения бифидобактерий.
Обсуждение
В ходе исследования показано, что среди представителей пристеночной микробиоты тонкой кишки пациентов с ФД доминируют анаэробные бактерии родов Ruminococcus spp., Eubacterium spp., Clostridium spp. (Cl. propionicum) и Klebsiella spp. В полостной микробиоте выявлено большее по сравнению с референтными значениями представительство анаэробных бактерий родов Eubacterium spp., Clostridium spp. (Cl. difficile), Bacteroides spp. (B. fragilis) и Butyribrio spp. Кроме того, в полостной микрофлоре выявлены аэробные бактерии рода Rhodococcus spp., которые относят к грамположительным неподвижным актиномицетам. Клиническое значение этих бактерий в качестве возбудителей инфекционных заболеваний недостаточно определено. Однако описано, что особенностью заболевших было фоновое наличие иммунодефицитных состояний [35].
Обращает на себя внимание, что более чем у 80% пациентов с ФД выявляется повышение в 2 и более раз уровня Eubacterium spp. и Klebsiella spp. Известно, что Eubacterium spp. – родственные клостридиям микроорганизмы, являющиеся одним из основных обитателей кишечника. Это условные патогены, участвующие в качестве основных агентов во многих воспалительных процессах. У лиц, перенесших инфекционные заболевания, выявляется повышение уровня метаболитов эубактерий как в полостной, так и в пристеночной микробиоте, что предположительно может являться маркером «постинфекционной» ФД.
В нашем исследовании показано, что более чем у половины пациентов с ФД превышен рост таких представителей пристеночной микрофлоры, как Clostridium spp. (Cl. propionicum), и родов Ruminococcus spp. Эта группа микробов, вероятно, служит источником эндотоксинов, поддерживающих заболевание при дефиците противодействия со стороны основных представителей нормальной микробиоты.
Характер дефицита состава полостной микробиоты обнаружил сниженное количество бактерий родов Bifidobacterium spp. и Enterococcus spp. Обращает на себя внимание тот факт, что уровень метаболитов бифидобактерий в толстой кишке был снижен у 63%, в тонкой кишке – у 51% пациентов, что позволяет сделать заключение о снижении роста и метаболической активности бифидобактерий у пациентов с ФД. При этом известно, что энтерококки участвуют в переработке углеводов, в производстве витаминов, а также играют роль в создании местного иммунитета (в кишечнике). Снижение роста бактерий родов Bifidobacterium spp. и Lactobacterium spp. будет способствовать снижению колонизационной резистентности кишечного микробиоценоза, повышению риска его заселения патогенной микрофлорой и формированию длительных хронических расстройств пищеварения.
В пристеночной микробиоте выявлено снижение Propionibacterium freudenreichii, считающиеся перспективным пробиотиком вследствие их способности ингибировать рост нежелательной микрофлоры. Снижение уровня этих анаэротолерантных бактерий влияет на снижение роста бифидобактерий и ферментативную активность кишечника. Возможность изменения ферментации в толстой кишке при изменении микробиоты была убедительно доказана в исследованиях, дизайн которых предполагал применение пребиотиков, селективно увеличивающих число бифидобактерий [36], или введение самих бифидобактерий. Изменения ферментации оказывают влияние на моторику не только толстой кишки, но и других отделов, таких как нижний сфинктер пищевода и желудок [37].
Неожиданным результатом, несомненно, является обнаружение избыточного роста в крови и кале грибов родов Candida spp., Aspergilles spp. и Mycromyces spp. и вирусов простого герпеса, Эпштейна–Барр и цитомегаловируса, что может указывать на снижение иммунных механизмов на фоне дефицита нормобиоты.
Заключение
Нарушение микробиоты кишечника при ФД носит преимущественно дефицитный характер. Снижение уровня бактерий родов Bifidobacterim spp., Lactobacterium spp. способствует сниже-нию колонизационной резистентности кишечного микробиоценоза и повышению риска его заселения патогенной микробиотой, формированию длительных хронических расстройств пищеварения. У пациентов с ФД отмечается избыточный рост анаэробов, представителей родов Eubacterium spp., Clostridium spp. и Klebsiella spp., аэробов рода Rhodococcus spp. и создаются условия для размножения грибов. Определение причинно-следственной связи ФД с изменениями кишечной микробиоты представляется перспективным направлением и служит предметом для дальнейших расширенных исследований.



