Введение
Первичный гиперальдостеронизм (ПГА) служит одной из наиболее частых причин артериальной гипертензии (АГ). По данным разных авторов, ПГА встречается среди 7–15% пациентов с повышенным артериальным давлением – АД [1]. В 30–50% случаев причиной ПГА является альдостерон-продуцирующая аденома (АПА) надпочечника, в 40–65% случаев – идиопатический гиперальдостеронизм (ИГА), связанный с дву- или односторонней диффузной, диффузно-узелковой гиперплазией надпочечников [1]. В настоящее время для постановки диагноза используют клинические признаки, лабораторные и визуализирующие методы диагностики. В арсенале врача имеются скрининговые тесты (определение концентрации альдостерона [АЛД] и ренина в крови, уровень альдостерон-ренинового соотношения [АРС]) и подтверждающие тесты (с физиологическим раствором, флудрокортизоном, c каптоприлом), которые выполняются на первом этапе обследования [2]. Дифференциальная диагностика АПА и ИГА основана на результатах сравнительного селективного забора крови из надпочечниковых вен [3]. Методом выбора лечения ПГА с односторонней гиперпродукцией АЛД надпочечником является адреналэктомия методами эндовидеохирургии. Своевременная диагностика и лечение больных ПГА служат ключевым моментом в предотвращении возникновения сердечно-сосудистых осложнений. Однако неблагоприятный метаболический риск при ПГА может быть связан не только с АГ, но и с инсулинорезистентностью, развитием сахарного диабета 2 типа и остеопорозом [4]. Эти коморбидные состояния скорее всего связаны с дополнительной гиперпродукцией глюкокортикостероидов (ГКС). В настоящее время первичная диагностика ПГА не включает оценки глюкокортикоидной функции коры надпочечников [4].
АЛД и кортизол (F) обладают одинаковой аффинностью к минералокортикоидным рецепторам (МР), однако соединению F с МР препятствует изоферемент 11β-гидроксистероиддегидрогеназа 2-го типа (11β-ГСДГ 2-го типа), что предотвращает гиперактивацию МР. Следовательно, дефицит изофермента 11β-ГСДГ 2-го типа приводит к гиперактивации МР и клиническим проявлениям, характеризующимся избытком минералокортикоидов. Наличие низкого уровня ренина у 40% больных эссенциальной АГ может указывать на участие изофермента 11β-ГСДГ 2-го типа в развитии АГ [5]. В некоторых исследованиях показано, что у больных АГ наблюдали достоверно пролонгированный уровень полувыведения F, повышенную экскрецию с мочой (ЭМ) свободного кортизола (UFF), что косвенно может указывать на участие изофермента 11β-ГСДГ 2-го типа в патогенезе АГ [6].
Цель исследования: оценить функциональное состояние ренин-альдостероновой и гипофизарно-адреналовой систем после хирургического лечения больных по поводу альдостеромы для оптимизации тактики послеоперационного ведения.
Методы
Обследованы 135 пациентов (34 мужчины и 101 женщина) в возрасте 51,3±14,1 года с объемным образованием надпочечника и 27 здоровых лиц (группа контроля) в возрасте 45,5±5,7 года. У всех пациентов собирали анамнез, проводили объективный осмотр, лабораторное и инструментальное обследования. Методами иммунохемилюминесцентного (ИХЛА) и иммуноферментного (ИФА) анализов у всех обследованных определяли уровни адренокортикотропного гормона (АКТГ), АЛД, ренина в плазме крови, АРС, уровни F в 9 (Ку) и 21 час (Кв) в сыворотке крови, метанефринов и норметанефринов в плазме крови и в моче, проводили подавляющий тест с 1 мг дексаметазона (ПДТ) и пробу с физиологическим раствором (ПФР) при подозрении на гиперальдостеронизм. Методом высокоэффективной жидкостной хроматографии (ВЭЖХ) определяли уровни F, кортизона (Е), кортикостерона (В), 11-дезоксикортизола (S), 11-дезоксикортикостерона (DOC), 11-дегидрокортикостерона (А) и 18-ОН-кортикостерона (18-ОНВ) в сыворотке крови, ЭМ свободного кортизола (UFF), свободного кортизона (UFЕ), 18-ОН-кортикостерона (U18-ОНВ) и 6β-гидроксикортизола (U6β-ОНF), рассчитывали соотношения F/E, В/А, UFF/UFE и U6β-ОНF/UFF.
По результатам обследования, у 64 пациентов был диагностирован ПГА. Для дифференциальной диагностики всем больным ПГА был выполнен сравнительный селективный забор крови из надпочечниковых вен (ССЗКНВ). По результатам обследования у 20 женщин и 2 мужчин в возрасте 50,7±10,8 года диагностирована АПА, средний размер которой составил 21,7±8,3 мм, нативная плотность – 23±19,9 HU (единиц Хаунсфилда), абсолютный процент вымывания контраста (APW) – 80,3±27,4%. Всем пациентам с АПА проведена односторонняя адреналэктомия. С 1-го по 7-й день после операции в раннем послеоперационном периоде (РПП) проводили анализ клинической картины, объективных, лабораторных и инструментальных данных. Всем больным АПА в 1-й день после операции определяли уровень гормонов методом иммуноанализа, на 4-й день после операции – методами ВЭЖХ и иммуноанализа.
Длительность АГ у пациентов с АПА составила 11,3±9,5 года, максимальное АД у больных АПА – 200 (180–220) на 110 (100–120) мм рт.ст. Все пациенты получали комбинированную антигипертензивную терапию (блокаторы рецепторов ангиотензина II; блокаторы кальциевых каналов, производные дигидропиридина или селективные β-адреноблокаторы; агонисты имидазолиновых рецепторов). На фоне массивной антигипертензивной терапии АД составило 142 (130–160) на 90 (80–90) мм рт.ст. Кроме этого для нормализации уровня калия в крови перед операцией все пациенты получали спиронолактон в средней дозе 150±50 мг/сут и препараты калия в средней дозе 1,0±0,5 г/сут. Данные обследования больных АПА после операции были сопоставлены с результатами дооперационного обследования и с соответствующими показателями группы контроля (ГК).
Статистическая обработка полученных результатов осуществлена с применением пакета программ для статистического анализа Statistiсa for Windows (версия 10) и GraphPadPrism 6. При сравнении показателей в динамике использовали непараметрические методы: U-критерий Манна–Уитни и тест Вилкоксона. Проводили корреляционный анализ с применением коэффициента ранговой корреляции Спирмена. Количественные показатели в работе представлены в виде Me (LQ–UQ), где Me – медиана, LQ – нижний квартиль, UQ – верхний квартиль. Критерием статистической значимости различий мы считали общепринятую величину доверительной вероятности (p) менее 0,05. Исследование проведено в соответствии с Международными стандартами надлежащей клинической практики GCP (Good Clinical Practice).
Результаты
АПА диагностирована у больных аденомой коры надпочечников на основании клинической картины и лабораторных данных. У пациентов с АПА выявлено увеличение уровня АЛД, снижение уровня ренина (меньше 3,0 пг/мл) в сыворотке крови, повышение АРС (больше 120), уменьшение уровня калия в сыворотке крови (табл. 1). Уровень АЛД после проведения ПФР составил 261 (144–396) пг/мл, больше 140 пг/мл. Коэффициент латерализации при ССЗКНВ составил 3,2 (2,8–5,0). У больных АПА в дооперационном периоде (ДОП) уровень АКТГ был снижен, уровни Ку, Кв и после ПДТ с 1 мг: 35 (25–49), 38 (30–47) нмоль/л (р>0,05) не отличались от ГК (табл. 1).
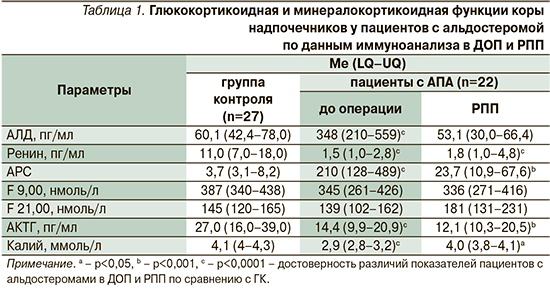
По данным ВЭЖХ, у больных АПА в ДОП были повышены уровни F, B и 18-ОНВ в сыворотке крови, ЭМ U18-OHB и UFF по сравнению с ГК (табл. 2). Полученные данные свидетельствуют о повышении минералокортикоидной и глюкокортикоидной функций коры надпочечников у пациентов с АПА. Кроме этого были увеличены соотношения F/E и B/A в сыворотке крови, что указывает на снижение активности 11β-ГСДГ 2-го типа. Уменьшение ЭМ U6β-OHF и соотношения U6β-OHF/UFF свидетельствует о снижении активности фермента цитохрома P450 3A4 (табл. 2). Полученные нарушения метаболизма F и B могут играть дополнительную роль в развитии АГ у больных АПА.
В РПП у пациентов с АПА сохранялся пониженный уровень АКТГ по сравнению с ГК. Уровень кортизола в сыворотке крови, по данным ИХЛА и по данным ВЭЖХ, экскреция с мочой UFF и UFE не отличались от ГК (табл. 1, 2). Эти данные подтверждают нормализацию глюкокортикоидной функции коры надпочечников и отсутствие глюкокортикоидной недостаточности у пациентов с АПА в РПП.
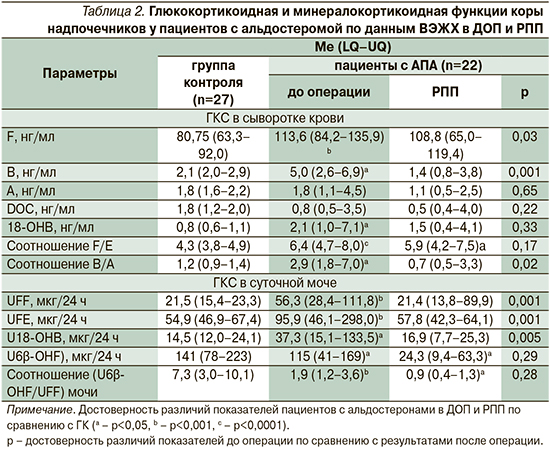
В РПП у пациентов с АПА сохранялся сниженный уровень ренина в сыворотке крови по сравнению с соответствующим показателем ГК (табл. 1).
Уровень АЛД в сыворотке крови был снижен по сравнению с результатом до операции и не отличался от показателя ГК, что свидетельствует о радикальности оперативного лечения (табл. 1). АРС в РПП снизилось по сравнению с уровнем до операции, однако по сравнению с показателем ГК оставалось высоким (табл. 1). По данным ВЭЖХ, в РПП у пациентов с АПА уровень B и соотношение B/A в сыворотке крови, ЭМ U18-OHB были снижены по сравнению с соответствовавшими результатами ДОП и не отличались от показателей ГК (табл. 2). Однако уровни DOC и 18-ОНВ в сыворотке крови в РПП не отличались от показателей в ДОП и ГК (табл. 2). Полученные данные указывают на частичную нормализацию минералокортикоидной функции коры надпочечников у больных АПА в РПП. ЭМ U6β-ОНF и соотношение U6β-ОНF/UFF у больных АПА в РПП сохранялись пониженными по сравнению с показателями ГК, что демонстрирует снижение активности фермента цитохрома P450 3A4 в РПП (табл. 2). Соотношение F/E в сыворотке крови не отличалось от соответствовавшего показателя в ДОП и оставалось повышенным по сравнению с соотношением F/E ГК, что подтверждает низкую активность фермента 11β-ГСДГ 2-го типа в РПП (табл. 2).
Установленные положительные корреляционные связи АРС (R=0,86), ЭМ U18-ОНВ (R=0,95) и U6β-ОНF (R=0,72) в ДОП с систолическим (САД) и диастолическим (ДАД) АД после операции демонстрируют их связь с АГ. Выявлена положительная корреляция уровня 18-ОНВ в сыворотке крови в РПП с уровнем АЛД (R=0,54) и соотношением В/А (R=0,70) в ДОП.
Через месяц после операции САД и ДАД 14 человек не отличались от соответствовавших показателей ГК, САД и ДАД 8 человек были повышены по сравнению с САД (р=0,004) и ДАД (р=0,0008) ГК.
Обсуждение
Своевременная диагностика и лечение больных ПГА служат ключевым моментом в предотвращении возникновения сердечно-сосудистых осложнений и развития метаболических нарушений в результате избытка минералокортикоидов и ГКС [4]. В нашем исследовании в ДОП увеличение концентрации F в сыворотке крови и его экскреции с мочой, по данным ВЭЖХ, подтверждает увеличение глюкокортикоидной активности коры надпочечников у пациентов с АПА. Уменьшение экскреции с мочой U6β-ОНF и снижение соотношения U6β-ОНF/UFF в ДОП и РПП свидетельствуют о снижении активности фермента цитохрома P450 3A4. Снижение активности цитохрома P450 3A4 приводит к замедлению метаболизма F. В результате проведенного исследования выявлены биомаркеры сохранения АГ у больных АПА после операции. Ими являются повышенное после операции АРС по сравнению с ГК и снижение активности фермента цитохрома P450 3A4.
Согласно некоторым исследованиям, 11β-ГСДГ 2-го типа участвует в патогенезе развития АГ [5]. В работе получены данные, свидетельствующие об увеличении соотношений F/E и B/A в сыворотке крови как в ДОП, так и в РПП, что указывает на снижение активности 11β-ГСДГ 2-го типа. Выявлена положительная корреляционная связь уровня 18-гидроксикортикостерона в РПП с АЛД и соотношением B/A в сыворотке крови в ДОП. Представленные результаты подтверждают данные других исследователей об участии изофермента 11β-ГСДГ 2-го типа в поддержании АГ после операции у пациентов с АПА [6].
Выводы
Снижение уровней АЛД, В, соотношения В/А в сыворотке крови и экскреции с мочой 18-ОНВ в РПП по сравнению с ДОП и отсутствие различий данных показателей с ГК указывают на радикальность оперативного лечения у пациентов с АПА.
Снижение активности фермента цитохрома P450 3A4 у пациентов с АПА в ДОП и РПП, повышение после операции АРС по сравнению с ГК служат биомаркером сохранения АГ у пациентов в послеоперационном периоде, что подтверждается наличием положительных корреляций с САД и ДАД после операции.
У больных АПА и стойкой АГ выявлены признаки снижения активности 11β-ГСДГ 2-го типа в ДОП и РПП, положительная корреляционная связь 18-ОНВ с АЛД соотношением В/А в сыворотке крови и АД через 1 месяц после операции.



