Введение
Хроническая бронхолегочная патология в детском возрасте на сегодняшний день считается одной из наиболее сложных разделов современной медицины. Хронические заболевания легких (ХЗЛ) гетерогенны по своим этиологическим факторам и патогенетическим механизмам. Однако, все они объединены необратимой трансформацией мукоцилиарной системы и морфофункциональными изменениями бронхиального дерева [1–3].
В настоящее время для создание персонифицированных терапевтических программ проводится активное изучение и поиск новых факторов, определяющих варианты течения ХЗЛ у детей. Особое внимание исследователей приковано к иммунологической интерференции, оказываемой витамином D на иммунокомпетентные клетки и ансамбль цитокинов в системе воспаления [1–4]. Согласно современным представлениям, изучение оси «витамин D и его рецептор (рецептор витамина D – VDR)» основополагающий для понимания принципов реализации геномных и негеномных влияний витамина D на клетки [1, 2, 5, 6]. Возможной причиной уровня целевого воздействия кальцийтриола на реализацию воспалительного процесса могут быть точечные генетические полиморфизмы, которые в конечном итоге способны влиять на фенотип заболевания [5–7]. В связи с этим происходит перенос внимания на генетические основы регуляции рецептора витамина D, а также витамин D-связывающего белка. При этом в оценке вариабельности патологии и реакции на фармакотерапию витамином D особое внимание уделено полиморфизмам гена VDR – BSMI (283 G>A) [1, 6, 7].
Цель исследования: изучить влияние полиморфных вариантов генов рецептора витамина D на течение хронических бронхолегочных заболеваний у детей.
Методы
Согласно цели исследования, проведено комплексное обследование 98 детей с хроническими заболеваниями легких. Возраст больных составил от 3 месяцев до 17 лет 11 месяцев 29 дней. Пациенты получали лечение в пульмонологическом отделении ГБУЗ АО «ОДКБ им. Н.Н. Силищевой» (Астрахань) с 2016 по 2019 г. Для решения поставленной задачи, все больные были разделены на 2 группы.
Первую группу составили дети с диагнозами «хронический бронхит» (n=30, 8,0±0,67 года) и «облитерирующий бронхиолит» (n=12, 6,83±0,84 года). Во вторую группу вошли пациенты с диагностированным муковисцидозом (n=34, 9,0±1,09 года), первичными иммунодефицитами (n=12, 10,67±1,05 года) и пороками развития легких (n=10, 6,60±1,27), т.е. больные с врожденными нарушениями мукоцилиарной системы.
Дизайн исследования был представлен несколькими этапами. На первом этапе проводился сбор клинико-анамнестических данных пациентов. Биохимический спектр обследования включал определение общего гидроксикальциферола в сыворотке крови методом иммуноферментного анализа. Молекулярно-генетический этап был представлен генотипированием полиморфизмов BSMI (283 G>A) гена VDR.
Для анализа влияния генотипов и аллелей на фенотипические проявления заболеваний использован непараметрический метод статистики – критерий χ2 Пирсона. Для оценки ассоциации генотипов и аллелей изучаемых генов с патологическим фенотипом вычисляли показатель отношения шансов (OR). Если OR превышало 1, то данный фактор рассматривался как предрасполагающий. Если же значение OR оказывалось меньше 1, то соответствующий фактор риска оказывал, напротив, протективное действие на наступление исхода.
Статистическая обработка полученных данных проводилась с помощью офисных приложений пакета Microsoft (электронных таблиц Excel и программы STATISTICA 10) с использованием параметрических и непараметрических методов в зависимости от распределения признака. Критический уровень значимости принимался меньше или равным 0,05.
Результаты
При анализе влияния генетического полиморфизма гена VDR на формирование ХЗЛ была выявлена ассоциация генотипа А/А с хроническими заболеваниями нижних дыхательных путей в обоих группах (табл. 1).
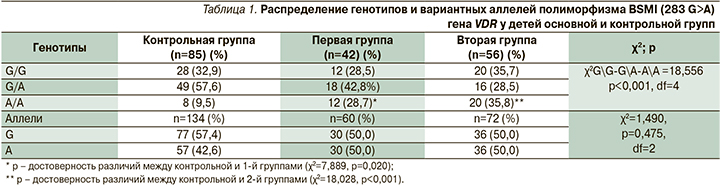
При поиске связей генотипов с гендерным показателем отмечена ассоциация генотипа А/А у лиц мужского пола второй группы, тогда как генотип G/G – у лиц женского пола (χ2=11,400, p=0,004; OR=3,667 и OR=8,000 соответственно). При анализе тяжести обострений в фокусе полиморфизма VDR установлено, что гомозиготный генотип А/А может рассматриваться в качестве протективного в реализации тяжелого обострения бронхолегочного процесса (OR=6,500 [ДИ: 1,386–30,488]; OR=2,333 [ДИ: 1,709–7,675]), в то же время генотип G/G ассоциирован с вероятностью среднетяжелых обострений (OR=0,250 [ДИ: 0,046–1,365]; OR=0,143 [ДИ: 0,029–0,712]). Определена ассоциация между характером микробиоты дыхательных путей у детей второй группы с генетической вариабельностью полиморфизма BSMI) (283 G>A) гена VDR (χ2=10,376, p=0,035). Гомозиготный генотип A/А является предрасполагающим к грам- и смешанному характеру микробиоты респираторного тракта у детей с хронической бронхолегочной патологией (χ2=9,908, p=0,008 и χ2=6,054, p=0,049 для 1-й и 2-й групп соответственно) [1].
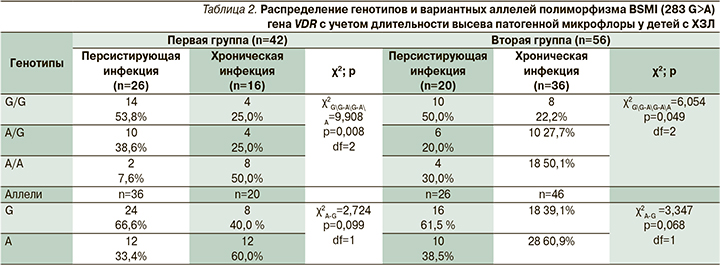
В ходе статистического анализа выявлена ассоциация минорного гомозиготного генотипа А/А полиморфизма BSMI (283 G>A) гена VDR с хроническим характером высева высокопатогенной флоры (χ2=6,054, p=0,049) (табл. 2).
Анализ характера морфологических изменений согласно данным компьютерной томографии органов грудной клетки свидетельствует, что статистические различия определялись только по частоте встречаемости бронхоэктазий у детей с наследственными заболеваниями, а именно генотип G/G ассоциирован с низкой, в то время как генотип А/А – с высокой частотой данных изменений (χ2=12,398, p=0,003).
Несмотря на поиск ассоциаций коморбидных состояний с вариантами полиморфизмами BSMI (283 G>A) гена VDR, статистически значимые различия получены исключительно у детей c хроническим бронхиолитом и хроническим бронхитом: генотип А/А возможно рассматривать в качестве протективного в реализации патологии печени и поджелудочной железы (χ2=11,0530; p=0,004).
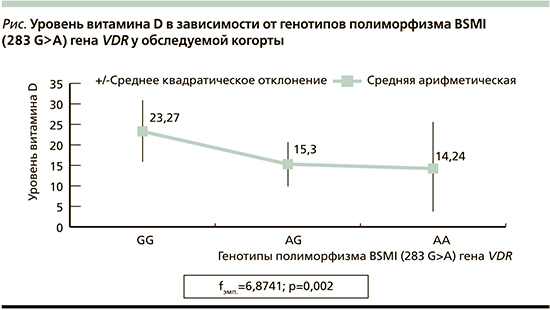
Диапазон ширины статистического распределения уровня сывороточного кальцидиола соответствовал нормальному. В связи с этим использовались количественные переменные: среднего значения±стандартная ошибка среднего значения. Установлено влияние генотипов полиморфизма BSMI (283 G>A) гена VDR на уровень сывороточного кальцидиола. В обеих основных группа детей с наличием мутантного аллеля А как в гетеро-, так и в гомозитном состоянии определялись показатели, соответствовавшие дефицитным значениям сывороточного кальцидиола, тогда как у пациентов с мажорным генотипом G/G показатели сывороточного кальцидиола соответствовали уровню недостаточности (fэмп=6,8741; p=0,002) (см. рисунок).
Обсуждение
Согласно проведенному статистическому анализу, установлено, что однонуклеотидный полиморфизм BSMI (283 G>A) гена VDR может рассматриваться в качестве кандитного, оказывающего влияние на некоторые фенотипические проявления ХЗЛ у детей. Мы полагаем, что моделирующее влияние изученных полиморфных замен ассоциировано с влиянием на связывающую способность рецептора витамина D с последующим изменением к экспрессии генов camp и defB2, запускающих транскрипцию природных пептидов (кателицидина и β-дефенсинов), обладающих выраженной антимикробной активностью и противовоспалительным действием. Бета-дефенсины входят в состав всех лейкоцитов, они способны вызывать гибель микробной клетки за счет встраивание в мембрану с ее последующей перфорацией [2, 3]. На сегодняшний день известно, что рецепторы к VD имеются на многих иммунокомпетентных клетках, за счет воздействия на которые и реализуется его иммуномодулирующий эффект. Он ослабляет презентацию антигена дендритными клетками, тормозит Th1-клеточную дифференцировку и производство Th1-цитокинов, сдвигает баланс Th1/Th2-клеточных ответов в направлении Th2-ответа, оказывает ингибирующее влияние на клетки Th17, способствует развитию Treg-клеток и повышению их активности. Видимо, полиморфизм А/А изменяет чувствительность рецептора с последующей трансформацией сцепления с витамином D и изменением геномных и негеномных воздействий на иммунную систему [5–7].
Мы полагаем, что связь полиморфизма BSMI (283 G>A) гена VDR с характером ряда фенотипических изменений, таких как частота встречаемости сопутствующей патологии гепатобилиарной системы, связана с тем, что VDR выполняет роль ядерного рецептора, влияющего на метаболизм и транспорт жирных кислот [8, 9]. Помимо этого VDR способен регулировать экспрессию базолатеральных транспортных систем, обеспечивающих транспорт жирных кислот и ряда других соединений из гепатоцитов в систему воротной вены. Таким образом, VDR регулирует транспорт и метаболизм жирных кислот преимущественно в кишечнике (в энтероцитах отмечается наиболее высокий уровень экспрессии VDR, помимо этого участвует в I и II фазах детоксикации жирных кислот в гепатоцитах. Применение витамина D3 или его синтетических агонистов представляет собой один из возможных подходов к терапии холестатических заболеваний и может служить одним из направлений будущих клинических исследований [9].
Заключение
Таким образом, в ходе исследования выявлено, что генотип А/А полиморфизма BSMI (283 G>A) гена VDR является кандидатным в развитии ХЗЛ у детей. Гомозиготный генотип А/А может рассматриваться в качестве протективного в реализации тяжелого обострения бронхолегочного процесса, контаминации и хронического варианта высева высокопатогенной микрофлоры в биотопе респираторного тракта, инфляции легочных функциональных показателей и ассоциированного со снижением значений кальцидиола в сыворотке крови ниже 20 нг/мл у детей с ХЗЛ.
Определена ассоциация мажорного генотипа G/G полиморфизма BSMI (283 G>A) гена VDR с наследственными заболеваниями бронхолегочной системы у лиц женского пола, со среднетяжелыми обострениями, грамположительным профилем микробиоты дыхательных путей, с умеренной частотой развития необратимых морфо-функциональных изменений в форме бронхоэктазий, снижением показателей сывороточного кальцидиола в диапазоне 21–30 нг/мл, у детей с ХЗЛ.
Вклад авторов. Концепция и дизайн исследования – И.А. Аверина, Д.Ф. Сергиенко. Сбор и обработка материала – И.А. Аверина. Статистическая обработка данных – И.А. Аверина. Написание текста – И.А. Аверина, Д.Ф. Сергиенко. Редактирование – Д.Ф. Сергиенко.



