1НИИ медицинской генетики ФГБНУ Томский НИМЦ, Россия, г. Томск
2ФГБОУ ВО СибГМУ Минздрава России, Россия, г. Томск
3ОГАУЗ ОПЦ, Россия, г. Томск
Цель исследования. В обзоре освещены вопросы, связанные с изучением роли генетической компоненты в формировании подверженности к привычному невынашиванию беременности (ПНБ) посредством обобщенного количественного анализа данных.
Материал и методы. В обзор включены результаты зарубежных и отечественных метаанализов, найденных в базе данных PubMed по данной тематике, опубликованные за последние 10 лет.
Результаты. Проведено обобщение данных, полученных в метаанализах исследований ассоциации аллельных вариантов генов-кандидатов с ПНБ, и охарактеризована функциональная значимость ряда ассоциированных полиморфных маркеров. Показана важность учета этнической принадлежности индивидов при изучении роли генетических факторов в развитии данной патологии, а также ген-генных и ген-средовых взаимодействий.
Заключение. Создание в перспективе базы данных, включающей результаты ассоциативных исследований с детальным описанием их дизайна (подробные клинические характеристики обследованных индивидов, критерии формирования групп, этническая принадлежность пациентов), будет способствовать получению статистически значимых доказательств роли генетической компоненты в структуре подверженности к ПНБ.
�привычное невынашивание беременности
полиморфный вариант
ген
наследственная предрасположенность
метаанализ
На сегодняшний день одной из наиболее важных проблем акушерства, оказывающих отрицательное воздействие на репродуктивное здоровье женщины и обусловливающих высокие показатели перинатальной заболеваемости и смертности, является привычное невынашивание беременности (ПНБ), согласно определению ВОЗ – наличие в анамнезе у женщины подряд 3 и более самопроизвольных прерываний беременности в сроках до 22 недель. По данным многих авторов, частота данного осложнения не имеет тенденции к снижению и составляет от 1 до 5% всех беременностей [1–3]. ПНБ – одна из самых трудных областей в репродуктивной медицине, так как этиология данного заболевания часто неизвестна, а современная диагностика и известные стратегии лечения, основанные на фактических данных, недостаточно эффективны [2, 4].
Привычное невынашивание является полиэтиологическим симптомокомплексом, развитию которого наиболее часто способствуют анатомические, инфекционные, иммунологические, эндокринные и генетические факторы в различных сочетаниях. При исключении всех вышеперечисленных причин, ведущих к потере беременности, в 50% случаев остается группа пациенток, генез привычного выкидыша которых представляется неясным (идиопатическим) [3].
Согласно современным представлениям, одним из ведущих факторов идиопатического ПНБ ранних сроков является наследственная предрасположенность со стороны родителей [3, 5]. К настоящему времени изучено более 230 генов-кандидатов ПНБ (база данных «HuGЕ Navigator»), имеющих отношение к тромбофилии и гипофибринолизу, метаболизму фолиевой кислоты и витамина B12, функционированию эндотелиальных клеток, метаболизму гормонов, иммунному ответу и др. Однако результаты этих работ нередко противоречивы даже в рамках изучения одной и той же этнической группы, что может быть обусловлено различным дизайном исследования (например, отличием критериев формирования обследуемых групп), методическими ошибками и/или малым объемом выборок [3]. В связи с чем определенный научный интерес представляют результаты обобщенного количественного анализа данных (метаанализа), полученных в отдельных исследованиях ассоциации полиморфных вариантов генов-кандидатов с ПНБ. За счет увеличения размеров выборки такой подход обеспечивает большую статистическую мощность, чем каждое отдельное исследование, и уменьшает вероятности случайных и систематических ошибок [6].
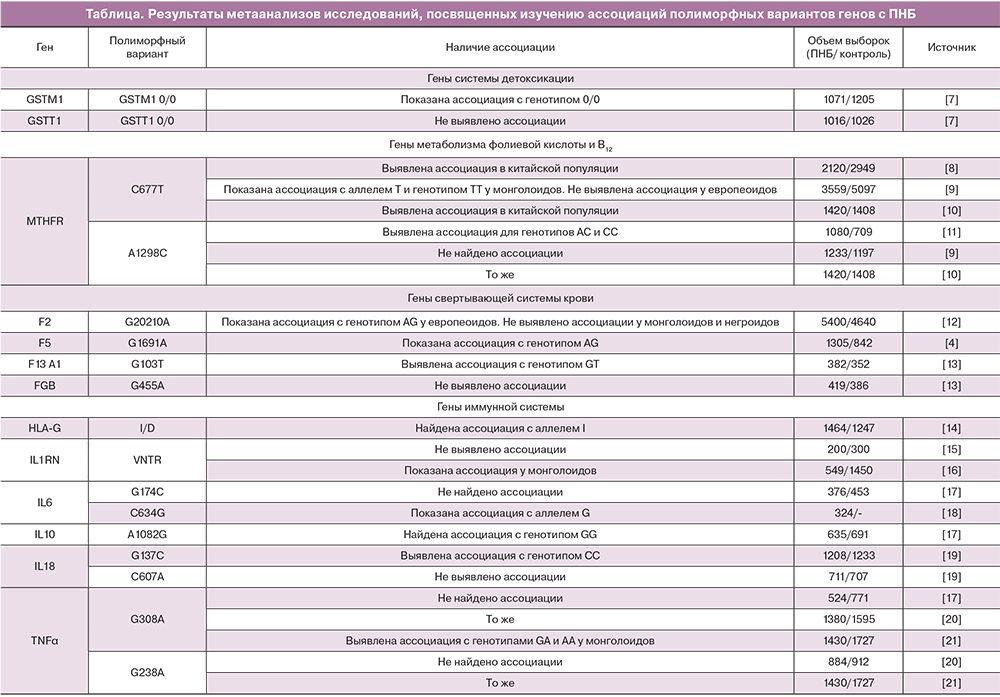
В настоящей работе с целью выявления ассоциации полиморфных вариантов генов, ответственных за предрасположенность к развитию ПНБ, были использованы следующие варианты запроса в поисковой строке базы данных «PubMed»: «meta-analysis, polymorphism gene recurrent pregnancy loss»; «meta-analysis, polymorphism gene recurrent miscarriage»; «meta-analysis, polymorphism gene recurrent spontaneous abortion». Всего было найдено 33 статьи по данной тематике, в которых была изучена ассоциация с ПНБ тридцати полиморфных вариантов 21-го гена. Результаты исследований приводятся в таблице [7–35].
Как видно, данные, полученные в метаанализах исследований ассоциации с ПНБ аллельных вариантов генов, свидетельствуют о значимой роли в структуре подверженности к ПНБ полиморфных маркеров ряда генов: глутатион S-трансферазы мю-1 (GSTM1), метилентетрагидрофолатредуктазы (MTHFR), пятого фактора свертывания крови (F5), протромбина (F2), субъединицы А1 XIII фактора свертывания крови (F13A1), антигена HLA-G (HLA-G), антагониста рецептора интерлейкина 1 (IL1RN), интерлейкинов 6, 10 и 18 (IL6, IL10, IL18), фактора некроза опухоли α (TNFα), ангиотензин-конвертирующего фермента (ACE), эндотелиальной синтазы оксида азота (NOS3), гена-супрессора опухоли (TP53), ингибитора активатора плазминогена (SERPINE1), фактора роста эндотелия сосудов (VEGF). Однако следует отметить, что результаты ряда других работ, основанных на аналогичном статистическом подходе, не обнаруживают связи данных маркеров с ПНБ. Например, Medica и соавт. (2009) сообщили в своей работе об отсутствии ассоциации между полиморфным вариантом G308A гена TNFα и ПНБ [17]. Аналогичные результаты были получены в исследовании Zhang и соавт. (2009) [20]. В то же время последующий метаанализ, проведенный Li и соавт. в 2016 году, показал, что генотипы GA и AA маркера G308A гена TNFα являются предрасполагающими к развитию ПНБ у индивидов, принадлежащих к монголоидной расе [21]. Аналогичные противоречивые данные были получены в ряде метаанализов и для полиморфных вариантов А1298С гена MTHFR и VNTR гена IL1RN, I/D-полиморфизма гена ACE, варианта -675 4G/5G гена SERPINE-1, маркера G1154A гена VEGFA [9–11, 15, 16, 23–26, 32–35].
Вышеописанные разноречивые результаты могут быть обусловлены этнической специфичностью наследственной структуры ПНБ и/или наличием ген-генных и ген-средовых взаимодействий, а также различными методическими подходами в реализации метаанализов. Необходимо отметить, что нередко в рассмотренных метаанализах не учитывалась этническая принадлежность исследованных групп. Однако, несмотря на вышеозначенную проблему, при обобщенном анализе литературных данных можно выделить ряд генетических маркеров, продемонстрировавших ассоциацию с ПНБ в нескольких метаанализах: С677Т гена MTHFR (rs1801133), 4G/5G гена SERPINE-1 (rs1799889), G894T (rs2070744) гена NOS3, I/D-полиморфизм гена ACE (rs4646994), G215C (rs1042522) гена TP53, G634C (rs2010963) и C936T (rs3025039) гена VEGF-A, в связи с чем хотелось бы привести более подробную функциональную характеристику этих аллельных вариантов, несомненно, представляющих интерес в рамках изучения предрасположенности к развитию ПНБ.

Характеристика функциональной значимости полиморфных вариантов генов-кандидатов привычного невынашивания беременности
Полиморфный вариант С677Т гена MTHFR. Несинонимичная замена С677Т гена MTHFR обусловливает снижение активности метилентетрагидрофолатредуктазы до 30% обычного уровня у гомозигот 677ТТ и до 65% у гетерозигот, которое связано с заменой аминокислотного остатка аланина на валин в области связывания данного фермента с ко-фактором флавин-аденин-динуклеотид [8].
Данный вариант представляет интерес в связи с патологическими состояниями, ведущими к накоплению гомоцистеина в организме и повреждению эндотелия с последующей активацией внутрисосудистого свертывания и развитием многих гестационных осложнений, в том числе и ПНБ [36].
Инсерционно-делеционный полиморфизм -675 4G/5G гена SERPINE1. Ген SERPINE1 кодирует один из основных ингибиторов фибринолиза – ингибитор активатора плазминогена 1-го типа (PAI-1). Известно, что маркер -675 4G/5G локализуется в промоторной области гена SERPINE1 и входит в состав сайта связывания активатора его транскрипции, при этом для носителей аллеля 5G возможно связывание как с активатором, так и с репрессором, подавляющим транскрипцию гена и таким образом снижающим уровень PAI-1 в тканях [37].
Гипофибринолиз, обусловленный 4G/4G генотипом, ассоциирован с повышенным риском развития таких осложнений беременности, как плацентарная недостаточность, внутриутробная задержка роста плода, ПНБ и преэклампсия. Необходимо отметить, что наряду с регуляцией фибринолиза, PAI-1 участвует и в протеолитическом каскаде, вовлеченном в патологические процессы при инвазии трофобласта, связанные с молекулярными механизмами ПНБ [37, 38].
Полиморфный вариант G894T гена NOS3. Продукт гена NOS3 – эндотелиальная NO-синтаза – участвует в синтезе оксида азота (NO), являющегося одним из основных медиаторов релаксации гладкомышечных клеток сосудов. Полиморфизм G894T гена NOS3 представляет собой замену гуанина на тимин в позиции 894 в седьмом экзоне гена NOS3, что приводит к замене глутамина на аспарагин в оксигеназном домене фермента и изменению его каталитической активности [37].
Патогенетическая роль эндогенного NO при ПНБ связана с развитием эндотелиальной дисфункции как в материнском организме, так и в фетоплацентарном комплексе [29].
Инсерционно-делеционный полиморфизм гена ACE. Alu-повтор гена АСЕ, состоящий из 287 пар оснований, определяет содержание ангиотензинпревращающего фермента (АПФ) в различных тканях: у носителей генотипа I/I имеет место минимальный уровень данного энзима, тогда как максимальное его содержание отмечено у лиц с генотипом D/D. Предполагается, что механизм влияния данного полиморфного варианта на вариабельность уровня АПФ и функционирование ренин-ангиотензин-альдостероновой системы связан с изменением регуляции экспрессии гена АСЕ [27]. Кроме того, показана ассоциация аллеля D гена АСЕ с повышенной резистентностью маточных артерий, являющейся маркером развития внутриутробной задержки роста плода [39].
Полиморфный вариант G215C гена TP53 характеризуется заменой нуклеотида гуанина на цитидин в 72-м кодоне гена, вследствие чего происходит замена аргинина на пролин и возникают изменения биологической активности кодируемого протеина p53 – многофункционального транскрипционного фактора, активируемого стрессовыми стимулами, включая повреждение ДНК и гипоксию. Показано, что p53 является мощным индуктором апоптоза и играет важную роль в ангиогенезе и эмбриональном развитии посредством взаимодействия с рядом белков, участвующих в контроле пролиферативных и воспалительных процессов, а также регуляции транскрипции [31].
Полиморфизмы гена VEGFA. Сосудисто-эндотелиальный фактор роста (VEGF) – продукт гена VEGFA, является важнейшим ангиогенным фактором, необходимым для успешной имплантации, инвазии трофобласта и развития эмбриона. В рассмотренных выше метаанализах с развитием ПНБ показана связь двух полиморфных вариантов гена VEGFA – G634C и C936T, расположенных соответственно в 5′- и 3′-нетранслируемых областях данного локуса и ассоциированных с вариабельностью уровня его транскрипта [40, 41]. Показано, что нарушение экспрессии гена VEGFA в плацентарной ткани может приводить к ряду неблагоприятных исходов беременности, включая ПНБ, внутриутробную гибель и задержку развития плода, а также преэклампсию [42].
Таким образом, проведенные многочисленные ассоциативные исследования генов-кандидатов ПНБ продемонстрировали немаловажный вклад генетической компоненты в структуру подверженности к данной патологии. Однако, несмотря на очевидность генетической предрасположенности к развитию ПНБ, к настоящему времени не выявлено этиологической значимости конкретного гена или группы генов, детерминирующих развитие этого осложнения беременности. Результаты ассоциативных исследований, посвященные данной проблеме, зачастую являются противоречивыми для разных этнических групп, что может быть связано с вариабельностью структуры наследственной компоненты ПНБ между различными популяционными выборками, а также ген-генными и ген-средовыми взаимодействиями. Кроме того, одной из основных проблем большинства работ, опубликованных на сегодняшний день, является небольшой размер изученных выборок и отсутствие подробной характеристики обследованных индивидов, что затрудняет проведение качественных систематических обзоров и метаанализов. В перспективе создание базы данных, включающей результаты подобных исследований, проведенных в различных популяциях, и подробное описание их дизайна (клинические характеристики обследованных индивидов, критерии формирования групп, этническая принадлежность пациентов) будет способствовать получению статистически значимых доказательств роли генетической компоненты в структуре подверженности к ПНБ.
1. Сидельникова В.М., Сухих Г.Т. Невынашивание беременности. М.: ГЭОТАР-Медиа; 2010. 534с.
2. Радзинский В.Е., Соловьева А.В., Оленев А.С. Невынашивание беременности. Что в перспективе? Репродуктивная медицина. 2014; 3-4: 8-10.
3. Rull K., Nagirnaja L., Laan M. Genetics of recurrent miscarriage: challenges, current knowledge, future directions. Front. Genet. 2012; 3: 34.
4. Sergi C., Al Jishi T., Walker M. Factor V Leiden mutation in women with early recurrent pregnancy loss: a meta-analysis and systematic review of the causal association. Arch. Gynecol. Obstet. 2015; 291(3): 671-9. doi: 10.1007/s00404-014-3443-x.
5. Kolte A.M., Nielsen H.S., Steffensen R., Crespi B., Christiansen O.B. Inheritance of the 8.1 ancestral haplotype in recurrent pregnancy loss. Evol. Med. Public Health. 2015; (1): 325-31. doi: 10.1093/emph/eov031.
6. Schulze R. Meta-analysis: a comparision of approaches. Cambridge, MA: Hogrefe & Huber; 2004. 242p.
7. Nair R.R., Khanna A., Singh K. Association of GSTT1 and GSTM1 polymorphisms with early pregnancy loss in an Indian population and a meta-analysis. Reprod. Biomed. Online. 2013; 26(4): 313-22. doi: 10.1016/j.rbmo.2012.12.004.
8. Ren A., Wang J. Methylenetetrahydrofolate reductase C677T polymorphism and the risk of unexplained recurrent pregnancy loss: a meta-analysis. Fertil. Steril. 2006; 86(6): 1716-22. doi: 10.1016/j.fertnstert.2006.05.052.
9. Cao Y., Xu J., Zhang Z., Huang X., Zhang A., Wang J. et al. Association study between methylenetetrahydrofolate reductase polymorphisms and unexplained recurrent pregnancy loss: a meta-analysis. Gene. 2013; 514(2): 105-11. doi: 10.1016/j.gene.2012.10.091.
10. Chen H., Yang X., Lu M. Methylenetetrahydrofolate reductase gene polymorphisms and recurrent pregnancy loss in China: a systematic review and meta-analysis. Arch. Gynecol. Obstet. 2016; 293(2): 283-90. doi: 10.1007/s00404-015-3894-8.
11. Nair R.R., Khanna A., Singh R., Singh K. Association of maternal and fetal MTHFR A1298C polymorphism with the risk of pregnancy loss: a study of an Indian population and a meta-analysis. Fertil. Steril. 2013; 99(5): 1311-8. e4. doi: 10.1016/j.fertnstert.2012.12.027.
12. Gao H., Tao F.B. Prothrombin G20210A mutation is associated with recurrent pregnancy loss: a systematic review and meta-analysis update. Thromb. Res. 2015; 135(2): 339-46. doi: 10.1016/j.thromres.2014.12.001.
13. Li J., Wu H., Chen Y., Wu H., Xu H., Li L. Genetic association between FXIII and β-fibrinogen genes and women with recurrent spontaneous abortion: a meta- analysis. J. Assist. Reprod. Genet. 2015; 32(5): 817-25. doi: 10.1007/s10815-015-0471-9.
14. Wang X., Jiang W., Zhang D. Association of 14-bp insertion/deletion polymorphism of HLA-G gene with unexplained recurrent spontaneous abortion: a meta-analysis. Tissue Antigens. 2013; 81(2): 108-15. doi: 10.1111/tan.12056.
15. Agrawal S., Parveen F., Faridi R.M., Prakash S. Interleukin-1 gene cluster variants and recurrent pregnancy loss among North Indian women: retrospective study and meta-analysis. Reprod. Biomed. Online. 2012; 24(3): 342-51. doi: 10.1016/j.rbmo.2011.11.021.
16. Nair R.R., Khanna A., Singh K. Association of interleukin 1 receptor antagonist (IL1RN) gene polymorphism with recurrent pregnancy loss risk in the North Indian Population and a meta-analysis. Mol. Biol. Rep. 2014; 41(9): 5719-27. doi: 10.1007/s11033-014-3443-8.
17. Medica I., Ostojic S., Pereza N., Kastrin A., Peterlin B. Association between genetic polymorphisms in cytokine genes and recurrent miscarriage – a meta-analysis. Reprod. Biomed. Online. 2009; 19(3): 406-14.
18. Bombell S., McGuire W. Cytokine polymorphisms in women with recurrent pregnancy loss: meta-analysis. Aust. N. Z. J. Obstet. Gynaecol. 2008; 48(2): 147-54. doi: 10.1111/j.1479-828X.2008.00843.x.
19. Chen H., Yang X., Du J., Lu M. Interleukin-18 gene polymorphisms and risk of recurrent pregnancy loss: A systematic review and meta-analysis. J. Obstet. Gynaecol. Res. 2015; 41(10): 1506-13. doi: 10.1111/jog.12800.
20. Zhang B., Liu T., Wang Z. Association of tumor necrosis factor-α gene promoter polymorphisms (-308G/A, -238G/A) with recurrent spontaneous abortion: a meta-analysis. Hum. Immunol. 2012; 73(5): 574-9. doi: 10.1016/j.humimm.2012.01.008.
21. Li H.H., Xu X.H., Tong J., Zhang K.Y., Zhang C., Chen Z.J. Association of TNF-α genetic polymorphisms with recurrent pregnancy loss risk: a systematic review and meta-analysis. Reprod. Biol. Endocrinol. 2016; 14: 6. doi: 10.1186/s12958-016-0140-6.
22. Su M.T., Lin S.H., Chen Y.C. Association of sex hormone receptor gene polymorphisms with recurrent pregnancy loss: a systematic review and meta-analysis. Fertil. Steril. 2011; 96(6): 1435-44. e1. doi: 10.1016/j.fertnstert.2011.09.030.
23. Yang C., Fangfang W., Jie L., Yanlong Y., Jie W., Xuefei L. et al. Angiotensin-converting enzyme insertion/deletion (I/D) polymorphisms and recurrent pregnancy loss: a meta-analysis. J. Assist. Reprod. Genet. 2012; 29(11): 1167-73. doi: 10.1007/s10815-012-9870-3.
24. Wang Z., Wang P., Wang X., He X., Wang Z., Xu D. et al. Significant association between angiotensin-converting enzyme gene insertion/deletion polymorphism and risk of recurrent miscarriage: a systematic review and meta-analysis. Metabolism. 2013; 62(9): 1227-38. doi: 10.1016/j.metabol.2013.03.003.
25. Su M.T., Lin S.H., Chen Y.C., Kuo P.L. Genetic association studies of ACE and PAI-1 genes in women with recurrent pregnancy loss: a systematic review and meta-analysis. Thromb. Haemost. 2013; 109(1): 8-15. doi: 10.1160/TH12-08-0584.
26. Pereza N., Ostojić S., Zdravčević M., Volk M., Kapović M., Peterlin B. Insertion/deletion polymorphism in intron 16 of ACE gene in idiopathic recurrent spontaneous abortion: case-control study, systematic review and meta-analysis. Reprod. Biomed. Online. 2016; 32(2): 237-46. doi: 10.1016/j.rbmo.2015.11.003.
27. Su M.T., Lin S.H., Chen Y.C. Genetic association studies of angiogenesis- and vasoconstriction-related genes in women with recurrent pregnancy loss: a systematic review and meta-analysis. Hum. Reprod. Update. 2011; 17(6): 803-12. doi: 10.1093/humupd/dmr027.
28. Cao Y., Zhang Z., Xu J., Wang J., Yuan W., Shen Y. et al. Genetic association studies of endothelial nitric oxide synthase gene polymorphisms in women with unexplained recurrent pregnancy loss: a systematic and meta-analysis. Mol. Biol. Rep. 2014; 41(6): 3981-9. doi: 10.1007/s11033-014-3266-7.
29. Pereza N., Peterlin B., Volk M., Kapović M., Ostojić S. A critical update on endothelial nitric oxide synthase gene variations in women with idiopathic recurrent spontaneous abortion: genetic association study, systematic review and meta-analyses. Mol. Hum. Reprod. 2015; 21(5): 466-78. doi: 10.1093/molehr/gav008.
30. Tang W., Zhou X., Chan Y., Wu X., Luo Y. p53 codon 72 polymorphism and recurrent pregnancy loss: a meta-analysis. J. Assist. Reprod. Genet. 2011; 28(10): 965-9. doi: 10.1007/s10815-011-9618-5.
31. Chen H., Yang X., Wang Z. Association between p53 Arg72Pro polymorphism and recurrent pregnancy loss: an updated systematic review and meta-analysis. Reprod. Biomed. Online. 2015; 31(2): 149-53. doi: 10.1016/j.rbmo.2015.05.003.
32. Chen H., Nie S., Lu M. Association between plasminogen activator inhibitor-1 gene polymorphisms and recurrent pregnancy loss: a systematic review and meta-analysis. Am. J. Reprod. Immunol. 2015; 73(4): 292-300. doi: 10.1111/aji.12321.
33. Li X., Liu Y., Zhang R., Tan J., Chen L., Liu Y. Meta-analysis of the association between plasminogen activator inhibitor-1 4G/5G polymorphism and recurrent pregnancy loss. Med. Sci. Monit. 2015; 21: 1051-6. doi: 10.12659/MSM.892898.
34. Zhang B., Dai B., Zhang X., Wang Z. Vascular endothelial growth factor and recurrent spontaneous abortion: a meta-analysis. Gene. 2012; 507(1): 1-8. doi: 10.1016/j.gene.2012.06.049.
35. Xu X., Du C., Li H., Du J., Yan X., Peng L. et al. Association of VEGF genetic polymorphisms with recurrent spontaneous abortion risk: a systematic review and meta-analysis. PLoS One. 2015; 10(4): e0123696. doi: 10.1371/journal.pone.0123696.
36. Трифонова Е.А., Габидулина Т.В., Агаркова Т.А., Габитова Н.А., Степанов В.А. Гомоцистеин, полиморфизмы гена MTHFR и осложнения беременности. Акушерство и гинекология. 2011; 2: 8-15. [Trifonova E.A., Gabidulina T.V., Agarkova T.A., Gabitova N.A., Stepanov V.A. Homocysteine, MTHFR gene polymorphisms, and pregnancy complications. Akusherstvo i Ginekologiya/Obstetrics and Gynecology. 2011; (2): 8-15. (in Russian)
37. Трифонова Е.А., Габидулина Т.В., Бухарина И.Ю., Степанов В.А. Роль факторов наследственной предрасположенности в развитии преэклампсии: обзор данных мета-анализов. Молекулярная медицина. 2016; 1: 8-14.
38. Ramón L.A., Gilabert–Estellés J., Cosín R., Gilabert J., España F., Castelló R. et al. Plasminogen activator inhibitor-1 (PAI-1) 4G/5G polymorphism and endometriosis. Influence of PAI-1 polymorphism on PAI-1 antigen and mRNA expression. Thromb. Res. 2008; 122(6): 854-60.
39. Serrano N.C., Díaz L.A., Páez M.C., Mesa C.M., Cifuentes R., Monterrosa A. et al. Angiotensin-converting enzyme I/D polymorphism and pre-eclampsia risk: evidence of small-study bias. PLoS Med. 2006; 3(12): e520.
40. Amirchaghmaghi E., Rezaei A., Moini A., Roghaei M.A., Hafezi M., Aflatoonian R. Gene expression analysis of VEGF and its receptors and assessment of its serum level in unexplained recurrent spontaneous abortion. Cell J. 2015; 16(4): 538-45.
41. Galazios G., Papazoglou D., Tsikouras P., Kolios G. Vascular endothelial growth factor gene polymorphisms and pregnancy. J. Matern. Fetal Neonatal Med. 2009; 22(5): 371-8. doi: 10.1080/14767050802645035.
42. Su M.T., Lin S.H., Chen Y.C., Kuo P.L. Gene-gene interactions and risk of recurrent miscarriages in carriers of endocrine gland-derived vascular endothelial growth factor and prokineticin receptor polymorphisms. Fertil. Steril. 2014; 102(4): 1071-7. e3. doi: 10.1016/j.fertnstert.2014.06.042.
Поступила 19.08.2016
Принята в печать 02.09.2016
Трифонова Екатерина Александровна, к.м.н., научный сотрудник НИИ медицинской генетики ФГБНУ Томский НИМЦ.
Адрес: 634050, Россия, Томск, ул. Набережная р. Ушайки, д. 10. Телефон: 8 (3822) 51-33-34. E-mail:
ekaterina.trifonova@medgenetics.ru
Ганьжа Ольга Александровна, ординатор ФГБОУ ВО СибГМУ Минздрава России.
Адрес: 634050, Россия, Томск, Московский тракт, д. 2. Телефон: 8 (923) 422-74-46. E-mail:
ganzha.olga42@gmail.com
Габидулина Татьяна Васильевна, к.м.н., доцент кафедры акушерства и гинекологии ФГБОУ ВО СибГМУ Минздрава России.
Адрес: 634050, Россия, Томск, Московский тракт, д. 2. Телефон: 8 (913) 850-11-20. E-mail:
helen556@yandex.ru
Девятьярова Лариса Леонидовна, врач-акушер-гинеколог ОГАУЗ ОПЦ.
Адрес: 634049, Россия, Томск, ул. Ивана Черных, д. 96/1. Телефон: 8 (3822) 64-49-00. E-mail:
dev-larisa@yandex.ru
Сотникова Лариса Степановна, д.м.н., профессор кафедры акушерства и гинекологии ФГБОУ ВО СибГМУ Минздрава России.
Адрес: 634050, Россия, Томск, Московский тракт, д. 2. Телефон: 8 (3822) 90-11-01. E-mail:
sotnikova-larisa@mail.ru
Степанов Вадим Анатольевич, д.б.н., профессор, директор НИИ медицинской генетики ФГБНУ Томский НИМЦ.
Адрес: 634050, Россия, Томск, ул. Набережная р. Ушайки, д. 10. Телефон: 8 (3822) 51-33-34. E-mail:
vadim.stepanov@medgenetics.ru
Для цитирования: Трифонова Е.А., Ганьжа О.А., Габидулина Т.В., Девятьярова Л.Л., Сотникова Л.С., Степанов В.А. Генетические факторы в развитии привычного невынашивания беременности: обзор данных мета-анализов.
Акушерство и гинекология. 2017; 4: 14-20
http://dx.doi.org/10.18565/aig.2017.4.14-20





