Введение
Гиперчувствительный пневмонит (синонимы: экзогенный аллергический альвеолит, гиперсенситивный пневмонит) – интерстициальное заболевание легких, развивающееся в результате иммунологически опосредованного воспаления в ответ на повторно вдыхаемые вещества антигенной природы восприимчивыми лицами. Гораздо реже возможен неингаляционный вариант гиперчувствительного пневмонита (ГП) в качестве одной из форм лекарственно-индуцированных заболеваний легких.
Первое научное описание клинической картины ГП, возникшего у пяти фермеров после работы с влажным сеном, выполнено в 1932 г. J. Campbell, назвавшим заболевание «легкое фермера» [1]. Только через 30 лет установлены его этиологический фактор (Thermophilic actinomycetes) и иммунные механизмы патогенеза [2]. К тому времени стали определяться и другие клинические варианты ГП, в частности «легкое любителей птиц» среди лиц, занимавшихся разведением голубей [3]. В 1967 г. J. Pepys предложил обобщающее название «экзогенный аллергический альвеолит», под которым понималось заболевание, инициируемое различными внешнесредовыми антигенными факторами [4]. В современной медицинской литературе преобладает обозначение болезни как ГП, что наиболее полно отражает характер патологического процесса, т.к. кроме альвеол в него вовлекаются и другие легочные структуры: интерстиций, бронхиолы, сосуды, плевра, лимфоидная ткань.
Эпидемиология
Данные о заболеваемости и распространенности ГП на популяционном уровне ограниченны, что связано с его невысокой частотой и отсутствием стандартизованных методов диагностики. В то же время эти показатели при ГП значительно варьируются в различных когортах населения в зависимости от климатогеографических, экологических, бытовых и профессиональных факторов, особенностей хобби, а также этиологии болезни. Наиболее часто ГП регистрируется среди работников сельского хозяйства и птицеводов, рабочих пищевой и химической промышленности, деревообработчиков, варьируясь в исследованных группах в диапазоне от 1,3 до 16,1% [5–8]. Среди любителей голубей и других декоративных птиц заболевание выявляется от 6 до 30% случаев, показан 14-кратный риск ГП для лиц, длительно контактирующих с ними [9, 10].
Гораздо меньше исследований ГП на популяционном уровне. Заболеваемость ГП в Великобритании (база данных первичной медицинской помощи за 1991–2003 гг.) составила 0,9 случая на 100 тыс. в год [11], в Дании (Национальный регистр пациентов за 1998–2010 гг.) – 1,16 случая на 100 тыс. в год [12]. По данным эпидемиологического исследования в США (база данных медицинского страхования более 150 млн человек за 2004–2013 гг.), ежегодные показатели заболеваемости и распространенности ГП колебались в пределах 1,28–1,94 и 1,67– 2,71 на 100 тыс. человек соответственно [13].
Для оценки распространенности ГП также анализируется его удельный вес среди интерстициальных заболеваний легких (ИЗЛ). В большинстве европейских стран и США доля ГП среди других ИЗЛ находится в пределах 7–20%, по частоте уступая только идиопатическому легочному фиброзу (ИЛФ) и ИЗЛ в рамках ревматических заболеваний [14, 15]. В диапазон европейских показателей укладываются и данные по удельному весу ГП среди ИЗЛ в РФ: 10,0–12,5% [16–18].
Этиология
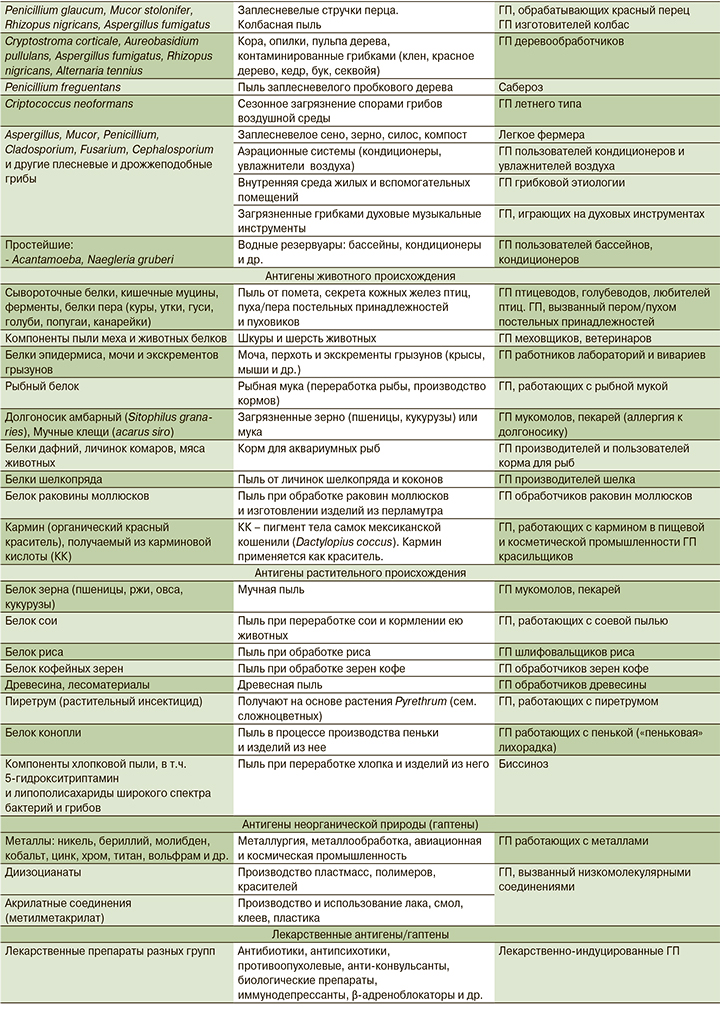
К настоящему времени известно более 200 внешнесредовых аллергенов, способных индуцировать развитие ГП. С учетом иммунобиологических и химических особенностей их обычно подразделяют на несколько групп (табл. 1): антигены микроорганизмов, животного и растительного происхождения, антигены неорганической природы (гаптены), лекарственные антигены/гаптены [19–22].
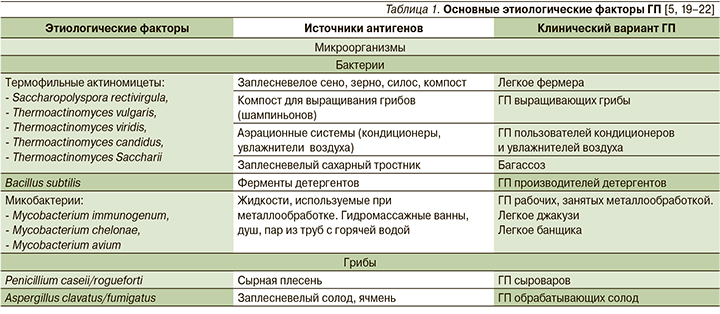
С экспозицией различных аллергенов человек сталкивается на работе, в домашних условиях, в процессе занятий, связанных с хобби. К наиболее частым причинам ГП относятся антигены микроорганизмов и животного происхождения. Среди людей, работающих в условиях сельского хозяйства, на приусадебных, дачных участках, контактирующих с гниющим и заплесневелым органическим материалом, пользующихся кондиционерами или увлажнителями воздуха, возможными причинами ГП могут быть бактериальные (термофильные актиномицеты) или грибковые аллергены. Термофильные актиномицеты широко распространены в почве, компосте, водной и влажной среде. Кроме высокой влажности необходимым условием для их жизнедеятельности является температура в пределах 40–60°С, развивающаяся при гниении органического субстрата или возникающая в бытовых приборах при их работе, где может накапливаться водный конденсат.
Кроме термофильных актиномицетов и Bacillus subtilis, используемых в производстве детергентов, большое значение придается другой разновидности бактерий – нетуберкулезным микобактериям (НТМ), распространенным в водных средах и способных контаминировать смазочноохлаждающие жидкости, используемые при обработке металлов. Попадая в дыхательные пути с жидкостным аэрозолем, НТМ инициируют развитие ГП у рабочих, занятых обработкой металлических изделий [7]. В непроизводственных условиях НТМ могут находиться в санитарно-техническом оборудовании, водной среде ванных и душевых помещений, джакузи, SPA-салонов, бассейнов. «Легкое джакузи» описано у людей, в респираторный тракт которых попадают водные аэрозоли, содержащие Mycobacterium avium [23].
Другим классом микроорганизмов, составляющих высокий удельный вес (15–46%) среди причин ГП, являются грибы [7, 24, 25]. Риск грибковой аллергии повышается у лиц, работающих в сырых и плохо проветриваемых помещениях, где имеется органический субстрат, необходимый для активной жизнедеятельности грибов. К более редким профессиональным заболеваниям, связанным с грибковой аллергией, относится ГП музыкантов, играющих на духовых инструментах (саксофон, тромбон). Сохраняющиеся в инструментах тепло и влажность способствуют размножению плесневых грибов. Аллергенную роль играют плесневые грибы, распространенные как в жилых, так и рабочих помещениях. Загрязнению грибами помещений способствуют эпизоды затоплений и протечек, сырость и плесень на мебели, половых и настенных покрытиях.
Среди этиологических факторов ГП животного происхождения наиболее часты аллергены птиц, с которыми возможен длительный контакт в условиях как профессионального, так и домашнего птицеводства или хобби: голубеводства, содержания декоративных птиц (попугаев, канареек и др.).
В целом же аллергены птиц в структуре этиологии ГП занимают одно из ведущих мест и определяются в разных когортах пациентов с частотой от 8,0 до 60,4% [13, 24, 26]. Выраженным аллергенным действием птиц обладают кишечный муцин и ферменты, содержащиеся в экскрементах, воскообразный секрет кожных желез, на перьях и подперьевом пушке, который служит для них гидроизоляцией. На аллергенные свойства образуемого биоаэрозоля влияют концентрация антигена и длительность его воздействия. Даже после удаления птиц их антигены сохраняются в помещениях в течение нескольких месяцев, более того, описаны случаи, когда биоматериал птиц, обитающих на улице, попадает в жилье человека и длительно там присутствует. Выявлена связь между интенсивностью воздействия аллергенов, течением ГП и неблагоприятным прогнозом болезни [27].
Редко диагностируется вариант ГП, ассоциированный с антигенами птиц, – «легкое пухового одеяла». Этот вариант болезни может развиваться при вдыхании пыли, содержащей антигены пуха/пера постельных принадлежностей у людей, в прошлом контактировавших с птицами и сенсибилизированных к ним либо никогда ранее не имевших контакта с птицами [28]. Трудности диагностики ГП в подобных случаях иллюстрируют результаты 6-летнего динамического обследования 60 пациентов, у которых первоначально предполагался ИЛФ. Впоследствии у 43% из них диагноз был изменен на хронический ГП (ХГП), который наиболее часто был обусловлен аллергенами птиц из постельных принадлежностей [19].
Помимо птиц причиной ГП является широкий круг различных видов животных. Этиологические факторы ГП из этой группы – белковые компоненты пыли из шерсти и меха домашних или диких животных, белки эпидермиса, мочи и экскрементов грызунов, пыль рыбной муки при переработке рыбы и производстве животных кормов. Также многообразны аллергены различных видов беспозвоночных организмов. Сюда относятся представители членистоногих (мучные клещи) и насекомых (долгоносик амбарный) – вредители зерна и муки, с которыми связан ГП мукомолов и пекарей. Аллергены таких насекомых, как шелкопряд, мексиканская кошениль, личинки комаров, могут инициировать ГП производителей шелка, работающих с кармином красильщиков, производителей и пользователей корма для аквариумных рыб.
Достаточно большая группа причинных агентов, способных вызывать ГП, представлена белками растительного происхождения. Контакт с ними происходит у людей, занятых в пищевой промышленности при вдыхании мучной и зерновой пыли (пшеницы, ржи, овса, кукурузы), а также пыли, содержащей белок сои, риса, кофейных зерен при их переработке. Работающие в условиях деревообрабатывающего и мебельного производства подвержены ингаляционному воздействию древесной пыли (опилки дуба, кедра, красного дерева и др.). У работников текстильной и швейной промышленности повышен риск ГП от вдыхания пыли, содержащей частицы хлопка, льна, конопли.
Неорганические низкомолекулярные вещества (химические соединения и металлы) становятся антигенными после соединения с белками человека в виде гаптенов. Среди них важное место в спектре этиологических факторов ГП занимают аэрозоли металлов с аллергенными свойствами. Профпатологи в этот перечень включают никель, хром, цинк, кобальт, бериллий, молибден; сплавы тугоплавких металлов и их соединений – титана, циркония, вольфрама, ванадия и др. [5]. В условиях производства и использования полимеров, пластмасс, красителей, лака, клея в химической, строительной и автомобильной промышленности часто происходит контакт человека с иной группой низкомолекулярных соединений – диизоцианатами и метилметакрилатом, способными инициировать развитие ГП.
Лекарственные средства, пожалуй, единственная группа аллергенов, способная инициировать ГП не только ингаляционным, но и другими путями проникновения в организм: пероральным и парентеральным.
Известно более 1000 фармакологических препаратов, которые могут быть причиной лекарственной легочной патологии, включая ИЗЛ – гетерогенную группу как по патогенезу, так и по клинико-рентгенологическим проявлениям [29]. К ГП относятся только ИЗЛ, инициированные лекарственными антигенами (гаптенами) и развивающиеся в результате иммуноопосредованного воспаления. К наиболее частым лекарственным этиологическим факторам ГП относятся антибиотики, противомикробные средства, иммунодепрессанты, противоопухолевые препараты, включая современные биологические агенты, противосудорожные и антипсихотические медикаменты [30].
Завершая этиологический раздел, следует подчеркнуть необходимость выявления причинно-значимых аллергенов, что важно не только для верификации диагноза ГП, но и для проведения элиминационной терапии. Вместе с тем в реальной клинической практике нередко возникает проблема определения индуктора заболевания, что не всегда связано с очевидной связью между экспозиционным воздействием и болезнью, а также отсутствием доступных высокочувствительных методов аллергенной диагностики. Это подтверждают исследования, в которых при наличии клинико-рентгенологических и морфологических признаков ГП этиологические факторы не были выявлены в 16–53% случаев [25, 26, 31–33], что послужило предпосылкой к выделению отдельной группы больных ГП с неуточненной этиологией [20, 21].
Патогенез
В основе патогенеза ГП лежит иммуноопосредованное воспаление, обусловленное сочетанием механизмов иммунокомплексной и Т-клеточой гиперчувствительности. Сложный и многоуровневый каскад иммунных, воспалительных и фибротических реакций, первоначально инициируемый причинным аллергеном в процессе формирования и эволюции ГП, в значительной степени изучен. Однако остается не совсем ясно: почему в большинстве случаев аллергенная экспозиция не приводит к формированию ГП? Его «избирательность» объясняется гипотезой «двойного попадания», когда действие антигена реализуется при наличии дополнительных генетических и внешнесредовых факторов, что обусловливает развитие чрезмерной иммунной реакции и клинически выраженной болезни [34, 35]. Значимость генетических факторов подтверждают семейные случаи заболевания среди кровных родственников, длительно живших отдельно, и полиморфизмы генов молекул главного комплекса гистосовместимости (MHC – major histocompatibility complex), участвующих в презентации антигенов, ассоциированных с восприимчивостью к ГП. Получены данные и по другим генетическим факторам, включающим полиморфизмы муцина, транспортных белков, участвующих в процессе переработки антигена, тканевых ингибиторов металлопротеиназ [5, 35].
С генетическими особенностями иммунного ответа связан феномен толерантности, благодаря которому большинство людей не реагируют на потенциальные аллергены или отвечают только продукцией специфических IgG-антител (сIgG) без каких-либо клинических проявлений ГП [36]. Иммунная толерантность контролируется T-регуляторными клетками (Treg), а их дисфункция – один из факторов развития ГП [37].
Среди внешнесредовых воздействий, способствующих развитию ГП, выделяют вирусную инфекцию, курение и загрязнение воздушной среды.
К адъювантным эффектам вирусов относят снижение фагоцитарной способности клеток и уменьшение клиренса антигена, повышение антигенпрезентирующей активности альвеолярных макрофагов, стимуляцию пролиферации Т-лимфоцитов [38]. Что касается курения, то хотя табачный дым и снижает риск возникновения ГП, однако при развитии ГП у курящих лиц заболевание характеризуется более тяжелым течением. Длительное курение увеличивает лимфоцитоз жидкости бронхоальвеолярного лаважа (ЖБАЛ) и легочный фиброз [35].
Ингаляционное воздействие аллергена характеризуется гуморальным иммунным ответом, в результате которого происходит продукция сIgG и образование иммунных комплексов (ИК) [22, 35]. Локальная депозиция ИК вызывает повреждение интерстиция и альвеол, их отек и клеточную инфильтрацию, в результате формируется острый нейтрофильный альвеолит. Активация макрофагов и нейтрофилов с продукцией ими провоспалительных медиаторов, в т.ч. интерлейкина-1 (ИЛ-1), ИЛ-8, фактора некроза опухоли-α (ФНО-α), хемотаксического цитокина CCL15, обусловлены не только действием ИК и фрагментов комплемента, но и непосредственно антигеном, а также влиянием цитокинов, секретируемых другими клетками – участницами воспаления. Нейтрофильный альвеолит возникает как при остром, так и при ХГП в период обострения, вызванного причинно-значимым аллергеном [39].
Продолжительность нейтрофильного воспаления обычно не превышает 48 часов, после чего альвеолит приобретает черты лимфоцитарного [25, 39]. Лимфоцитарный альвеолит ассоциирован с Т-клеточной гиперчувствительностью, которая развивается в течение 24–48 часов после экспозиции антигена и опосредуется при остром/подостром ГП преимущественно в рамках Тh1-зависимого иммунного ответа, параллельно протекающего с иммунокомплексными реакциями. Начальным звеном в цепи формирующейся Т-клеточной гиперчувствительности служит взаимодействие Тh1-клеток CD4+ и CD8+ с антигенпрезентирующими клетками (АПК) с помощью молекул MHC. В процессе межклеточного взаимодействия активируются как Th-лимфоциты, так и АПК, увеличивается синтез ряда провоспалительных цитокинов: ФНО-α, интерферона γ (ИФН-γ), ИЛ-12, -17, -18, -22. В результате иммунного ответа на аллергенную экспозицию развивается инфильтрация легочной ткани мононуклеарами, гранулоцитами, макрофагами, фибробластами. Среди клеточных элементов инфильтрата преобладают лимфоциты, соотношение субпопуляций которых в процессе эволюции ГП может изменяться: при остром/подостром течении заболевания больше CD8+-клеток, благодаря чему отношение CD4+/CD8+ в жидкости БАЛ<1, тогда как при хроническом и особенно фибротическом варианте пневмонита данное отношение возрастает за счет снижения числа CD8+-клеток [37, 40].
Помимо преимущественно лимфоцитарного профиля интерстициальной пневмонии другим патогенетическим признаком ГП является гранулематозный характер воспаления. Развитие гранулем связано с высоким уровнем ИФН-γ, ИЛ-12 и -17 в условиях активного антигенного воздействия, что обусловливает пролиферацию и локальное клеточное скопление в легочном интерстиции сенсибилизированных лимфоцитов, макрофагов, содержащих антигенный материал, и гистиоцитов [35]. При прекращающейся аллергенной экспозиции течение острого/подострого ГП, как правило, имеет благоприятный характер с обратимым развитием иммунного воспаления, в т.ч. и гранулематозного процесса. При хроническом течении ГП при повышенной фибробластической активности и избыточном коллагенообразовании происходит фиброзирование гранулем.
Завершает иммуновоспалительный каскад при ГП прогрессирующий интерстициальный фиброз, который ассоциируется с определенными иммунологическими изменениями. К ним относят истощение CD8+-T-клеток с увеличением отношения CD4+/CD8+-лимфоцитов, возрастание числа Th17-клеток и продукции ими ИЛ-17. Кроме того, меняется профиль иммунного ответа: если при остром/подостром ГП преобладает Th1-тип, то при ХПГ доминирующим становится Th2-тип иммунного реагирования [35, 41]. Показано, что Т-клетки ЖБАЛ и периферической крови пациентов с ХГП демонстрируют уровень экспрессии хемокиновых рецепторов, свойственный Тh2-лимфоцитам, а также более высокие уровни ИЛ-4, -10 и, наоборот, сниженное содержание ИФН-γ по сравнению с таковым у пациентов с острым/подострым ГП [37, 42]. Существенно, что между продолжительностью контакта с причинным аллергеном, показателями уровня ИЛ-4, площадью легочного фиброза, увеличением содержания в легочной ткани коллагена и трансформирующего ростового фактора-β (TGF-β) имеется положительная корреляция, отражающая активность фибробластов [43].
Исследования последних лет показали, что фиброгенез при ГП связан не только и, по-видимому, не столько с резидентными фибробластами, но в значительной степени с рекрутированием фиброцитов из костного мозга, где они представлены субпопуляцией гемопоэтических клеток, экспрессирующих молекулы коллагена I, маркеров CD34, CD45 и хемокинового рецептора CXCR4 [44]. При этом ключевую роль в миграции и накоплении фиброцитов в легких играет продуцируемый альвеолярным эпителием и взаимодействующий с клеточным рецептором CXCR4 хемокин CXCL12. Его уровень у больных ХГП значительно повышен в крови и ЖБАЛ. Мигрирующие в легкие фиброциты активируют фибробласты и совместно с ними секретируют ряд ростовых факторов, стимулирующих избыточную продукцию внеклеточного матрикса: коллаген, гладкомышечный актин, гликозаминогликаны и матричные металлопротеазы [44, 45].
Одновременно с профиброзирующим влиянием фиброциты при ХГП оказывают и провоспалительное действие: индуцируют секрецию легочными фибробластами и лимфоцитами CCL2 хемокина, с которым связано рекрутирование моноцитов и макрофагов в ответ на повреждение легких. Развивается своего рода порочный круг: воспаление–фиброз–воспаление, иллюстрирующий возможное персистирующее и самоподдерживающееся фиброзирующее воспаление, с которым, вероятно, связано прогрессирующее течение ХГП даже после полной элиминации причинно-значимого аллергена.
Классификация
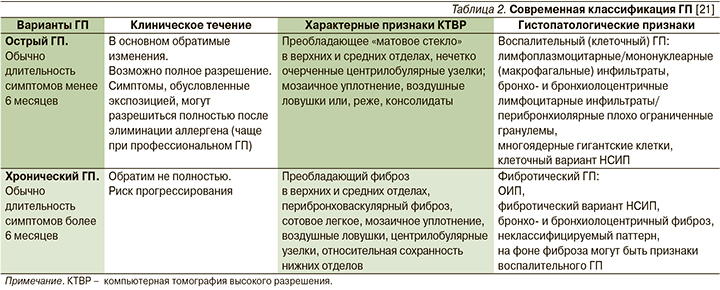
В соответствии с современной классификацией (табл. 2) выделяются острый ГП (ОГП) и ХГП [21]. Кроме критериев длительности в классификации представлены особенности клинического течения, томографические и морфологические признаки обоих вариантов заболевания, отмечается обратимость изменений, возможность их полного разрешения при ОГП и неполная обратимость с риском прогрессирования при ХГП. Важным дополнением представленной классификации является подразделение ХГП на нефибротический и фибротический варианты (фенотипы), поскольку наличие фибротических изменений существенно влияет на неблагоприятный прогноз, включая более высокий темп прогрессирования заболевания, снижение показателей выживаемости больных, а также выбор терапии [34, 46–48].
Диагностика
Диагноз ГП основывается на данных анамнеза, клинической картины и результатов дополнительных методов обследования, включающих компьютерную томографию высокого разрешения (КТВР), функциональные и иммунологические исследования, анализ ЖБАЛ, провокационный ингаляционный тест и при наличии показаний – морфологическое изучение биопсийного материала легких.
Анамнез в диагностике ГП имеет чрезвычайно большое значение, т.к. от качества расспроса пациента зависит определение этиологического фактора как ключевого компонента обоснованного диагноза. Ориентиром анамнестического поиска возможных аллергенов и их источников служат материалы по этиологии ГП, суммированные в табл. 1. Ниже представлены вопросы, рекомендуемые экспертами при изучении анамнеза у пациентов с возможным ГП [5, 21, 31, 34]:
- Возникает ли ОРВИ-подобный синдром (лихорадка, кашель, одышка), повторяющийся в определенное время недели, в определенном месте или после определенных событий (например, в начале рабочей недели или после уборки места содержания птиц)?
- Симптомы появились после переезда на новую квартиру или изменения работы?
- Пациент чувствует себя лучше вне дома или вне работы (например, в отпуске)?
- Имеется ли контакт с птицами или другими животными в домашних условиях?
- Хобби, в связи с которым возможен контакт с перьями, мехом, шерстью, растениями.
- Пользование пуховыми подушками, одеялом, спальным мешком, курткой?
- Эпизоды затоплений и протечек в квартире или на работе, сырость и плесень на мебели, половых и настенных покрытиях?
- Пользование гидромассажной ванной, джакузи, сауной, бассейном?
- Использование кондиционера или увлажнителя?
- Профессиональные особенности: ветеринария, лабораторные животные, сельское хозяйство, в т.ч. обработка сена, выращивание или обработка грибов, металлообработка, производство пластмасс или эпоксидных смол, окраска с помощью распылителей и др.
Следует иметь в виду, что временная связь между экспозицией аллергена и симптомами наиболее заметна при ОГП, тогда как при ХГП отчетливая хронологическая зависимость между аллергенным воздействием и обострением заболевания может быть менее очевидной и даже отсутствовать.
Клиническая картина
Клинические признаки ОГП возникают у сенсибилизированных лиц в течение от нескольких часов до нескольких дней после экспозиционного воздействия, затем симптомы постепенно уменьшаются, но при продолжающемся воздействии или реэкспозиции аллергена могут возникать повторно и иметь рецидивирующий характер [8, 16, 21]. Наиболее часто ОГП описывается в виде ОРВИ-подобного синдрома, при котором интенсивность симптомов варьируется, но большинство пациентов жалуются на повышение температуры тела, ощущение озноба, непродуктивный кашель, чувство стеснения в груди, одышку. У отдельных пациентов она достигает тяжелой степени и сопровождается выраженными вентиляционными нарушениями функции внешнего дыхания (ФВД). Помимо респираторных симптомов характерен интоксикационный синдром в виде лихорадки, головной боли, слабости, миалгий и артралгий. Физикальное обследование пациентов в острый период позволяет отметить при аускультации сухие рассеянные и реже свистящие хрипы, у части больных выслушивается крепитация. Возможно отсутствие физикальных нарушений, «нормальная» аускультативная картина не исключает диагноз ОГП.
ХГП наиболее часто характеризуется первично хроническим течением, которое ассоциируется с длительным воздействием ингаляционных аллергенов при невысоком уровне их экспозиции [31]. Постепенное развитие и усиление симптомов, особенно в отсутствие острых эпизодов, делают незаметным начало заболевания и часто приводят к поздней диагностике ХГП, в т.ч. уже в фазу отчетливых фибротических изменений в легких. Так, например, у 17% больных ХГП, обусловленным аллергией к птицам, временной интервал от начала экспозиционного воздействия до установления диагноза составил в среднем 16 лет, при этом 25% пациентов отмечали выраженную одышку [49].
Клинические проявления ХГП неспецифичны и характеризуются теми же симптомами, что и другие ИЗЛ: в первую очередь больные жалуются на одышку прогрессирующего характера (98%) и малопродуктивный кашель (82%) [50]. Одышка, которую первоначально пациенты отмечают только при значительных нагрузках, нарастает, что сопровождается снижением физической работоспособности и дыхательной недостаточностью (ДН), подтверждаемой снижением показателей сатурации кислорода. ДН у больных ХГП более чем в 30% случаев осложняется легочной гипертензией, рассматриваемой в качестве значимого фактора риска неблагоприятного исхода заболевания [51].
При физикальном обследовании у части больных, как правило, со значительно выраженными клинико-функциональными и КТВР-изменениями фиброзного характера отмечаются симптомы «барабанных палочек» и «часовых стекол» вследствие гипертрофической остеоартропатии концевых фаланг пальцев рук, а также снижение массы тела, которое имеет место более чем в половине случаев. При ХГП наиболее характерен аускультативный признак двусторонней инспираторной крепитации, при выраженном фибротическом процессе может выслушиваться конечно-инспираторная крепитация – т.н. треск липучки. Нередко выслушиваются и сухие, в т.ч. высокотональные «пищащие», хрипы, характерные для бронхиолита, ассоциированного с ГП [31, 34].
Говоря о течении ХГП, следует подчеркнуть его особенности в зависимости от фенотипа заболевания. Нефибротический ХГП отличается стабильным или медленнопрогрессирующим течением. При этом возможны обострения и рецидивирующий характер заболевани, даже достижение ремиссии [33, 34]. И наоборот, фибротическому варианту ХГП свойственно более тяжелое и прогрессирующее течение, при котором часто формируется ДН [20, 46, 47]. Обострения при этом варианте ХГП возникают достаточно редко, они не всегда связаны с воздействием причинного аллергена и обычно имеют тяжелое течение. После обострения клинико-функциональный статус больных к исходному состоянию, как правило, не возвращается.
Компьютерная томография высокого разрешения (КТВР)
КТВР рассматривается как ведущий метод лучевой диагностики ГП. К характерным его признакам относят симптомы «матового стекла», мозаичного уплотнения, центрилобулярные очаги, воздушные ловушки [20, 21, 48]. В основе симптома «матового стекла», визуализирующего повышение плотности легочной ткани, лежит утолщение межальвеолярных перегородок, гиповентиляция альвеол, их частичное заполнение экссудатом, увеличение капиллярного кровотока. Двусторонние изменения по типу «матового стекла» определяются чаще в верхних и средних отделах легких, имеют очаговый, неравномерный или диффузный характер. Поскольку симптом «матового стекла» отражает активное интерстициальное воспаление или умеренный фиброз, данный признак может быть как обратимым, так и необратимым.
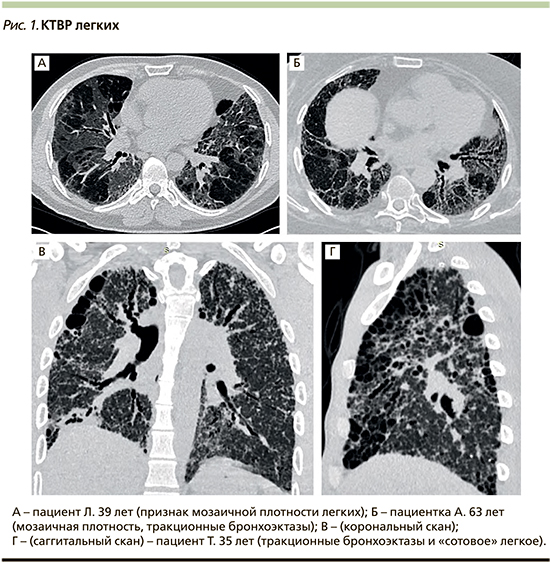
Вариантом «матового стекла» является мозаичная плотность – другой важный симптом ГП, определяемый при КТВР. Этот признак характеризуется неравномерными изменениями легочной ткани в виде чередования участков различной плотности, что связано с их различной воздушностью (рис. 1А). Наличие зон в легких с сочетанием трех различных плотностей (низкой, нормальной и повышенной) получило обозначение как симптом (паттерн) «головки сыра» (headcheese sign), ассоциированный или с интерстициальным воспалением, или с сосуществующим бронхиолитом [20, 48].
Еще одним характерным признаком ГП служат центрилобулярные очаги, представленные мелкими, плохо очерченными образованиями легочной ткани низкой плотности. Они возникают в результате клеточной инфильтрации бронхиол и перибронхиолярной легочной ткани, а значительное число таких образований при близком их расположении и частичном слиянии может создавать иллюзию диффузных инфильтративных изменений по типу матового стекла [52].
При проведении инспираторной и экспираторной КТВР могут быть выявлены т.н. воздушные ловушки – фокусы повышенной прозрачности, определяемые в конце задержанного выдоха. Их генез связывают с формированием обструктивного бронхиолита остаточным альвеолярным воздухом после неэффективного выдоха и сниженной перфузией в зонах гиперинфляции [20, 22].
Отмеченные выше КТВР-признаки могут наблюдаться как при остром/подостром, так и при хроническом ГП. Распространенность и выраженность отмеченных симптомов изменяются в периоды обострения и стабильного течения, отражая активность и в определенной мере обратимость хронического воспаления.
Фибротический фенотип ГП (ФГП) определяется на основании имеющихся признаков фиброза: ретикулярных изменений, тракционных бронхоэктазов, «сотового» легкого [20, 34]. Ретикулярные изменения (ретикулярный паттерн) в виде иррегулярных линейных затемнений возникают в результате утолщения межальвеолярных перегородок из-за клеточной инфильтрации, экссудативного компонента и интерстициального фиброза.
О более выраженном и прогрессирующем характере фиброза свидетельствуют тракционные бронхо- или бронхиолоэктазы (рис. 1Б), формирующиеся из-за расширения дистальных отделов бронхов или бронхиол в результате растяжения и деформации их стенок окружающей фиброзной тканью.
И наконец, очень важный признак поздней стадии тяжелого фиброза – множественные мелкие толстостенные воздушные полости, напоминающие по форме пчелиные соты. Именно поэтому симптом получил обозначение «сотовое» легкое, которое встречается при ФГП у 16–69% больных [21]. Фиброз в стадии «сотового» легкого свидетельствует о дезорганизации и утрате значительного объема функционально активной легочной ткани (рис. 1В, Г). Для диагностики ФГП вовсе не обязательно наличие всех перечисленных признаков, достаточно любого из них, однако в качестве индикатора наиболее тяжелого течения и неблагоприятного исхода заболевания, сближающего его с ИЛФ, рассматриваются изменения по типу «сотового» легкого [20, 47].
К важной характеристике фиброза относится его локализация, которая при ФГП чаще имеет перибронховаскулярное распределение и преобладает в средних и верхних отделах легких. Вместе с тем не исключается относительно равномерное распределение фиброза по всем легочным полям и даже нарастание фиброзных изменений от верхушек к базальным отделам. Преобладание базальной и субплевральной локализации фиброза, в т.ч. «сот», характерно для ИЛФ/обычной интерстициальной пневмонии (ОИП) и реже встречается при ФГП, что имеет важное дифференциально диагностическое значение [19, 20, 34].
Еще одним патологическим признаком, определяемым по данным КТВР у 20–48% больных ХГП, является эмфизема легких, обычно верхнедолевой локализации [21, 53]. Эмфизема при ХГП может сочетаться с фиброзом (синдром сочетанного фиброза и эмфиземы) или протекать без него.
Функциональные исследования
Гетерогенность клинических проявлений предполагает комплексную оценку функционального статуса пациентов с ГП или подозрением на него. Необходима диагностика характера и выраженности вентиляционных нарушений, диффузионной способности легких (ДСЛ), нарушений газообмена и гемодинамики в малом круге кровообращения, для чего обследование включает спирометрию, бодиплетизмографию, исследование ДСЛ, пульсоксиметрию и анализ газов крови, эходопплеркардиографию [5, 8, 50]. Результаты оценки ФВД зависят от варианта течения ГП, а при хронической форме заболевания от выраженности фиброза. Аналогично другим ИЗЛ преобладающими функциональными изменениями при ГП являются рестриктивные нарушения, снижение ДСЛ и нарушение газообмена.
При сосуществующем бронхиолите могут определяться обструктивные изменения и признаки гиперинфляции. Для ранней диагностики прогрессирующего течения ГП важна динамическая оценка показателей ФВД.
Иммунологические исследования
Иммунологические тесты (определение сIgG в крови и антиген-индуцированная пролиферация лимфоцитов) направлены на подтверждение этиологического диагноза ГП.
Наиболее полно изучено значение серологического определения сIgG. По данным мета-анализа 9 исследований, чувствительность определения птичьих сIgG составляет 82,9–92,5%, специфичность – 43,5–100% [54]. Между тем большинство авторов рассматривают положительные серологические тесты только как подтверждение имеющейся сенсибилизации, которая не всегда является индикатором развившегося ГП. Так, у 10–40% фермеров и голубеводов, имевших сIgG в крови, отсутствовали признаки заболевания [36, 49, 55]. Примером ложно отрицательного тестирования служит отсутствие сIgG у больных даже с гистологически подтвержденным ГП, что объясняется ограниченным набором диагностических аллергенных панелей [56].
Таким образом, наличие сIgG в отсутствие клинических, функциональных и КТВР-признаков заболевания не имеет определяющего диагностического значения, тогда как при соответствующем анамнезе и симптомах, характерных для ГП, наличие сIgG может интерпретироваться как существенный фактор этиологической диагностики [20].
Антиген-индуцированная пролиферация лимфоцитов (АИПЛ) Положительные результаты теста АИПЛ периферической крови или ЖБАЛ получены при ГП с аллергией к птицам [26, 39] и лекарственном ГП [57]. Несмотря на высокие показатели чувствительности и специфичности, тест до настоящего времени не нашел широкого применения в клинической практике, т.к. не стандартизованный.
Бронхоальвеолярный лаваж
У пациентов с предполагаемым ГП одним из важных компонентов диагностики является подтверждение лимфоцитарного профиля ЖБАЛ, который определяется в диапазоне 20–60% у большинства больных [21, 40, 58]. На основании двух крупных мета-анализов по оценке диагностической роли лимфоцитарного профиля БАЛ (36 исследований – 1643 пациента и 53 исследования – 3112 пациентов) группа международных экспертов рекомендует использовать показатель ≥30% лимфоцитов в ЖБАЛ в качестве одного из диагностических критериев ХГП [20]. Вместе с тем необходимо учитывать, что уровень лимфоцитоза ЖБАЛ зависит от клинических особенностей и патологических паттернов ГП. Наиболее высокие уровни лимфоцитов в БАЛ, как правило, отмечаются при остром/подостром ГП. Однако в период дебюта ОГП и в фазе обострения, вызванного воздействием причинного аллергена при ХГП, может наблюдаться нейтрофильный профиль ЖБАЛ с последующим повышением уровня лимфоцитов [31, 39]. Повышенные уровни лимфоцитоза ЖБАЛ у пациентов с ХГП чаще встречаются при вариантах с КТВР и/или морфологическим паттерном клеточной неспецифической интерстициальной пневмонии (НСИП) и организующейся пневмонии, тогда как для ОИП-паттерна более характерно невысокое содержание лимфоцитов в ЖБАЛ [21]. Также низкий удельный вес лимфоцитов в цитограмме ЖБАЛ не всегда исключает ГП, что может быть у пациентов с выраженным пневмофиброзом, курильщиков, при лечении СКС [34, 49, 59].
Кроме оценки общего уровня лимфоцитов обсуждается диагностическое значение соотношения их субпопуляций CD4+/CD8+ в ЖБАЛ. Результаты исследований свидетельствуют о значительных колебаниях этого показателя при ГП [33, 56], что свидетельствует о недостаточной чувствительности и специфичности отношения CD4+/CD8+ и не позволяет его использовать в качестве диагностического критерия [20, 21, 34].
Провокационный ингаляционный тест (ПИТ)
ПИТ может играть важную роль, когда другие методы диагностики ГП оказались недостаточными. ПИТ проводится с предполагаемым «виновным» аллергеном, доступным в виде коммерческого или индивидуально приготовленного антигенного экстракта [21]. Наиболее высокие значения чувствительности (73–99%) и специфичности (81–100%) ПИТ получены с птичьими или грибковыми аллергенами, тогда как с другими антигенами эти показатели были значительно ниже [49, 60, 61]. Интерпретация ПИТ основывается на оценке клинических, КТВР, лабораторных и функциональных признаков [21]. Анализ результатов теста демонстрирует, что если положительный тест подтверждает диагноз, отрицательный его не всегда исключает.
Характеризуя ПИТ, проводимый в лабораторных условиях, необходимо отметить его недостатки, значительно ограничивающие широкое применение: отсутствуют высокоочищенные стандартизованные антигены для ингаляционного тестирования, сам ПИТ не валидизирован для диагностики ГП, требует опытного, специально подготовленного персонала, возможны респираторные осложнения [20, 21].
В качестве альтернативы лабораторному ингаляционному тестированию возможно проведение ПИТ в естественных (профессиональных или бытовых) условиях, когда сохраняется высокая специфичность, но отсутствуют серьезные осложнения [5, 9, 16]. При этом варианте после исключения контакта с предполагаемым аллергеном на определенный период (желательно не менее недели) тест проводится в течение нескольких часов экспозиционного воздействия. В динамике оценивают температуру тела, частоту дыхания, данные аускультации легких, показатели спирометрии, по возможности, этот перечень дополняется показателями ДСЛ. ПИТ интерпретируется как положительный, если в течение 8–12 часов после экспозиционного контакта повышаются температура тела, частота дыхания, снижаются форсированная жизненная емкость легких (ФЖЕЛ) и диффузионная способность легких по оксиду углерода (DLco – diffusing capacity or transfer factor of the lung for carbon monoxide – CO) [5].
Морфология биопсийного материала легких
Биопсия легких показана в сложных случаях диагностики ГП для его верификации, когда другие неинвазивные методы исследования недостаточно информативны. Кроме хирургической биопсии легких (ХБЛ) используются трансбронхиальная биопсия (ТББ) и активно развиваемая в последние годы трансбронхиальная криобиопсия (ТБКБ). Мета-анализ 24 исследований ХБЛ и 11 исследований ТББ и ТБКБ показал близкие значения диагностической информативности для ХБЛ и ТБКБ (91,1 и 84,4%) при гораздо более низких показателях для ТББ – 64,3% [62]. Однако риск кровотечений у больных ИЗЛ повышен при ТБКБ по сравнению с ТББ: 16,2 против 4,2% (р<0,05) [63]. Международный экспертный комитет по диагностике ГП рекомендует преимущественное использование ТБКБ в случаях предполагаемого фибротического фенотипа заболевания, но при этом подчеркивает, что решение о выполнении легочной биопсии и ее методах должно приниматься после оценки всех доступных данных с учетом потенциальных преимуществ и рисков планируемых процедур в рамках полидисциплинарного обсуждения [20].
В легочных биоптатах при ГП может быть выявлена классическая триада: интерстициальная пневмония, гранулемы и бронхиолит. Весь набор перечисленных признаков определяется не всегда, т.к. частота и характер патологических изменений зависят от особенностей течения и фазы заболевания [20, 56]. Пневмония имеет преимущественно лимфоцитарный характер и на ранних стадиях бронхиолоцентрическое распределение. Позднее воспалительный процесс приобретает в большей степени диффузный характер, что соответствует паттерну НСИП. Плохо сформированные ненекротизирующие гранулемы образованы лимфоцитами и многоядерными гигантскими клетками. При фиброзных изменениях гранулемы часто не обнаруживаются. Еще один компонент патологической триады (бронхиолит) определяется у большинства больных в виде клеточного (лимфоцитарного) или в трети случаев облитерирующего бронхиолита.
По мере прогрессирования фиброза специфичность морфологических изменений при ГП значительно уменьшается и даже может полностью утрачиваться. В поздней стадии заболевания патогистологические признаки сходны с таковыми при других фиброзирующих ИЗЛ и могут проявляться в виде таких паттернов, как фибротическая НСИП, ОИП или бронхиолоцентрический фиброз. В таких случаях морфологическим маркером ГП могут быть отдельные гигантские многоядерные клетки, расположенные в участках фиброза или в «сотовых» структурах легких [20, 31].
Диагностический алгоритм
В настоящее время диагностика ГП проводится на основе анамнеза, клинической картины и ряда дополнительных исследований, в ряду которых одно из ведущих мест принадлежит КТВР. Вместе с тем, как показывает клиническая практика, распознавание ГП, особенно его хронического фибротического фенотипа, остается сложной задачей. Это подтверждается результатами недавнего международного многоцентрового исследования, которое показало низкий коэффициент согласованности диагноза ГП между клиницистами разных центров: он составил всего 0,29, что гораздо ниже, чем при ИЛФ (0,72), тогда как хорошие результаты согласованности диагноза между специалистами показывают значения в диапазоне 0,6–0,8, отличные – более 0,8 [64]. По мнению экспертов, полученные результаты обусловлены отсутствием «золотого» стандарта и унифицированных диагностических критериев, что диктует необходимость разработки современного диагностического алгоритма ГП.
В связи с этим представляется очень важным диагностический алгоритм для ХГП, предложенный международной группой экспертов (исследование Delphi) [58]. На основе трехэтапного анализа достигнут консенсус по 18 из 40 диагностических признаков, которые окончательно оценивались в условиях различных клинических сценариев на заключительном этапе обсуждения. В число наиболее характерных для ХГП критериев включены экспозиционное воздействие, клинические признаки, КТВР-симптомы, соответствующие фибротическому и нефибротическому вариантам ХГП, анализ БАЛ с определением уровня лимфоцитоза и типичные гистопатологические данные, доступные при биопсии легких.
В окончательном виде диагностический алгоритм представлен на рис. 2. В его основе лежит оценка экспозиционного воздействия, наличие которого в сочетании с типичными КТВР-признаками и лимфоцитозом ЖБАЛ свидетельствует об «определенном» ХГП. При тех же условиях, но недостаточно характерных для ХГП изменениях на КТВР диагноз заболевания рассматривается только в категории «возможного» и требует уточнения с помощью биопсии легких. Наличие морфологических маркеров предполагаемого заболевания при соответствующем анамнезе определенно подтверждает диагноз ХГП даже при КТВР-паттерне ОИП. Важной особенностью рассматриваемого алгоритма является включение в него диагностических критериев ХГП и в отсутствие сведений о возможной аллергенной экспозиции. При этом допускается единственный вариант высоковероятного (но не определенного) диагноза, когда имеется сочетание типичных КТВР-изменений с патогистологическими признаками ХГП.
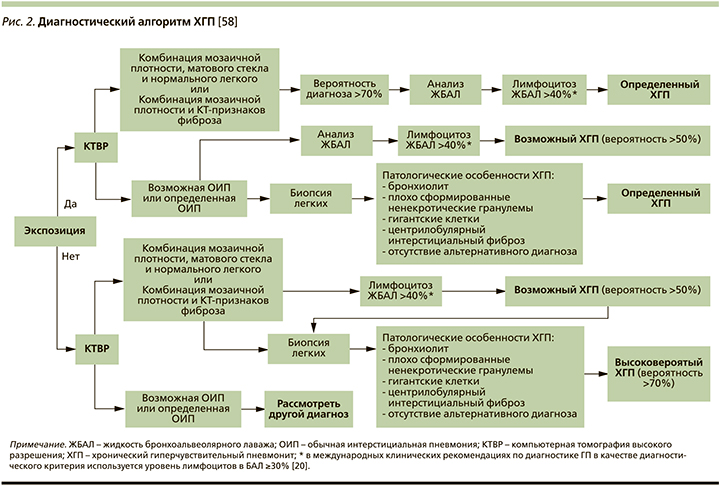
Аналогичный «дихотомический» алгоритм использован в совсем недавно опубликованных совместных рекомендациях по диагностике ГП Американского торакального общества, Японского респираторного общества и Латиноамериканской торакальной ассоциации [20]. Эксперты подчеркивают, что оценка экспозиционного воздействия кроме анамнеза включает анализ сIgG против потенциальных антигенов, связанных с ГП. При необходимости могут быть использованы ПИТ. Важным шагом в реализации диагностического алгоритма, особенно при неуточненной этиологии ГП, является междисциплинарная дискуссия с участием пульмонолога, торакального радиолога и при необходимости других специалистов.
Лечение
С учетом иммуновоспалительного патогенеза ГП основные направления его лечения включают прекращение контакта с причинным аллергеном (элиминационная терапия), противовоспалительную, иммуносупрессирующую и антифибротическую тера-пию.
Прекращение контакта с причинным аллергеном. Традиционно рассматривается как необходимый и эффективный метод лечения ГП. Эти представления основаны на данных об ОГП, который обычно разрешается после устранения «виновного» аллергена. Результаты когортного сравнительного исследования элиминационной терапии при нефибротическом ГП (НГП, n=93) и ФГП (n=109) показали, что наличие фиброза служит предиктором неэффективного устранения аллергенного воздействия [65]. Если в течение 5-летнего наблюдения при нефибротическом варианте заболевания ФЖЕЛ и ДСЛ снижались, то после элиминации аллергена тренд ФВД изменился противоположно: в течение 2 лет имело место достоверное увеличение ФЖЕЛ и ДСЛ (p=0,016). Оценка тех же параметров и в те же сроки до и после устранения причинных аллергенов у больных ФГП не выявила положительного статистически значимого терапевтического эффекта.
К факторам, затрудняющим проведение элиминационной терапии или снижающим ее эффективность, относятся неуточненная этиология ГП и не всегда имеющаяся возможность полного устранения известного причинного аллергена [9].
Системные глюкокортикостероиды (СГКС) и иммуносупрессанты применяются при ГП на протяжении длительного времени. Вместе с тем доказательная база их эффективности весьма ограничена. Имеется только одно рандомизированное плацебо-контролируемое исследование (РКИ), выполненное в 1992 г. с участием 36 пациентов с «легким фермера», показавшее увеличение ДСЛ после 8-недельной терапии преднизолоном [66]. Современное многолетнее когортное исследование эффективности СГКС при ХГП (n=202) показало положительное терапевтическое влияние многомесячного приема преднизолона, подтвержденное достоверным увеличением показателей ФЖЕЛ только при НГП (n=93), тогда как при ФГП (n=109) положительная динамика параметров ФВД в процессе лечения отсутствовала [65].
В целом СГКС рассматриваются в качестве фармакотерапевтических средств первой линии при остром/подостром и хроническом НГП; при ФГП их роль ограничена главным образом фазой обострения [22, 34, 65]. Оптимальные дозы и длительность лечения СГКС с позиций доказательной медицины не разработаны, а имеющиеся рекомендации основаны на экспертном мнении специалистов. Как правило, назначаются стартовые дозы препарата в пределах 0,5–1,0 мг/кг/сут (в пересчете на преднизолон) на 4–8 недель с постепенным снижением дозы до 10 мг/сут. Общая продолжительность терапии СГКС при остром/подостром ГП колеблется обычно от 1–2 до 6 месяцев с последующей их полной отменой или приемом поддерживающих доз преднизолона по 10–15 мг/сут. Полная отмена ГКС при их достаточной переносимости может проводиться в отсутствие клинических симптомов и функциональных нарушений [31]. Вопрос о продолжительности лечения СГКС при ХГП решается индивидуально с учетом активности воспалительного процесса, коморбидной патологии, выраженности легочного фиброза, клинической эффективности проводимой терапии и ее осложнений.
При прогрессирующем течении ГП, неэффективности СГКС или их выраженных побочных эффектах возможно проведение иммуносупрессивной терапии, в частности назначение микофенолата мофетила или азатиоприна. Однако их применение при ГП затрудняет отсутствие РКИ. До настоящего времени опубликовано 3 ретроспективных исследования, включивших 30, 70 и 131 пациента, в которых анализировались эффективность и безопасность микофенолата или азатиоприна, назначаемых как спаринг-препараты преднизолона [67, 68, 69]. Проведенные исследования показали, что многомесячное лечение как микофенолатом (1000–2000 мкг/сут), так и азатиоприном (100–150 мкг/сут) в сочетании с преднизолоном сопровождается достоверным увеличением ДСЛ при сохраняющихся без изменений показателях ФЖЕЛ. Другое важное обстоятельство – уменьшение дозы преднизолона в среднем в 2 раза и достоверное снижение частоты его побочных эффектов по сравнению с монотерапией СГКС. По-видимому, для более широкого использования иммуносупресивной терапии как в сочетании с СКС, так, возможно, и в виде монотерапии при ГП необходимы РКИ.
Антифибротическая терапия. Активно развивающийся в последнее десятилетие метод лечения ИЛФ и других фибротических ИЗЛ, в т.ч. ХГП. Обоснованность антифибротической терапии ХГП подтверждена результатами двойного слепого плацебо-контролируемого исследования INBUILD, в котором изучалась эффективность антифибротического препарата нинтеданиб для 663 больных прогрессирующими фиброзирующими ИЗЛ, в т.ч. для 173 (26,1%) пациентов с ФГП [70]. Включенные в исследование пациенты имели признаки фиброза, поразившего более 10% объема легочной ткани на КТВР, и соответствовали критериям прогрессирующего течения ИЗЛ в последние 24 месяца, несмотря на лечение. Основной конечной точкой исследования был годовой темп снижения ФЖЕЛ. Для оценки эффективности лечения в зависимости от особенностей фибротического процесса пациенты были стратифицированы, по данным КТВР, на две группы: с паттерном ОИП как варианта с менее благоприятным течением или с другими признаками фиброза.
Лечение нинтеданибом по 150 мкг 2 раза/сут в течение 52-недельного периода продемонстрировало его клиническую эффективность. В общей когорте пациентов независимо от варианта фиброза скорректированная скорость снижения ФЖЕЛ за 52-недельный период составила -80,8 мл/год, что на 107,0 мл ниже, чем в группе плацебо (р<0,001). Аналогичная динамика отмечена у пациентов с ОИП-подобным паттерном фиброза: ФЖЕЛ за 52-недельный период уменьшилась на 82,9 мл/год, что на 128,2 мл ниже, чем в группе плацебо (р<0,001). Таким образом, терапия нинтеданибом существенно замедляет прогрессирование ИЗЛ по сравнению с группой плацебо независимо от паттерна фибротических изменений, что дает основания для более широкого внедрения его в клиническую практику у пациентов с прогрессирующим фибротическим фенотипом ХГП.
Заключение
ГП – иммуновоспалительное интерстициальное заболевание легких, развивающееся под влиянием широкого спектра преимущественно ингаляционных аллергенов, этиологическая роль которых не всегда очевидна и требует тщательного поиска. Клиническая картина и течение заболевания характеризуются гетерогенными проявлениями, что часто затрудняет своевременную диагностику. Необходимым фактором улучшения диагностики ГП служит комплексная оценка анамнестических, клинических, лабораторных, функциональных и данных КТВР – одного из ключевых методов диагностики. Трудно переоценить значение междисциплинарной дискуссии в диагностике, в т.ч. при решении о необходимости биопсии и ее интерпретации. Возможности современной эффективной терапии ГП не ограничиваются только элиминационными мероприятиями, противовоспалительными и иммуносупрессивными средствами, но должны включать при прогрессирующем фиброзирующем фенотипе ХГП антифибротические лекарственные препараты.



