Важнейшей проблемой практического акушерства до настоящего времени является невынашивание беременности, достигающее 15–20% среди всех ее исходов [1]. Наиболее значимыми причинами репродуктивных потерь являются нарушения иммунных механизмов. Одним из примеров таких нарушений является антифосфолипидный синдром (АФС), представляющий собой аутоиммунное заболевание, характеризующееся стойким наличием антифосфолипидных антител и развитием тромбофилических состояний [2, 3]. Частота АФС среди пациенток с привычным невынашиванием беременности достигает 27–42% [4].
Органонеспецифические аутоантитела способны связываться с отрицательно заряженными фосфолипидами клеточных мембран тромбоцитов и клеток эндотелия [5], приводить к развитию тромбофилических осложнений, нередко заканчивающихся преждевременными родами и выкидышами [6]. Из всего многообразия существующих аутоантител выделяют только три типа, патогномоничных для АФС: волчаночный антикоагулянт, антитела к кардиолипину и антитела к бета-2 гликопротеину-1 [7]. Однако, существует также достаточно большой спектр аутоантител, которые ассоциируются с АФС, но в диагностические критерии не включены. Это антитела к фосфатидилсерину, фосфатидиловой кислоте, фосфатидилинозитолу, протеину С, аннексину 5, протромбину и другие. Их роль, также как данные о частоте выявления, носят противоречивый характер [8].
Патогенез клинических проявлений АФС реализуется в результате развития тромбофилических состояний [9]. Так, при действии различных факторов (инфекции, новообразования, лекарственные вещества), происходит активация синтеза аутоантител. Они связываются с аннексином 5, протромбином, протеинами C и S, вмешиваясь в коагуляционный каскад [10], связываясь с тромбоцитами, потенцируют их агрегацию; влияя на эндотелиальные клетки, приводят к развитию эндотелиальной дисфункции, являющейся одним из основных патогенетических факторов развития АФС [11, 12]. Медиаторы, выделяемые эндотелиальными клетками при их повреждении, могут служить дополнительными факторами, усугубляющими тяжесть течения заболевания.
Целью настоящей работы явилось исследование спектра аутоантител, ассоциированных с АФС, в периферической крови у женщин с привычным невынашиванием беременности.
Материал и методы
Проведено обследование 561 женщины репродуктивного возраста на базе ФГБНУ «НИИ АГиР им. Д.О. Отта». Обследованных женщин разделили на 2 группы: первая группа – соматически здоровые женщины с физиологически протекающей беременностью (n=76), вторая группа – женщины с диагнозом «привычное невынашивание беременности» (n=485).
Возраст женщин находился в интервале от 25 до 47 лет и в среднем составил 32±5,5 года. Критериями включения в I группу являлись I триместр беременности, отсутствие осложнений беременности. Критериями включения во II группу явились I триместр беременности, угроза прерывания беременности, невынашивание беременности в анамнезе. Всем женщинам было проведено клинико-лабораторное обследование, включающее общий анализ крови, мочи, биохимические, коагулологические и бактериологические исследования. Критериями исключения во всех группах были сахарный диабет, наличие доказанных эндокринных, генетических факторов невынашивания беременности, пороки развития матки.
В сыворотках периферической крови определяли содержание аутоантител (IgG/IgM) к кардиолипину, фосфатидилсерину, фосфатидилинозитолу, фосфатидиловой кислоте, бета2-гликопротеину-I, аннексину 5 и протромбину методом твердофазного иммуноферментного анализа (ИФА) с использованием коммерческих тест-систем фирмы Orgentec Diagnostika GmbH (Германия). Содержание маркеров эндотелиальной дисфункции – растворимой формы молекулы межклеточной адгезии (sICAM-I), эндотелина-1, тромбомодулина и фактора Виллебранда определяли методом ИФА с использованием коммерческих тест-систем («sICAM-I» BD, США), «ENDOTELIN (1–21)» фирмы Biomedika (Австрия), «Thrombomodulin» фирмы USCN Life Science (США) и «TECHNOZYM vWFAg ELISA» фирмы Technoclone GmbH (Австрия) соответственно. При постановке исследований использовали стандартные образцы для построения калибровочной кривой и контрольные образцы. Учет результатов анализа проводили инструментально путем измерения оптической плотности на ИФА-анализаторе для микропланшет серии ELx808 производства BioTek Instruments Inc. (США) при длине волны 450 нм. Результаты исследования оценивали в соответствии с рекомендациями производителя. Волчаночный антикоагулянт определяли на коагулометре ACL Elit PRO (Instrumentation Laboratory, Испания) с использованием реактивов фирмы Siemens (Германия).
Статистическую обработку полученных данных проводили при помощи программы STATISTICA Windows 7.0., используя методы непараметрической статистики (критерий Манна-Уитни). Статистически значимыми признавали различия при p<0,05; p<0,01 и p<0,001. Анализ зависимости и силу связи между признаками оценивали по величине непараметрического коэффициента корреляции Спирмена: более 0,7 – сильная, от 0,3 до 0,7 – умеренная, менее 0,3 – слабая.
Результаты
Результаты исследования показали, что аутоантитела у женщин с физиологически протекающей беременностью (n=76) выявлены не были, аутоантитела у женщин с привычным невынашиванием беременности (n=485) были выявлены в 31,7% случаев. Среди них антитела к кардиолипину обнаружены у 14,3% пациентов (n=154), при этом изолированное повышение антител к кардиолипину наблюдалось в 27,3% случаев, в 72,7% это было сочетание с другими видами аутоантител. Антитела к фосфатидилсерину, фосфатидилинозитолу и фосфатидиловой кислоте выявлялись у 7,1% пациентов, изолированного повышения данных аутоантител не наблюдалось, во всех случаях это было сочетание с другими видами аутоантител. Антитела к бета-2 гликопротеину-I выявлялись у 37,1% пациентов: изолированно – в 56,1%, сочетано – в 43,9% случаев. Антитела к аннексину 5 выявлялись у 29,9% пациентов: изолированно – в 71,7%, в сочетании с другими антителами – в 28,3% случаев. Волчаночный антикоагулянт определялся у 42,8% пациентов: изолированно – в 75,7%, сочетано – в 24,3% случаев (рис. 1).
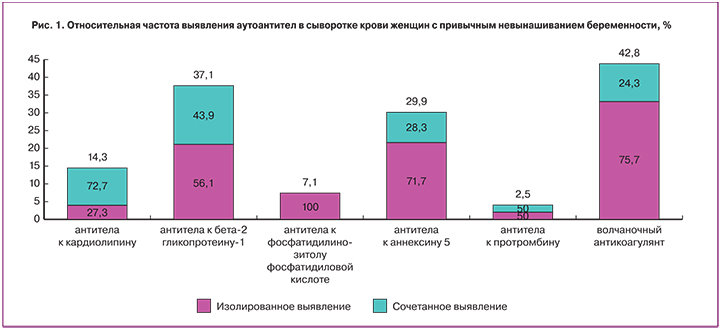
Была проведена оценка сочетаний аутоантител в зависимости от титра. По уровню выявленных аутоантител к кардиолипину и к бета-2 гликопротеину-I женщин с привычным невынашиванием беременности (n=63) разделили на три группы: с низким (10–20 Ед/мл), средним (20–40 Ед/мл) и высоким титром (более 40 Ед/мл) аутоантител. Низкий уровень аутоантител был выявлен у 66,6%, средний – у 20,7%, высокий – у 12,7% пациенток. Было отмечено, что в группе женщин с низким уровнем аутоантител, наряду с антителами к кардиолипину и к бета-2 гликопротеину-I выявлялись антитела к аннексину 5, протромбину, фосфатидилсерину, фосфатидилинозитолу, фосфатидиловой кислоте и волчаночный антикоагулянт – в 30,1% случаев, в группе со средним уровнем аутоантител – в 38,5%, а в группе с высоким уровнем аутоантител – в 75,0% случаев.
Оценка уровня маркеров эндотелиальной дисфункции показала, что содержание тромбомодулина и фактора Виллебранда в периферической крови у женщин с привычным невынашиванием беременности было выше, чем у женщин физиологически протекающей беременностью. При анализе группы женщин с привычным невынашиванием беременности отмечено, что уровень указанных маркеров был выше именно у женщин с выявленными аутоантителами, чем у женщин с привычным невынашиванием беременности без аутоантител (рис. 2). Корреляционная зависимость по Спирмену между антителами к бета-2 гликопротеину-I и тромбомодулином, хотя и выявлялась, однако, носила слабый характер (r=0,47, p<0,05).
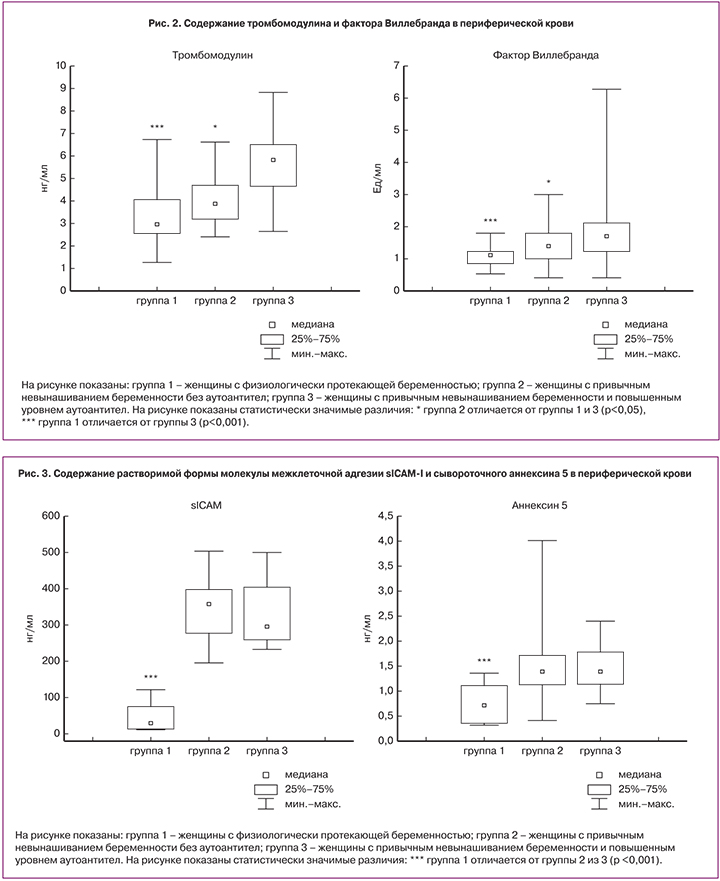
Уровень растворимой формы молекулы межклеточной адгезии (sICAM-I) и сывороточного аннексина 5 в периферической крови у женщин с привычным невынашиванием беременности был выше, чем у женщин с физиологически протекающей беременностью. Достоверных различий в группах женщин с привычным невынашиванием беременности без аутоантител и женщин с привычным невынашиванием беременности с выявленными аутоантителами по уровню sICAM-I и сывороточного аннексина 5 выявлено не было (рис. 3). При исследовании уровня эндотелина-1 в сыворотке периферической крови различий в группах женщин с привычным невынашиванием беременности и женщин с физиологически протекающей беременностью также не определялось.
Обсуждение
АФС, как состояние с различным спектром клинических проявлений, изучается более 35 лет. Но, несмотря на разнообразие накопленных данных о предполагаемой роли антифосфолипидных антител, полученных в экспериментальных моделях [13] и клинических исследованиях [14], до сих пор нет убедительного ответа на вопрос о взаимосвязи между их наличием и невынашиванием беременности [15].
Проведенное нами исследование показало, что аутоантитела у женщин с физиологическим течением беременности не определялись. В то же время у женщин с привычным невынашиванием беременности аутоантитела были выявлены в 31,7% случаях, что показывает очевидное их участие в развитии состояния, приводящего к потере беременности. Среди выявленных аутоантител превалировали волчаночный антикоагулянт и антитела к β2-гликопротеину-I. В низких и средних титрах антифосфолипидные антитела определялись в основном изолированно, тогда как при высоких значениях антифосфолипидных антител наблюдалось их сочетание с другими видами аутоантител в 75% случаях, что может свидетельствовать об активности аутоиммунного процесса в целом. Это требует углубленного обследования таких пациенток и на другие формы аутоиммунной патологии. По данным литературы, у женщин с потерей беременности в анамнезе и выявленными антителами в высоких титрах, следующая беременность в 80% случаях заканчивается гибелью плода [16, 17]. Если антифосфолипидные антитела выявляются в средних титрах, то таким пациенткам при планировании беременности необходимо проведение антитромботической терапии с профилактической целью. Антитела, выявленные в низких титрах считаются сомнительными и клинически незначимыми и рассматриваются только, как факторы риска развития тромбофилических состояний [18], связанных, вероятно, с транзиторной нестабильностью клеточных мембран.
Антителоопосредованное повреждение эндотелиальных клеток является существенным фактором, который участвует в патогенезе тромбозов у пациентов с АФС [19]. При воздействии антифосфолипидных антител на клетки эндотелия происходит гиперэкспрессия клеточных молекул адгезии E-Selectin, ICAM-I, VCAM-I [11], увеличивается секреция ими провоспалительных цитокинов, таких как интерлейкин -1бета и интерлейкин-6. Происходит повышение экспрессии тканевого фактора на эндотелиальных клетках, который является одним из главных инициаторов коагуляционного каскада, приводящий к запуску внешнего пути свертывания крови. Активированные эндотелиальные клетки также экспонируют в больших количествах фактор Виллебранда (который является также маркером повреждения эндотелиальных клеток). Кроме того, происходит слущивание тромбомодулина с клеточной поверхности эндотелия [20, 21]. Эти изменения приводят к повышению свертывающего потенциала крови, увеличивая риск развития тромбозов.
В нашем исследовании показано, что у женщин с привычным невынашиванием беременности концентрация маркеров повреждения эндотелия, таких как тромбомодулин, фактор Виллебранда, растворимая форма молекулы межклеточной адгезии (sICAM-I) и сывороточный аннексин 5, выше, чем у женщин с физиологическим течением беременности. Показано также, что уровень тромбомодулина и фактора Виллебранда выше у женщин с выявленными антифосфолипидными антителами. Выявлена положительная корреляционная связь между антителами к бета-2 гликопротеину-I и тромбомодулином. Данный факт подтверждает то, что антифосфолипидные антитела, связываясь с фосфолипидами мембраны эндотелиальных клеток, инициируют каскад реакций, приводящих к повреждению эндотелия, формированию его прокоагулянтной активности, повышению риска развития тромбообразования, что в итоге ведет к репродуктивным неудачам.
Заключение
Таким образом, результаты исследования продемонстрировали существенную роль аутоантител в развитии патологического состояния коагуляционной системы, приводящего к потере беременности.
Полученные данные дают основание для проведения дополнительных лечебных и диагностических мероприятий, связанных с выявлением аутоиммунной патологии и использованием фармакологических средств, направленных на предотвращение патологического влияния аутоантител, приводящего к преждевременному прерыванию беременности. В комплекс такого рода мероприятий могут входить иммуноглобулины для внутривенного введения, препараты, регулирующие свертывание крови (антиагреганты, низкомолекулярные гепарины) и улучшающие микроциркуляцию.



