Введение
Сердечно-сосудистые события (ССС) остаются ведущей причиной смертности в диализной популяции [1–3]. Прогнозирование риска неблагоприятных клинических исходов, обусловленных в первую очередь сердечно-сосудистыми причинами, необходимо для стратификации риска и разработки персонифицированного подхода к лечению диализных пациентов.
Биомаркеры твердо заняли свое место в диагностике сердечно-сосудистых заболеваний и предикции ССС в общей популяции. Однако использование некоторых биомаркеров на диализе имеет свои особенности и ограничения. Определение сывороточного уровня N-терминального фрагмента прогормона мозгового натрийуретического пептида (NT-proBNP) широко применяется в популяции пациентов, имеющих сердечно-сосудистые заболевания, для диагностики хронической сердечной недостаточности, стратификации риска и контроля терапии [4, 5]. В настоящее время нет рекомендаций по использованию NT-proBNP для прогнозирования развития ССС и оценки сердечно-сосудистого риска на программном гемодиализе (ПГД). В то же время NT-proBNP демонстрирует хорошую прогностическую ценность на ПГД [6], но его использование ограничено по ряду причин. Главная из них – колебания концентрации прогормона в широких пределах у пациентов, получающих программную экстракорпоральную терапию [6–9].
За последние годы возрастает клиническая значимость маркера ST2 (Growth Stimulation expressed gene 2 – стимулирующий фактор роста) – члена суперсемейства рецепторов интерлейкина-1. ST2 – маркер фиброза и гипертрофии/ремоделирования сердца, секретируемый кардиомиоцитами и фибробластами, который возможно определить в сыворотке крови в виде растворимой изоформы soluble ST2 (sST2) [10]. Отмечаются незначительные индивидуальные колебания уровня sST2 при исследовании в динамике по сравнению с концентрацией NT-proBNP. В когортном исследовании 879 пациентов с сердечной недостаточностью не выявлено корреляции между уровнем sST2 и почечной функцией в отличие от NT-proBNP, концентрация которого существенно повышалась по мере снижения функции почек [8]. Имеются данные, свидетельствующие, что выведение sST2 ограничено даже при проведении диализа с использованием высокопоточных мембран [4]. Таким образом, sST2 – более стабильный биомаркер, уровень которого варьируется в незначительных пределах.
С учетом значительной вариабельности уровня NT-proBNP и незначительных колебаний концентрации sST2 в диализной популяции использование комбинации двух биомаркеров может повысить качество предикции ССС у пациентов, получающих ПГД методом «on-line» гемодиафильтрации (ГДФ).
Цель исследования – оценить возможность определения сывороточных уровней NT-proBNP и sST2 для прогнозирования CCС у пациентов, получающих ПГД методом «on-line» ГДФ.
Материал и методы
В течение 16 месяцев проспективного исследования под наблюдением находились 43 пациента (60,5% мужчин), получавших «on-line» ГДФ на аппарате искусственной почки с использованием бикарбонатного диализирующего раствора и высокопоточных диализаторов. Пациентам проводился адекватный диализ: 3 дня в неделю, не менее 4 часов эффективного времени, фактическая доза диализа за сеанс ГДФ, по данным «on-line» Clearance Monitor (OCM), Kt/V>1,4; недельный объем замещающего раствора >63 л/нед. Все пациенты с начала исследования получали стабильную комплексную медикаментозную терапию в рамках внедрения клинико-статистических групп как метода оплаты стационарной помощи. В качестве сосудистого доступа всеми пациентами использовалась артериовенозная фистула.
Пациенты соответствовали критериям включения в исследование (возраст старше 18 лет, подписанное информированное согласие на участие в исследовании) и не имели критериев исключения из исследования: неудовлетворительная визуализация сердца при проведении трансторакальной эхокардиографии, клапанные пороки сердца (врожденные и/или приобретенные до начала заместительной почечной терапии), инфекционные заболевания (вирус иммунодефицита человека, гепатиты В и С, сепсис, инфекционный эндокардит, туберкулез и т.п.) или хронические заболевания в фазе обострения (язвенная болезнь, холецистит и т.п.), хроническая обструктивная болезнь легких, онкологические, лимфопролиферативные заболевания, в т.ч. в анамнезе.
Всем участникам ежемесячно проводились стандартные клинико-биохимические исследования. С учетом лабильности показателей на ПГД при статистической обработке использовались средние значения лабораторных показателей и дозы диализа для каждого пациента за период наблюдения. На момент включения в исследование на 2-е сутки после процедуры ГДФ определены сывороточные уровни NT-proBNP (пг/мл) и sST2 рецептора (нг/мл) методом иммуноферментного анализа. В междиализный промежуток у пациентов определяли стандартные эхокардиографические показатели при проведении трансторакальной эхокардиографии и гидратационный статус методом биоимпедансометрии, проводимой в день забора крови для определения NT-proBNP и sST2.
Статистическая обработка материала осуществлялась с использованием пакета программ IBM SPSS Statistics 23. Для описания нормально распределенных количественных признаков использовали среднее значение признака и среднее квадратичное отклонение (M±SD); для описания признаков, распределение которых отличается от нормального, указаны медиана, нижний и верхний квартили (Med; 25–75%). Связи между признаками оценивали с использованием непараметрического метода ранговых корреляций Спирмена. Для оценки различий количественных признаков в нескольких независимых группах использован критерий Краскела–Уолиса. При сопоставлении количественных показателей в одной и той же группе пациентов в динамике при наличии двух разных условий применен критерий Вилкоксона. При сравнении нескольких независимых групп с суммарным числом наблюдений менее 20 частота встречаемости признака указана в процентах (%). Кумулятивная частота ССС за период наблюдения в зависимости от наличия повышения одновременно двух биомаркеров (NTproBNP≥2093 пг/мл и sST2≥22 пг/мл) оценивалась с помощью построения кривых Каплана–Мейера. Статистически значимыми приняты различия при р<0,05. Тенденцию к различию рассматривали при 0,05<p<0,1.
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Проведение исследования одобрено Этическим комитетом ФГБОУ ВО «Саратовский ГМУ им. В.И. Разумовского» Минздрава РФ.
Результаты
Общая характеристика пациентов, получавших «on-line» ГДФ, представлена в таблице.
В ходе корреляционного анализа обнаружены связи между уровнями sST2 и NT-proBNP (r=0,385; p=0,01), недельным временем диализа (r=-0,334; p=0,03), конечным систолическим размером левого желудочка (ЛЖ) (r=0,367; p=0,02). Уровень NT-proBNP коррелировал с объемом замещающего раствора (r=-0,5; p=0,002) и ферритином (r=0,3; p=0,04).
В группе пациентов с одновременным превышением установленных уровней двух биомаркеров оказались выше процент додиализной гипергидратации и как следствие – скорость ультрафильтрации во время процедуры ГДФ; больше величина индекса массы миокарда левого желудочка (ИММ ЛЖ). У пациентов с повышением обоих биомаркеров был меньше недельный объем замещающего раствора, большие объемы которого, возможно, имеют «кардиопротективный» эффект (см. таблицу).
В процессе наблюдения у 11 (25,6%) из 43 пациентов развились ССС. Повторно развившихся ССС у одного и того же пациента за период наблюдения не выявлено. Структура нефатальных ССС: нарушения ритма и проводимости – 3 пациента, нестабильная стенокардия – 3, инфаркт миокарда – 1 пациент. У 4 пациентов зарегистрированы фатальные ССС: в 3 случаях причиной летального исхода послужил инфаркт миокарда, у 1 пациента – внезапная сердечная смерть.
Медиана сывороточного уровня NT-proBNP на момент начала наблюдения составила 1808 (757–2580) пг/мл. В ранее проведенном исследовании [11] установлено, что уровень NT-proBNP выше 2093 пг/мл может использоваться для прогнозирования ССС в диализной популяции. Прогностический уровень sST2 на диализе не установлен [4], в связи с чем определено среднее значение sST2 в нашей популяции 22±5,9 нг/мл.
Частота развития ССС была существенно выше у пациентов с уровнем NT-proBNP выше 2093 пг/мл (Log-Rank test; p=0,01). В то же время частота ССС не менялась в зависимости от уровня sST2 выше и ниже 22 нг/мл (p>0,05).
Через 16 месяцев от начала исследования повторно определены уровни NT-proBNP и sST2. При этом отмечено существенное снижение уровня прогормона через 16 месяцев от первой точки 646 (13–1800) пг/мл (p=0,03) и не выявлено существенного изменения уровня sST2 (p>0,05). Среднее значение sST2 при определении через 16 месяцев составило 22±8,5 нг/мл.
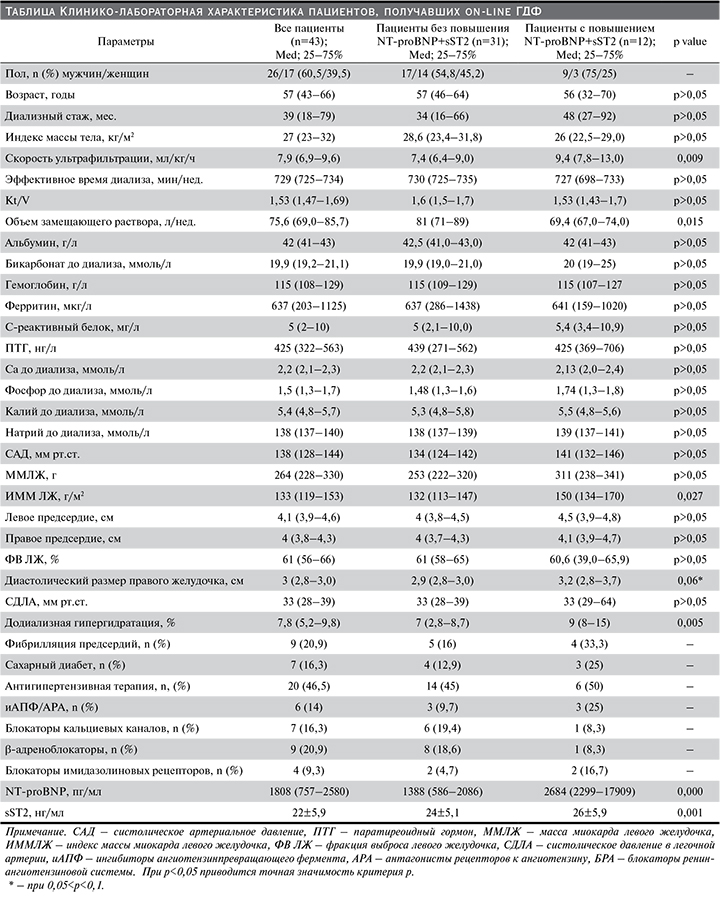
Для оценки возможности прогнозирования ССС на ПГД с помощью комбинации NT-proBNP и sST2 выделено две группы пациентов в зависимости от наличия одновременного повышения двух маркеров выше указанных значений. В группе пациентов с одновременным повышением двух биомаркеров (n=12) ССС зафиксированы у 6 (50%) больных, среди пациентов без повышения NT-proBNP+sST2 (n=31) ССС выявлены у 5 (16,1%) больных (рис. 1).
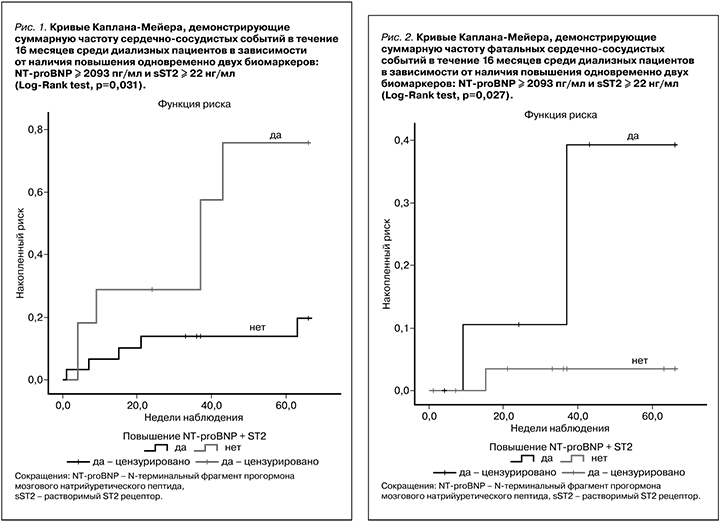
В целом частота развития ССС существенно выше у пациентов с повышением двух биомаркеров, как и частота развития фатальных ССС: среди пациентов с повышением уровней NT-proBNP и sST2 произошло 3 (25%) фатальных ССС, у пациентов без повышения NT-proBNP+sST2 зафиксирован 1 (3,2%) неблагоприятный исход (рис. 2).
Обсуждение
Наличие обратной связи между уровнем sST2 и таким параметром адекватности процедуры ГДФ, как эффективное время, сокращение которого связано с неблагоприятным прогнозом на ПГД, и прямой взаимосвязи с таким параметром ремоделирования миокарда, как конечный систолический размер ЛЖ, подтверждает возможность использования уровня sST2 для оценки риска развития ССС. Отрицательная связь между уровнем NT-proBNP и объемом замещающего раствора свидетельствует о потенциальном кардиопротективном эффекте данного параметра адекватности процедуры ГДФ, а прямая корреляция с ферритином свидетельствует, что прогормон наряду с ферритином является провоспалительным пептидом и, соответственно, отражает риск неблагоприятного исхода.
Гипергидратация и гипертрофия ЛЖ, а также меньшее значение недельного объема замещения служат фактором неблагоприятного прогноза на ПГД, а частота их встречаемости оказалась выше у пациентов с повышением NT-proBNP+sST2. Таким образом, полученные данные свидетельствуют в пользу предположения, согласно которому повышение установленных уровней биомаркеров (уровень NT-proBNP≥2098 пг/мл и sST2≥22 нг/мл) может быть прогностически неблагоприятным фактором.
В ходе исследования получено подтверждение высокой вариабельности уровня NT-proBNP и продемонстрирована относительная стабильность сывороточного уровня sST2. Несмотря на то что NT-proBNP продемонстрировал хорошую прогностическую ценность в отличие от sST2, использование прогормона для предикции ССС ограничено ввиду существенных колебаний его уровня при исследовании в динамике и, возможно, в долгосрочном периоде. Применение биомаркерной стратегии предикции ССС с использованием комбинации двух биомаркеров (NT-proBNP+sST2) позволяет нивелировать недостатки каждого из них, повышать прогностическую точность модели и в перспективе влиять на выбор лечебной тактики.
Заключение
Для предикции ССС в отношении пациентов, получающих ПГД методом «on-line» ГДФ, целесообразно использовать комбинацию биомаркеров (NT-proBNP+sST2). Пациентов, имеющих сывороточный уровень NT-proBNP≥2098 пг/мл в сочетании с уровнем sST2≥22 нг/мл, следует относить к группе высокого риска развития ССС.
Ограничения
Исследование проведено на небольшой выборке пациентов, взятых под наблюдение на разных сроках программной диализной терапии. Следует проявлять осторожность при экстраполяции полученных в настоящем исследовании результатов на пациентов других диализных популяций.



