Эндометриоз является одной из наиболее актуальных проблем современной медицины. Широкая распространенность эндометриоза, а также высокая (до 50%) частота встречаемости у женщин репродуктивного возраста обуславливают интерес врачей к его изучению и поиску эффективных методов лечения [1]. В основе причин развития эндометриоза лежит множество фундаментальных биологических механизмов, однако до конца этот вопрос не изучен [2]. Воспаление, изменения гормонального фона, гормональных рецепторов, генетические и эпигенетические факторы являются предпосылками для развития эндометриоидного процесса [3–6]. Многофакторность течения эндометриоза осложняет поиск эффективных методов терапии [2].
Особое место в развитии эндометриоза играют процессы снижения апоптоза, пролиферации, инвазии и неоангиогенеза. Течение заболевания и клинические проявления напрямую зависят от происходящих молекулярных процессов [7].
Принимая во внимание пролиферативные, а также инвазивные процессы, наблюдаемые при эндометриоидных поражениях, особое внимание стоит уделить изучению фармакологических соединений негормонального происхождения, влияющих на несколько патогенетических звеньев эндометриоза: нормализацию баланса эстрогенов, патологическую клеточную пролиферацию, ингибирование неоангиогенеза, а также способность стимулировать избирательный апоптоз клеток [8]. Одним из таких терапевтических средств является индол-3-карбинол.
Индол-3-карбинол (И3К) – хорошо известная молекула растительного происхождения, обладающая широким спектром биологической активности в отношении активно пролиферирующих клеток млекопитающих. Особый интерес представляет противоопухолевая активность И3К, которая детально исследована на различных экспериментальных моделях, что послужило основанием для включения этой молекулы в перечень соединений для лекарственной профилактики злокачественных новообразований различной локализации [9].
Так, в исследовании И3К при раке молочной железы отмечена высокая эффективность терапии при совместном применении с тамоксифеном, вне зависимости от эстрогенового статуса заболевания. Благодаря воздействию на различные сигнальные пути достигается синергетический эффект терапии [10]. Выраженный терапевтический потенциал И3К обусловлен его мультифакторным действием в отношении пролиферирующих клеток. В частности, И3К ингибирует основные сигнальные пути, поддерживающие агрессивное клеточное деление [11], индуцирует апоптоз клеток, находящихся в состоянии метаболического стресса, ингибирует патологический ангиогенез [12, 13], обладает эпигенетической активностью, модулируя экспрессию гистондеацетилаз, ДНК-метилтрансфераз и синтез микроРНК в клетках-мишенях [14–16]. На системном уровне И3К регулирует метаболизм эстрогенов, восстанавливая физиологическое соотношение 16-альфа и 2-гидроксиметаболитов, нормализуя, таким образом, клеточное деление в гормончувствительных тканях женской репродуктивной системы [9].
Следует отметить, что И3К склонен к олигомеризации и под воздействием кислой среды желудка быстро превращается в дииндолилметан (DIM). Некоторые авторы приписывают терапевтические эффекты И3К именно DIM, как продукту его биоконверсии [17].
Следует особо отметить тот факт, что для DIM убедительно доказана способность ингибировать активность гипоксия-индуцибельного фактора (HIF)-1a, который, наряду с сосудисто-эндотелиальным фактором роста (VEGF), является ключевой молекулярной мишенью, участвующей в патологическом росте новых сосудов. Показано, что in vitro в опухолевых клетках, находящихся в условиях гипоксии, в присутствии DIM снижается уровень HIF-1a, а также его транскрипционная активность. Более того, DIM подавлял экспрессию HIF-1a-респонсивных эндогенных генов, что приводило к ингибированию экспрессии ключевых гипоксия-респонсивных факторов, таких как фактор VEGF, енолаза-1, глюкозный транспортер-1, фосфофруктокиназа и др. Уменьшение уровня HIF-1a в гипоксичных опухолевых клетках сопровождалось увеличением скорости его ферментативной и протеосомной деградации, а также снижением скорости генной транскрипции [18].
Все перечисленные механизмы действия И3К и DIM с высокой вероятностью могут быть реализованы и в лечении эндометриоза, исходя из современных представлений о его патогенезе [19]. На основе И3К разработано и зарегистрировано лекарственное средство для лечения гиперпластических процессов в молочной железе [20]. Вышеперечисленными факторами была продиктована цель данного исследования, в котором изучался терапевтический эффект И3К на экспериментальной модели эндометриоза.
Целью нашего исследования явилось изучение фармакологической активности лекарственного средства с действующим веществом индолкарбинол на модели эндометриоза у крыс.
Данное исследование направлено на изучение возможности применения препарата для лечения эндометриоза, а также болевого синдрома, вызванного данной патологией.
Исследуемые препараты
В качестве тестируемого использовали препарат производства АО «МираксБиоФарма», содержащий в качестве активного вещества субстанцию индолкарбинол (И3К) по 200 мг в капсуле, контрольный препарат – 1% раствор крахмала.
Животные и их содержание
Для проведения эксперимента использованы 60 самок аутбредных крыс, полученных из питомника АО «НПО «Дом Фармации», г. Санкт-Петербург. Животных содержали в стандартных условиях в соответствии с правилами надлежащей лабораторной практики, в стандартных прозрачных пластиковых клетках, группами по 6 особей одного пола, со свободным доступом к корму и воде.
Животных содержали в контролируемых условиях окружающей среды (19–25°C и относительной влажности воздуха 30–70%). Световой режим составил 12 ч света и 12 ч темноты. Был установлен режим воздухообмена, обеспечивающий смену около 15 объемов помещения в час.
Этическое сопровождение
Исследование рассмотрено на биоэтической комиссии АО «НПО «Дом Фармации» и одобрено для проведения № БЭК 4.61/17 от 06 октября 2017 г.
Материалы и методы
Перед началом исследования животные случайным образом были распределены на 5 групп, по 12 особей в каждой группе. Животным 1-й и 2-й групп была проведена ложная операция, в ходе которой выполнялись разрез брюшной стенки, экспозиция рога матки (в течение 2 мин), послойное ушивание раны, обработка шва антисептиком. Животные группы 1 получали 1% раствор крахмала, животные группы 2 получали активный препарат в дозировке 111 мг/кг в сутки. Животным групп 3, 4, 5 выполнялось оперативное вмешательство с моделированием эндометриоза путем аутологичной трансплантации эндометриальной ткани в брюшную полость. В группе 3 животные получали 1% раствор крахмала, в группе 4 – активный препарат в дозировке 37 мг/кг в сутки, животные группы 5 получали активный препарат в дозировке 111 мг/кг в сутки. Терапия началась после выхода животных из наркоза. В послеоперационном периоде для облегчения болевого синдрома животным внутримышечно вводили Кетонал в дозе 5 мг/кг, 1 раз в день, 5 дней [21].
Курс терапии для 50% животных составил 30 дней, для 50% – 60 дней. Препарат или контрольное вещество вводили ежедневно, один раз в день, внутрижелудочно.
Болевую чувствительность оценивали через 2, 4 и 8 недель от начала терапии по давлению (в граммах), необходимому для индукции болевой реакции (отдергивание/избегание) при приложении датчика к брюшной стенке. Давление на брюшную стенку осуществлялось с помощью электронного анальгезиметра (Electronic von Frey anesthesiometer, IITC Inc., Life Science Instruments, Woodland Hills, CA, USA). Проводили пять повторных измерений с интервалом 5 с. При анализе данных рассчитывали среднее за 5 измерений.
На 30-й и на 60-й день терапии осуществляли эвтаназию животных с помощью СО2‑камеры, без учета эстрального цикла. Эвтаназированные животные подвергались вскрытию, с последующей морфометрической оценкой размера имплантата: проводили измерение длины, ширины, высоты и площади очага эндометриоза, а далее определяли объем образования. Выделенные имплантаты с прилегающей тканью и интактный рог матки фиксировали в 10% формалине для последующего гистологического исследования.
Гистологические признаки эндометриоза оценивались по следующим критериям полуколичественной балльной оценки:
- выраженность кисты: 0 – отсутствие кисты; 1 – незначительная киста; 2 – киста умеренной степени выраженности; 3 – крупная киста;
- воспалительная инфильтрация: 0 – отсутствие; 1 – незначительная; 2 – умеренная; 3 – выраженная;
- васкуляризация: 0 – отсутствие; 1 – незначительная; 2 – умеренная; 3 – выраженная;
- наличие железистых структур: 0 – отсутствие; 1 – небольшое количество желез; 2 – умеренное количество желез; 3 – значительное количество желез;
- тип эпителия: 0 – отсутствие эпителия; 1 – плохо сохранившийся эпителиальный слой; клетки небольшие, уплощенной формы; 2 – умеренно сохранившийся эпителиальный слой, преобладают клетки кубической формы; 3 – хорошо сохранившийся эпителиальный слой; клетки крупные, призматической формы;
- гиперплазия эндометрия/внутренней стенки эндометриоидного очага: 0 – отсутствие; 1 – незначительная; 2 – умеренная; 3 – выраженная.
Статистический анализ
С помощью программного обеспечения Statistica 10.0. (StatSoft, США) выполнялся анализ полученных данных. Использованы непараметрические критерии для оценки показателей.
Морфометрическая характеристика эндометриоза представлена в работе в виде среднего арифметического (М) и стандартного отклонения (SD). Тип данных – количественные, распределение не соответствует нормальному. Парное сравнение групп проводилось с помощью критерия Манна–Уитни (уровень значимости p<0,05).
Показатели гистологической оценки в баллах анализировались с помощью рангового анализа вариаций по Краскелу–Уоллису. Данные представлены в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3). Статистически значимые различия между группами оценивались процедурами апостериорного сравнения с помощью критерия Манна–Уитни (уровень значимости p<0,05).
Результаты
Гибель животных в экспериментальных группах в ходе исследования не зарегистрирована.
Результаты, полученные при проведении оценки висцеральной болевой чувствительности, показали, что в группе с индуцированной патологией болевая реакция в ответ на механическое воздействие была значимо выше, чем у ложнооперированных животных: крысы реагировали на меньшее давление. Терапия уже через 4 недели привела к снижению выраженности болевой реакции, эффект наблюдался в обеих группах, получавших препарат, но статистической значимости достиг только в группе, получавшей препарат в максимальной дозе 111 мг/кг (p<0,05). При анализе данных, полученных через 8 недель терапии, получены схожие результаты, с той разницей, что уже при использовании минимальной исследованной дозы 37 мг/кг наблюдался статистически значимый обезболивающий эффект.
Таким образом, в группе животных с индуцированной патологией, не получавших лечения, на всем протяжении эксперимента наблюдалась более выраженная болевая реакция по сравнению с ложнооперированными животными. На фоне терапии исследуемым препаратом уже через две недели лечения у животных, получавших препарат в максимальной дозе, болевая чувствительность не отличалась от показателей животных ложнооперированных групп. Через 4 и 8 недель терапии обезболивающий эффект отмечен у всех групп животных с индуцированной патологией, получавших активный препарат.
Данные патоморфологического исследования
Патологоанатомическому и гистологическому исследованию были подвергнуты интактный рог матки и участок брюшины с имплантатом (очаг эндометриоза). Патологоанатомическое исследование включало в себя макроскопическую оценку эндометриоза с морфометрией.
При гистологическом исследовании состояние эндометрия интактного рога матки и степень развития эндометриоза оценивали полуколичественно в баллах, от 0 до 3: где 0 – отсутствие изменений; 1 – незначительные изменения; 2 – умеренные изменения; 3 – выраженные изменения.
Оценка состояния эндометрия интактного рога матки экспериментальных животных
При патологоанатомическом исследовании маток ложнооперированных крыс патологических изменений не выявлено. У крыс, получавших тестируемый препарат в дозе 111 мг/кг, при макроскопическом исследовании отмечалось уменьшение толщины рогов матки и степени полнокровия органа, что было особенно заметно на 60-й день эксперимента.
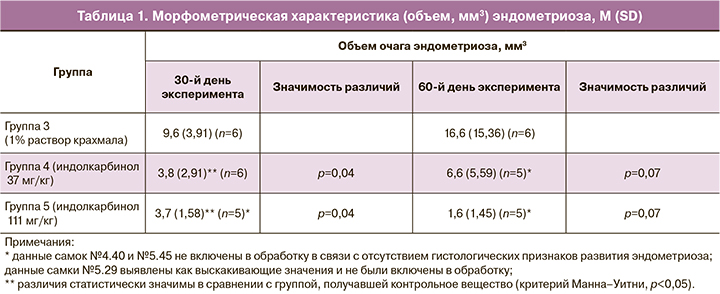
Гистологическое строение эндометрия интактного рога матки животных с индукцией патологии также соответствовало норме. Эндометрий представлен однослойным призматическим мерцательным эпителием, состоящим из секреторных и реснитчатых клеток и собственной пластинки, образованной рыхлой соединительной тканью, содержащей многочисленные маточные железы. На фоне применения активного препарата на 30-й день эксперимента у группы ложнооперированных животных, получавших активный препарат в дозе 111 мг/кг (группа 2), отмечалось значительное снижение степени пролиферации эндометрия, что проявлялось в уменьшении количества железистых структур, снижении высоты эпителия и степени гиперплазии эндометрия (рис. 1) по сравнению с ложнооперированными животными, получавшими контрольное вещество (группа 1) (рис. 2). На 60-й день эксперимента сохранялась такая же тенденция, но признаки снижения пролиферации эндометрия у ложнооперированных животных, получавших активный препарат в дозе 111 мг/кг, были менее выражены.
Оценка развития эндометриоидных гетеротопий
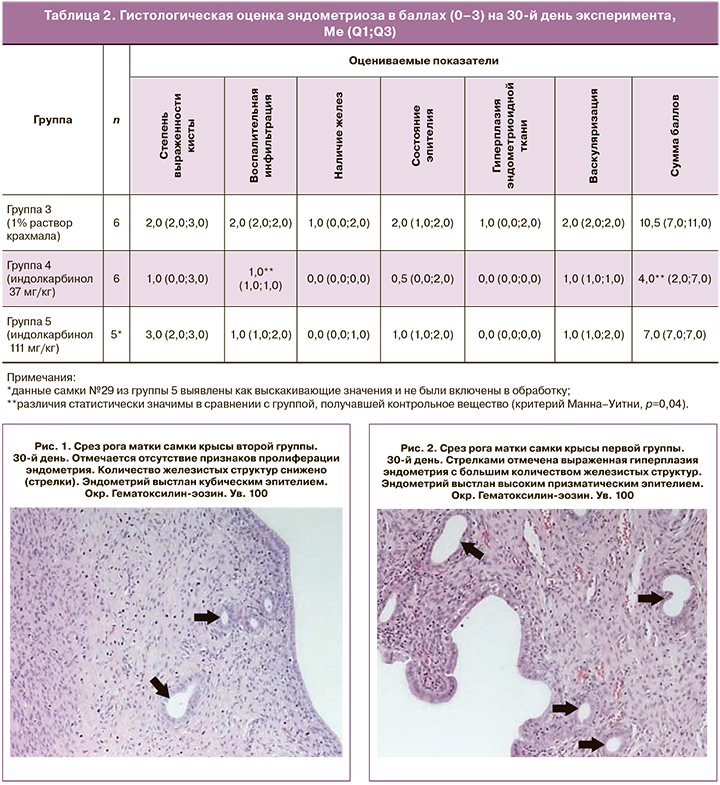
При макроскопическом исследовании самок крыс экспериментальных групп с индукцией патологии у большинства животных отмечались успешное разрастание гетеротопии и образование кист разного размера на месте имплантатов. Размеры кист варьировали в пределах 2–4×2–6×2–10 мм, превышая исходные размеры имплантатов. Четко визуализировалась густая сосудистая сеть.
Морфометрическая характеристика очагов эндометриоза приведена в таблице 1.
У животных, получавших активный препарат, отмечалось статистически значимое снижение объемов эндометриоза на 30-й день эксперимента (p<0,05). На 60-й день также отмечалась тенденция к снижению объема очага эндометриоза в группах, получавших тестируемый препарат, но не достигшая статистической значимости (р=0,07). В целом результаты морфометрии свидетельствуют о наличии терапевтического эффекта препарата в отношении снижения объема эндометриоидного очага как через 30, так и через 60 дней после начала терапии.
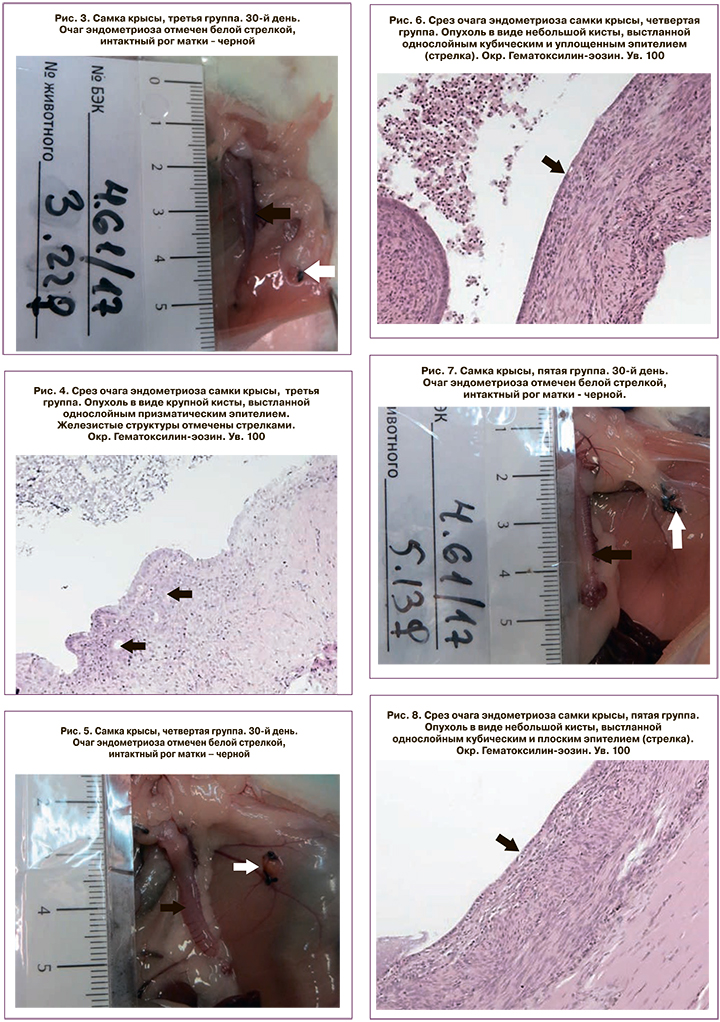
Гистологически очаги эндометриоза в большинстве случаев характеризовались кистозным строением. Отмечалась разной степени выраженности мононуклеарная инфильтрация с преобладанием лимфоцитов, макрофагов и гистиоцитарных клеток. Стенка кист была образована соединительнотканными элементами с небольшим количеством слабо дифференцированных миофибробластоподобных клеток. В некоторых случаях выявлялась гиперплазия внутренней стенки эндометриоидного очага. Содержимое кист представлено неструктурированным слабобазофильным компонентом с небольшим количеством мононуклеаров и десквамированных эпителиальных клеток. В стенке кисты также выявлялись немногочисленные железистые структуры по типу трубчатых желез эндометрия. Внутренняя стенка эндометриоидного очага была выстлана однослойным эпителием различной степени сохранности и дифференцировки. У самок, получавших контрольное вещество, преобладал призматический эпителий, схожий по строению с эутопическим эпителием эндометрия интактного рога матки (рис. 3 и 4). У животных, получавших активный препарат в дозах 37 мг/кг и 111 мг/кг, отмечалось заметное снижение высоты эпителия, в большинстве случаев кисты были выстланы плохо сохранившимся уплощенным эпителием, практически не наблюдалась гиперплазия стенки кисты, отмечалось значительное снижение объемов и степени васкуляризации эндометриоидного очага (рис. 5–8).
В некоторых случаях отмечались признаки полной резорбции эндометриоза с выявлением в небольших количествах слабодифференцированных клеток, а также элементов рыхлой соединительной и грануляционной ткани в месте прикрепления импланта, что чаще наблюдалось у животных, получавших индолкарбинол в дозах 37 мг/кг и 111 мг/кг на 60-й день эксперимента.
Данные по гистологической оценке эндометриоидных гетеротопий в баллах (0–3) приведены в таблице 2. Успешность формирования патологии и эффективность лечения оценивались в баллах, по состоянию эпителиального слоя эндометрия имплантов по модифицированной шкале Keenan [22]:
- 0 баллов – отсутствие эпителиальных клеток;
- 1 балл – единичные эпителиальные клетки;
- 2 балла – умеренно выраженный эпителиальный слой;
- 3 балла – хорошо выраженный эпителиальный слой.
При межгрупповом сравнении установлено статистически значимое снижение баллов по данным показателям в группе самок крыс, получавших индолкарбинол в дозе 37 мг/кг, по отношению к группе животных, получавших контрольное вещество (р<0,05, см. табл. 2).
На 60-й день эксперимента при межгрупповом сравнении установлено статистически значимое снижение баллов по оцениваемым показателям в группе животных, получавших индолкарбинол в дозе 111 мг/кг, по отношению к группе получавших контрольное вещество.
Таким образом, по результатам гистологической оценки интактного рога матки выявлена тенденция к снижению степени гиперплазии эндометрия в группах самок, получавших активный препарат, по сравнению с контрольными группами.
Результаты морфометрии эндометриоидных очагов свидетельствуют о наличии терапевтического эффекта индолкарбинола при введении в дозах 37 мг/кг и 111 мг/кг: снижение объема эндометриоидного очага отмечалось как через 30, так и через 60 дней после начала терапии. Терапевтическая эффективность препарата также подтверждается результатами гистологической оценки эндометриоидных гетеротопий: сумма баллов по оцениваемым показателям была меньше в группах, получавших терапию.
Обсуждение
Эндометриоз является многофакторным заболеванием. Сегодня в основе его консервативного лечения лежит длительная гормональная терапия, которая предотвращает дальнейшее его развитие за счет снижения влияния эстрогенов. Применяются для этой цели комбинированные синтетические эстроген-гестагенные препараты, прогестины, препараты без эстрогенного компонента, антигестагены, антигонадотропины, агонисты гонадотропин-рилизинг-гормона, антиэстрогены, ингибиторы ароматазы [23].
Поскольку эстрогены являются ключевыми факторами поддержания гомеостаза эндометрия, любое нарушение процесса синтеза и метаболизма эстрогенов ведет к развитию патологических изменений эндометрия. Изменения функциональной активности эстрогеновых рецепторов β (ЭР)β рассматриваются как важное звено патогенеза эндометриоза. Показано, что при эндометриозе, независимо от локализации гетеротопии (яичники или брюшная полость), наблюдается увеличение экспрессии ЭРβ [24]. Поэтому одним из возможных механизмов терапевтической активности препарата может быть его антиэстрогеновое действие [25].
Известно, что, кроме антиэстрогенового эффекта, индолкарбинол обладает антипролиферативным действием. Показана эффективность применения И3К (действующего вещества препарата) для профилактики рака молочной железы, рака тела и шейки матки [26, 27]. Развитие очагов эндометриоза связано с функционированием системы инсулиноподобных факторов роста, индуцирующих пролиферативную активность клеток [28, 29]. В очагах эндометриоза любой локализации отмечается высокая экспрессия инсулиноподобных факторов роста (IGF1 и IGF2). С использованием культур различных линий раковых клеток установлено, что И3К снижает пролиферативную активность путем подавления различных звеньев каскадов внутриклеточных посредников, в том числе IGF [30—32]. Антипролиферативное действие И3К также может быть одним из ведущих факторов, обуславливающих эффективность препарата, выявленную на модели развития эндометриоза у крыс. Однако определение точных механизмов, опосредующих выявленную терапевтическую активность препарата, требует дальнейшего изучения.
Заключение
Таким образом, проведенное исследование показало, что индолкарбинол при введении животным в двух дозах (37 мг/кг и 111 мг/кг) эффективно снижал размер очага эндометриоза, а также выраженность эндометриоидных гетеротопий. За счет уменьшения объемов патологической ткани у животных наблюдалось также снижение болевого синдрома, вызванного эндометриозом.



