Введение
В 2008 г. была предложена первая классификация кардио-ренальных синдромов (КРС) с выделением пяти типов: I тип – острый КРС (острый коронарный синдром, или острая сердечная недостаточность – ОСН, приводящие к острому повреждению почек – ОПП), II тип – хронический КРС (хроническая сердечная недостаточность – ХСН, приводящая к хронической болезни почек – ХБП), III тип – острый ренокардиальный синдром (ОПП, приводящее к ОСН), IV тип – хронический ренокардиальный синдром (ХБП, приводящая к ХСН), V тип – вторичный КРС. Для каждого из них характерен свой патогенез [1].
В 2021 г. Y. Zhang et al . опубликовали новую классификацию КРС с выделением шести типов [2]. Вторичный КРС разделен на острый (V тип) и хронический (VI тип). При V типе КРС острое системное заболевание (сепсис, острая интоксикация) приводит к ОСН и ОПП. При VI типе КРС хронический системный процесс (сахарный диабет, артериальная гипертензия, ожирение, дислипидемия, амилоидоз, цирроз печени, системная красная волчанка и др.) приводит к ХСН и ХБП.
Активация ренин-ангиотензин-альдостероновой системы (РААС), воспаление, окислительный стресс и дисфункция эндотелия сосудов при VI типе вторичного КРС приводят к формированию фиброза, связанного с повреждением тканей. Фиброз рассматривается в первую очередь как защитный механизм компенсации внешнего повреждения системных состояний, но в конечном итоге он вызывает дилатацию полостей сердца и ХСН, потерю нефронов и снижение скорости клубочковой фильтрации (СКФ), а именно КРС VI типа [2]. VI тип вторичного КРС может быть следствием гемохроматоза.
Гемохроматоз
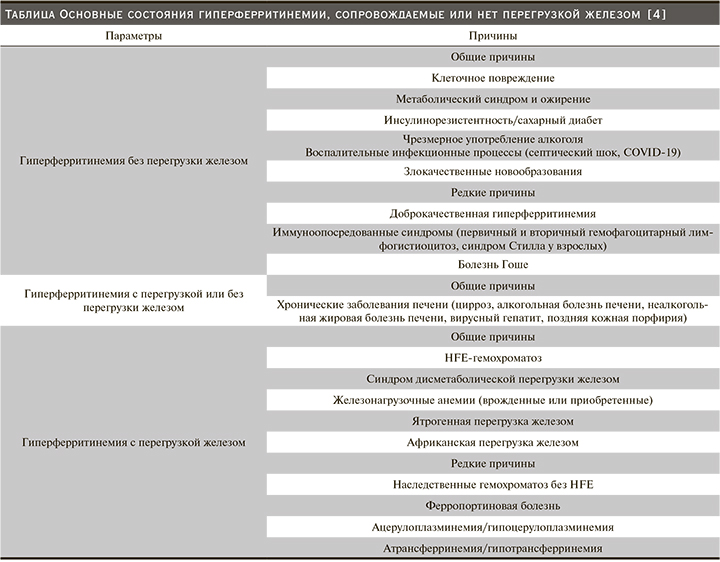
Гемохроматоз (МКБ 10: E83.1) – состояние, характеризующееся избыточным накоплением железа в органах и тканях, что сопровождается нарушениями структуры и функций печени, сердца, поджелудочной железы и других органов эндокринной системы, почек [3]. Распространенность наследственного гемохроматоза (НГ) варьируется от 1:250 до 1:3300. Гомозиготная мутация гена HFE (ген, кодирующий структуру белка НГ 1-го типа) регистрируется в 10 раз чаще (у 1 из 500 обследованных), чем число клинически верифицированных случаев НГ (1:5000). Таким образом, зачастую заболевание диагностируют поздно – на стадии необратимого поражения внутренних органов (цирроз печени, сахарный диабет, дилатационная кардиомиопатия – КМП, почечная недостаточность) [3–4].
Перегрузка железом, вызывающая гемохроматоз, может происходить различными способами: массивное пероральное потребление железа, повышенная абсорбция железа при нормальном его потреблении [3]. Длительное парентеральное введение железа или переливание эритроцитарной массы пациентам при хронической анемии также могут приводить к перегрузке железом. Отложение железа в тканях становится значимым при переливании более 40 единиц гемотрансфузий [3–4].
По A. Andrew et al. (2000), выделяют первичный (наследственный) и вторичный (приобретенный) гемохроматоз [3–7]. Вторичная перегрузка железом (вторичные гемохроматозы – ВГ и гемосидерозы): анемии, сопровождаемые перегрузкой железом (связанные с массивным неэффективным эритропоэзом, рефрактерные гипопластические анемии, например, при ХБП); заболевания, протекающие с умеренной перегрузкой железом (хронические болезни печени, врожденная атрансферринемия, поздняя кожная порфирия; местная перегрузка железом: легочная – идиопатический легочной сидероз, почечная – пароксизмальная ночная гемоглобинурия, серповидно-клеточная анемия, состояния типа «гемолитическая почка», синоним гиперферритинемии с катарактой глаз), другие виды перегрузки железом; ацерулоплазминемия.
Диагностируют гемохроматоз с использованием уровней таких лабораторных показателей, как сывороточное железо, ферритин (более 1000 мкг/л в отсутствие воспалительного, деструктивного и опухолевого процесса, см. таблицу), трансферрин и общая железосвязывающая способность, коэффициент насыщения трансферрина железом (более 60%), повышенная экскреция железа с мочой и морфологические критерии (число сидеробластов в костном мозге, отложение гемосидерина в тканях, содержание железа в печени) [3–4].
Поражение сердца при перегрузке железом
Частота поражения сердца, по данным авторов, вариабельна и зависит от вида гемохроматоза (первичный или вторичный) с большей частотой при НГ: от 0,9–3,1% [8–9] до 20–30% и более [10]. Пациенты мужского пола и больные с повышенным уровнем ферритина в сыворотке подвержены более высокому риску ХСН (10,2%) и нарушений ритма сердца (6,9%), преждевременной смерти [11]. НГ может протекать под «маской» ишемической болезни сердца или КМП. Последняя при гемохроматозе может приводить к развитию ХСН, но чаще имеет малосимптомное течение [11].
Клинические проявления перегрузки железом включают симптомы поражения сердца: экстрасистолию, фибрилляцию предсердий и другие нарушения ритма и проводимости, синдром слабости синусового узла, диастолическую и систолическую дисфункцию как проявление токсической КМП (чаще рестриктивной, реже дилатационной), внезапную сердечную смерть, легочную гипертензию, вальвулопатии, перикардит, некомпактный миокард (НМ) [3, 11–12].
Первоначально пациенты могут отмечать одышку при физической нагрузке из-за диастолической дисфункции, приводящей к ограничительной гемодинамике и повышенному давлению наполнения, с более поздними проявлениями систолической дисфункции левого желудочка (ЛЖ) [8]. Пациентов беспокоят тахикардия, одышка; нарушения ритма сердца и проводимости [12].
Для диагностики поражения миокарда при гемохроматозе необходимы электрокардиография (ЭКГ), холтеровское мониторирование ЭКГ и эхокардиография (ЭхоКГ) [3, 10–13]. Также в настоящее время особый интерес представляют такие ЭхоКГ-критерии, как продольная деформация миокарда, миокардиальная работа. Уровни натрийуретического пептида позволяют судить о наличии ХСН на фоне поражения сердца перегрузкой железом.
Для подтверждения перегрузки железом миокарда выполняют магнитно-резонансную томографию (МРТ) сердца с использованием методики Т2-релаксометрии, что позволяет выявлять накопления железа на доклинической стадии и дает возможность количественно оценить перегрузку сердца железом [3, 13]. В исследовании A. Pepe et al. показано, что у пациентов со временем релаксации Т2 менее 10 мс риск развития застойной сердечной недостаточности был высоким и они нуждались в хелаторной терапии [14].
A. Piga et al. провели исследование, посвященное вопросам ремоделирования миокарда у пациентов с β-талассемией и перегрузкой железом. По данным МРТ сердца были выявлены признаки НМЛЖ у 18 из 135 пациентов с использованием критериев Petersen. Авторы предполагают, что неэффективный эритропоэз и хроническая анемия/гемолиз вызывают развитие окислительного и воспалительного стресса, что в свою очередь приводит к ремоделированию миокарда и трансформации из компактной мускулатуры в губчатый миокард – приобретенный вариант НМЛЖ [15].
В исследовании E. Chiodi et al. проведен сравнительный анализ данных МРТ пациентов с гемохроматозом и вторичным НМ с результатами визуализации пациентов с НМЛЖ [16] с целью выявления лучшего критерия диагностики НМЛЖ из имеющихся: модифицированный критерий Petersen, критерий Jacquier и критерий Grothoff. Авторы рекомендуют с целью дифференциальной диагностики НМЛЖ использовать критерий Grothoff [16].
У пациентов с вторичным гемохроматозом (ВГ) сердца отмечается ремоделирование миокарда по типу НМЛЖ, генез которого с большой долей вероятности носит вторичный характер. С целью подтверждения данной гипотезы могут быть актуальными проведение проспективного наблюдения (МРТ сердца), а также семейный скрининг и молекулярно-генетическое исследование [13]. Дисбаланс метаболизма железа и окислительный стресс служат фактором риска развития гипертрофии сердца, сердечной аритмии. Кроме того, перегрузка железом рассматривается как основной механизм гибели клеток, называемый ферроптозом, который приводит к повреждению тканей. Измененный гомеостаз железа допускает неконтролируемое поступление и отложение железа в различных органах, включая сердце, и приводит к прогрессирующему повреждению с тяжелой недостаточностью пораженных органов. В экспериментальной работе исследователи предположили развитие сердечных аритмий за счет продукции активных форм кислорода, деполяризации митохондриальной мембраны и нарушения цитозольной динамики ионов кальция [17–19].
Поражение почек при перегрузке железом
В настоящее время хорошо изученных данных о поражении почек при гемохроматозе недостаточно. Однако достоверно известно, что ось гепсидин–ферропортин почек контролирует реабсорбцию железа и определяет восприимчивость почек к перегрузке железом [20]. Так, в экспериментальной работе G. Mohammad et al. показана регуляция гепсидином ферропортин-опосредованной реабсорбции железа в различных условиях (нормальные физиологические условия, перегрузка железом – 200 мг и 5000 ppm, внутрь в течение 3 месяцев, при гемохроматозе). Получены данные о различной локализации ферропортина в почках: у нокаутированных мышей – в цитоплазме и базолатеральной мембране почечных канальцев, у мышей «дикого» типа – в цитоплазме и апикальной мембране. Исследователи из Оксфордского и Кэмбриджского университетов продемонстрировали, что при утрате этой регуляции при гемохроматозе происходит перегрузка железом печени и защита почек. Подавление реабсорбции железа сопряжено с повышением его содержания в почках. Торможение реабсорбции железа повышенным гепсидином при хроническом воспалении усиливает дефицит железа, а его инфузия ведет к перегрузке железом почек [20].
Чем опасна перегрузка железом? Увеличение пула железа III может служить катализатором образования свободных радикалов и инициатором оксидативного стресса. С целью компенсации в организме предусмотрены естественные антиоксиданты – хелаторы железа III, к которым относятся мочевая кислота, церулоплазмин, супероксиддисмутаза, ферритин, трансферрин [21].
S.A.T. Alenezi et al. изучали гиперурикемию как маркер перегрузки железом у 117 пациентов Саудовской Аравии. Из исследования исключили лиц с повышенным уровнем С-реактивного белка. Выявлена положительная корреляция между уровнем мочевой кислоты и содержанием сывороточного железа (r=0,52), ферритина (r=0,46), трансферрина (r=0,23), насыщением трансферрина железом (r=0,56). Таким образом, ураты могут снижать катализируемый железом окислительный стресс, действуя как хелатор ионов металлов. Повышенные уровни мочевой кислоты в сыворотке связаны с повышенными уровнями ферритина в сыворотке, что может служить переменной стратификации риска наличия перегрузки железом [22].
Исследователи из США и Санкт-Петербурга изучали в экспериментальной работе на модели сахарного диабета 1 и 2 типов возможности влияния железа на уровень ренина в сыворотке и почках. У мышей с HFE выявлено содержание железа в эпителиальных клетках капсулы Боумена, проксимальных канальцах и собирательных трубочках, а также повышение уровня ренина как в плазме, так и в ткани почек. Диета с низким содержанием железа и хелаторы железа замедляли прогрессирование диабетической нефропатии [23]. При НГ может развиваться метаболическая нефропатия [24].
При местной перегрузке железом в практике интерниста может быть диагностирован синдром Гудпасчера (идиопатический гемосидероз легких с пролиферативным или мембранозным гломерулонефритом) [25–26]. Страдают преимущественно молодые мужчины. Кризовое течение (спонтанно или на фоне ОРВИ), поражение легких, гемолитическая анемия (отрицательная прямая проба Кумбса), в моче – гематурия, протеинурия, цилиндрурия; азотемия. В крови определяют антитела к базальной мембране альвеол и почечных клубочков. При биопсии почек наблюдается картина быстропрогрессирующего гломерулонефрита. Патогномоничным диагностическим признаком служит обнаружение гемосидерина в моче [25]. Рано развивается ХБП. Лечение: глюкокортикостероиды, трансфузии эритроцитарной массы, после массивных кровоизлияний – дефероксамин, цитостатики; лечение гломерулонефрита, трансплантация почек при терминальной почечной недостаточности [25–26].
Также известно, что при перегрузке железом может усугубляться течение ХБП [27]. I. Ashankyty et al. изучали связь наличия мутации гена HFE (C282Y, S65C, H63D) как фактора риска ХБП у 5 мужчин в возрасте 46–62 лет. У 2 из 5 пациентов выявлена гетерозиготная мутация H63D в гене HFE. Авторы исследования полагают, что перегрузка железом, опосредованная генетическим гемохроматозом, может способствовать развитию ХБП. Хотя НГ, приводящий к накоплению железа в почках, встречается редко, его отложение в таких органах, как селезенка, печень, сердце, приводит к сильному нарушению функций этих органов [27].
Гиперферритинемия при ХБП у пациентов на гемодиализе частично служит результатом системного воспаления, уровни ферритина коррелируют с его тяжестью [4].
Гемохроматоз редко встречается у реципиентов почечного трансплантата. Описан гемохроматоз, верифицированный по высокому уровню ферритина (до операции – 2115 нг/мл, на фоне введения препаратов железа и стимуляторов эритропоэза; через полтора года после трансплантации – 9468 нг/мл), у пациента 37 лет после трансплантации почки от умершего донора. При генетическом исследовании выявлена гетерозиготность HFE C282Y. Наблюдались такие симптомы гемохроматоза, как гиперпигментация кожи, повышение активности аминотрансфераз, нарушение толерантности к глюкозе и сердечная недостаточность. После лечения (36 процедур флеботомии) функция трансплантата значительно улучшилась, большинство симптомов гемохроматоза исчезло, а уровень ферритина в сыворотке значительно снизился (до 1921 нг/мл). По данным авторов, гемохроматоз может возникать у гетерозиготных пациентов с HFE после трансплантации почки. Введение железа, инфекции, тип иммуносупрессии и нарушение функции печени следует рассматривать как потенциальные триггеры гемохроматоза у пациентов этой группы [28].
Диагностика поражения почек [3]: уровень креатинина, мочевины, расчет СКФ, позволяет судить о степени ХБП, наличии ОПП. Цистатин С и мочевая кислота также позволяют оценить функцию почек. Визуализирующие методики: УЗИ, МРТ. Биопсия почки.
Диагностика КРС 6-го типа: маркеры повреждения сердца и почек (BNP, креатинин, Cys C, Gal-3, NGAL, ST-2, кардиотрофин-1), стрейн (продольная деформация по данным эхокардиографии), биопсия почки [2].
Причиной гибели при гемохроматозе могут быть печеночная иди диабетическая комы, сердечная недостаточность, «шоковая почка» (ОПП), кровотечение из варикозно расширенных вен пищевода при циррозе [24].
Лечение гемохроматоза и вторичного кардиоренального синдрома
При гемохроматозе рекомендуют диету с ограничением продуктов, содержащих большие количества железа; проводят флеботомию; назначают хелаторы железа (обязательно при уровне ферритина в сыворотке крови более 2000 нг/мл) [3].
В Российской Федерации зарегистрирован деферозирокс – пероральный хелатор железа с периодом полувыведения 8–16 часов, что позволяет принимать препарат 1 раз в сутки. Клинические исследования показали, что деферазирокс способен контролировать токсичный пул лабильного железа плазмы и удалять отложения железа из ткани печени и сердца [3].
Назначение хелаторной терапии деферазироксом показано в следующих клинических ситуациях: наличие доказанной перегрузки железом у трансфузионно-зависимых больных и у пациентов с гемобластозами или миелодиспластическим синдромом, ожидающих проведения трансплантации аллогенных гемопоэтических клеток [3].
Хелатирующую терапию рекомендуется назначать при анемии 2–3-й степеней, выраженной гипотонии, гипоальбуминемии, ХСН, значении Т2<10 мс (по данным МРТ сердца). Цель лечения – достижение уровня насыщения трансферрина железом <50% [3, 8, 10–11, 13, 29]. Лечение может быть временно прервано, когда содержание ферритина сыворотки стабильно менее 500 мкг/л [3].
Однако у хелаторной терапии есть и побочные эффекты [30], в т.ч. со стороны почек: повышение уровня креатинина, протеинурия, почечная тубулопатия (синдром Фанкони), отеки, ОПП. Легкое непрогрессирующее повышение уровня креатинина в сыворотке, в основном в пределах референсных значений, наблюдалось почти у 34% пациентов. Данный побочный эффект зависит от дозы препарата, часто разрешается спонтанно и иногда может уменьшаться при снижении дозы [30]. С целью контроля безопасности хелаторной терапии рекомендуют определять уровень креатинина до начала терапии и далее ежемесячно, содержание белка в моче (общий анализ мочи) – ежемесячно [3].
Кроме того, для лечения пациентов с КРС 6-го типа в настоящее время рекомендованы ингибиторы РААС (ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II, антагонисты рецепторов ангиотензина/неприлизина), антагонисты минералокортикоидных рецепторов ингибиторы натрий-глюкозного котранспортера 2 типа [2, 11], доказавшие кардиопротективное и нефропротективное действия. Миметики гепсидина, ингибиторы ферропортина могут снижать реабсорбцию железа и повышать его содержание в почках [20].
Заключение
Таким образом, НГ является орфанным заболеванием, которое врачи-клиницисты диагностируют порой не на ранних стадиях. Различные «маски» данного заболевания кроются за другими, более хорошо изученными заболеваниями. Однако необходимость знания данной патологии заключается в том, что это заболевание можно и нужно выявлять на ранних сроках, чтобы оно не приводило к терминальным стадиям сердечной и почечной недостаточности.



