Преэклампсия (ПЭ) – это полиэтиологичный клинический синдром, как правило, развивающийся после 20 недель беременности, специфичный для беременности и послеродового периода. ПЭ является основной причиной материнской и перинатальной заболеваемости и смертности и снижает качество последующей жизни женщины даже при благоприятном исходе родов. Частота ПЭ составляет 2–8% среди всех беременных, а 10–15% случаев материнской смертности непосредственно связано с ПЭ и эклампсией [1].
Поиски молекул-предикторов ПЭ продолжаются. Вместе с тем установлено, что в связи с гетерогенностью данного синдрома наличие единого биомаркера – предиктора, способного предсказать все виды нарушений при ПЭ, крайне сомнительно. Особый интерес исследователей в последние годы сконцентрирован на изучении постгеномных изменений, а именно особенностей метаболомного профиля. Анализ метаболома обладает потенциалом для детального исследования ПЭ и других гипертензивных нарушений, но количество таких работ ограничено. Особенно это касается исследования метаболома мочи при ПЭ, несмотря на то, что моча является удобным объектом для анализа ввиду неинвазивности забора материала. Основные работы посвящены изучению плазмы и сыворотки крови [2, 3]. Вместе с тем состав мочи отражает физиологические процессы, происходящие в организме, и может выступать в качестве информативного объекта исследований.
В данном исследовании в динамике было изучено содержание аминокислот и органических кислот в моче пациенток с риском развития ПЭ, с развившейся ПЭ и пациенток с неосложненной беременностью.
Целью исследования было определение характерных особенностей состава мочи в динамике у беременных с риском развития ПЭ и реализовавшейся ПЭ.
Такого рода анализ позволит определить потенциальные метаболические биомаркеры, которые могут усовершенствовать современные модели прогнозирования риска, клинической диагностики и улучшить понимание конкретных метаболических механизмов ПЭ.
Материалы и методы
В ходе исследования, проведенного на базе ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России, обследованы 27 пациенток, которые были разделены на 3 группы: I группа (n=13) – женщины с неосложненной беременностью; II группа (n=13) – пациентки с высоким риском, но не развившейся ПЭ, и III группа (n=5) – пациентки с высоким риском и развившейся ПЭ. Пациентки были включены в группу высокого риска развития ПЭ по результатам расширенного комбинированного скрининга I триместра со значением ≤1:100 до 34 недели и/или до 37 недель беременности. Диагноз ПЭ ставился в соответствии с клиническими рекомендациями, утвержденными Минздравом России [4].
Критерии включения в группу сравнения: возраст старше 18 лет, одноплодная спонтанная беременность, а также наличие добровольного информированного согласия. Условия для исключения беременных из исследования: многоплодная беременность, сахарный диабет, аутоиммунные заболевания, онкологические заболевания, заболевания почек в стадии декомпенсации, преждевременный разрыв плодных оболочек.
Для проведения анализа проводился забор средней порции мочи после предварительных гигиенических процедур. В процессе приготовления к анализу аминокислот к 200 мкл образца мочи добавляли 480 мкл раствора хлороформ/метанол (3/1 об./об.), перемешивали 10 минут, центрифугировали 10 минут при 13 000 G, после чего отбирали 200 мкл верхней фазы, высушивали в потоке азота и растворяли образец в 500 мкл раствора ацетонитрил/вода (1/1 об./об.).
Для анализа органических кислот к 100 мкл мочи добавляли 850 мкл метанола, перемешивали 5 минут, центрифугировали 10 минут при 13 000 G и отбирали 200 мкл в хроматографическую виалу.
Анализ образцов осуществляли с помощью высокоэффективной жидкостной хроматографии (ЖХ) на хроматографе 1260 Infinity II (Agilent, США) с детектированием на масс-спектрометре (МС) 6460 Triple Quad (Agilent, США). Разделение образцов осуществлялось методом жидкостной хроматографии с использованием колонок Jasem для анализа аминокислот или органических кислот.
Для анализа аминокислот вводили 15 мкл образца и использовали следующие элюенты, подаваемые со скоростью потока 700 мкл/мин с поддерживаемой температурой колонки 30◦С, в качестве подвижной фазы: элюент А – вода с добавлением 0,1% муравьиной кислоты, элюент В – ацетонитрил с добавлением 0,1% муравьиной кислоты. Состав подвижной фазы в ходе анализа изменялся следующим образом: 0–1 минута – 78% В; до 4-й минуты объемная доля элюента B снижалась до 20%, сохраняла значение до 4,5 минуты и за 0,1 минуты возвращалась к значению 78%.
Для анализа органических кислот вводили 10 мкл образца и использовали следующие элюенты А и В от Jasem для анализа органических кислот, подаваемые со скоростью потока 500 мкл/мин с поддерживаемой температурой колонки 40°С. Состав подвижной фазы в ходе анализа изменялся следующим образом: 0–2 мин. – 5% В; до 2,1 минуты объемная доля элюента B повышалась до 35%, сохраняла значение до 4,5 минуты, повышалась до 80% за 0,1 минуты, удерживалась на этом значении 3,4 минуты и за 0,1 минуты возвращалось к значению 35%.
Транзитные переходы между родительскими ионами и дочерними фрагментами для анализируемых аминокислот и органических кислот приведены в руководстве JASEM.
Уровни метаболитов определяли с использованием программы QuantAnalysis (Agilent, США).
Статистический анализ
Статистический анализ проводился с использованием программы StatTech v. 3.1.6 («Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка или критерия Колмогорова–Смирнова. В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела–Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение групп по количественному показателю, имеющему нормальное распределение, выполнялось с помощью однофакторного дисперсионного анализа, апостериорные сравнения проводились с помощью критерия Геймса–Хауэлла. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат (χ2) Пирсона. Статистически значимыми различия считали при р<0,05.
Статистическую обработку экспериментальных данных проводили с помощью скриптов, написанных на языке R [R Core Team (2018). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL http://www.R-project.org/] в RStudio [RStudio Team (2016). RStudio: Integrated Development for R. RStudio, Inc., Boston, MA URL http://www.rstudio.com/].
Содержание органических и аминокислот в образце оценивали полуколичественно по относительному уровню аналита, который рассчитывали делением площади хроматографического пика соответствующего аналита на суммарную площадь пиков аналитов в данном образце.
Сравнение уровней органических и аминокислот проводилось с помощью непараметрического критерия Уилкоксона–Манна–Уитни. Для описания количественных данных использовали медианы (Me) и квартили Q1 и Q3. Величину порогового уровня значимости p принимали равной 0,05.
Кроме того, для классификации образцов был применен многофакторный метод OPLS-DA (дискриминантный анализ с помощью ортогональных проекций на скрытые структуры) [5]. Анализ OPLS-DA реализован с использованием библиотеки «ropls» [6]. Качество OPLS-DA моделей оценивали по их способности описывать дисперсию анализируемых данных (R2) и прогнозировать возможные новые данные (Q2). Параметр Q2 рассчитывали путем 7-кратной кросс-валидации. При Q2≥0,4 модель может быть использована для отнесения анализируемых образцов к той или иной клинической подгруппе. Кроме того, OPLS-DA использовали для выявления метаболитов, которые являются наиболее значимыми для классификации. Это делалось путем анализа влияния переменной на проекцию (variable influence on projection, VIP). К потенциальным метаболитам-маркерам были отнесены вещества, у которых VIP>1 [5].
Анализ вовлеченности исследуемых соединений, значимых для рассматриваемой патологии, в метаболические пути проводили с помощью ресурса MetaboAnalyst 5.0 (https://www.metaboanalyst.ca/home.xhtml).
Результаты
Возраст обследованных женщин во всех группах варьировал от 26 до 42 лет, что в среднем составило 32,74 (3,81) года: в I группе – 31,92 (3,64), во II группе – 32,69 (3,30); в III группе – 35 (5,29) лет. Статистически значимых различий по возрастному составу между исследованными группами не было отмечено. Средний индекс массы тела (ИМТ) в I группе составил 25 (3) кг/м², во II группе – 27,30 (4,11) кг/м², а в III группе – 34,6 (10,7) кг/м², при анализе нам не удалось выявить значимых различий (p=0,110) (табл. 1).
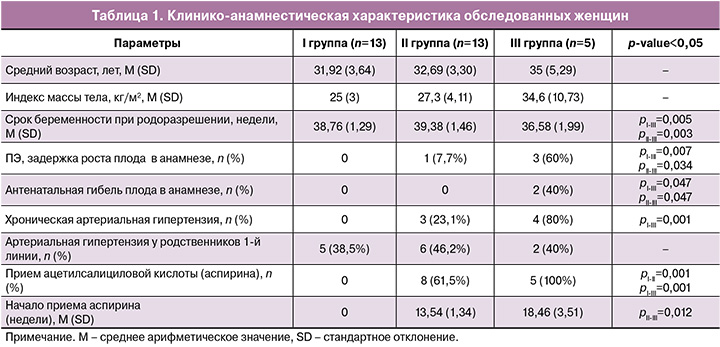
В III группе женщины значимо чаще имели отягощенный акушерско-гинекологический анамнез: антенатальная гибель плода – у 2 (40%), ПЭ в анамнезе – у 3 (60%) женщин, в то время как во II группе отмечалась только ПЭ в анамнезе в 1 (7,7%) случае. В группе сравнения репродуктивный анамнез осложнен не был (р<0,001).
Хроническая артериальная гипертензия статистически значимо чаще отмечалась в III группе – 4 (80%) – по сравнению с группой контроля, где данное заболевание не было зафиксировано (р=0,001). Были найдены статистически значимые различия в отношении гестационной артериальной гипертензии, которая диагностировалась только во II группе пациенток – у 4/13 (30,8%), р=0,042.
Средний риск развития ПЭ по данным расширенного комбинированного скрининга I триместра во II группе составил 1:57, а в III – 1:33, что статистически значимо выше, чем в I группе, где риск составил 1:2435 (р=0,001). 8/13(61,5%) пациенток II группы получали ацетилсалициловую кислоту в дозе 150 мг, тогда как в III группе данная профилактика ПЭ проводилась во всех случаях. Вместе с тем cредние сроки начала приема ацетилсалициловой кислоты во II группе составили 13,54 (1,34) недель, в то время как в III группе – 18,46 (3,51) недель (р=0,012). Вероятно, одним из факторов развития ПЭ в данной группе явилось более позднее начало приема ацетилсалициловой кислоты. Гестационный срок при родоразрешении был значительно ниже в группе III по сравнению с I и II группами (36,58 (1,99), 38,76 (1,29) и 39,38 (1,46) недель соответственно), р=0,005. Соответственно выписка из стационара пациенток III группы происходила статистически значимо позже в сравнении с I и II группами (p=0,001).
Более ранний срок родоразрешения в III группе отражался в меньшей массе тела новорожденных – 2502,40 (774,75) г против 3394,69 (447,59) г в I группе и 3340,77 (497,46) г – во II группе (p=0,008). В связи с этим и выписка новорожденных происходила значительно позже в III группе (5,2 (1,78) суток) в сравнении с I и II группами (3,34 (0,58); 3,44 (0,88) суток соответственно) (p=0,003).
В ходе анализа были получены данные об относительном содержании 21 аминокислоты и 13 органических кислот в моче беременных. Список аминокислот включал L-триптофан, L-тирозин, таурин, L-фенилаланин, L-валин, L-метионин, аспарагиновую кислоту, L-норвалин, L-гомоцитруллин, L-серин, L-треонин, саркозин, L-аланин, L-глютамин, глицин, транс-4-гидрокси-L-пролин, L-глютаминовую кислоту, L-аспарагин, L-пролин, L-цитруллин, L-цистин. В число органических кислот, для которых удалось зарегистрировать ЖХ-МС-сигнал, входили 2-гидрокси-масляная кислота, 2-гидрокси-глутаровая кислота, 3-гидрокси-3-метилглутаровая кислота, 3-гидрокси-глутаровая кислота, 3-гидрокси-изобутират, альфа-кетоглутаровая кислота, лимонная кислота, гликолевая кислота, молочная кислота, яблочная кислота, метилмалоновая кислота, N-ацетил-аспарагиновая кислота, пировиноградная кислота. Динамическое наблюдение за пациентками с забором образцов мочи проводилось в 11–14, 22–25 и 32–35 недель беременности (точки исследования), а также в точке клинической манифестации ПЭ.
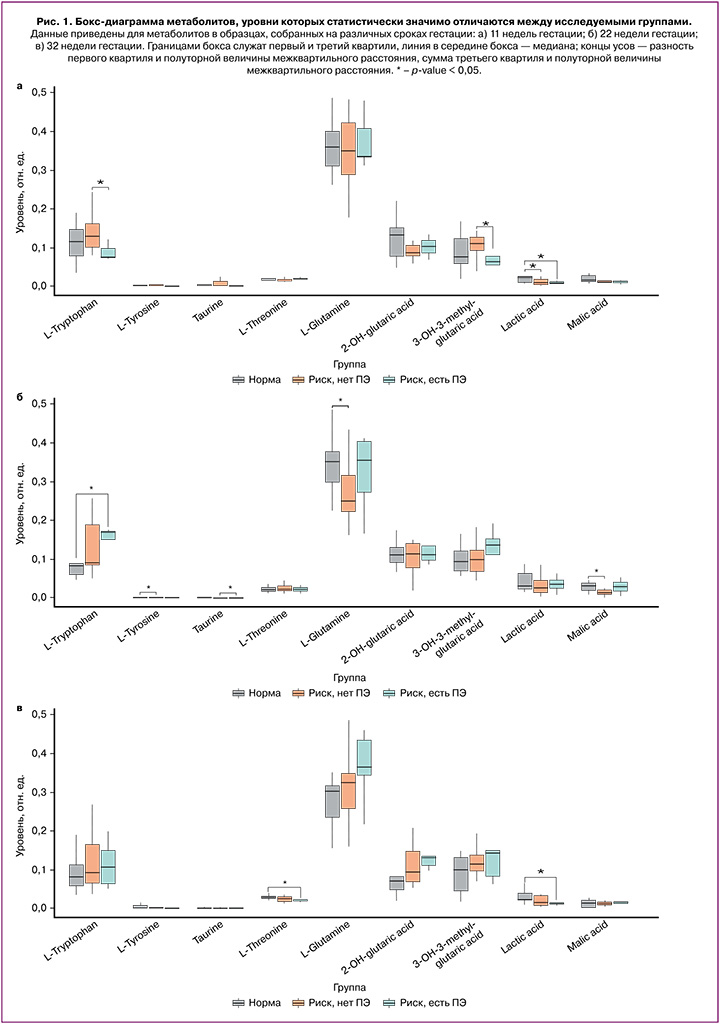
Статистически значимые различия уровней метаболитов в I и II группах были обнаружены для молочной кислоты (p=0,03) в сроке «11–14 недель гестации»; для тирозина (p=0,05), глутамина (p=0,03) и яблочной кислоты (p=0,01) в сроке «22–25 недель гестации». В точке «32–35 недель гестации» статистически значимых отличий не было выявлено. Аналогичный сравнительный анализ уровней метаболитов в I и III группах позволил обнаружить статистически значимые различия для следующих метаболитов: в сроке «11–14 недель гестации» – молочная кислота (p=0,04), в сроке «22–25 недель гестации» – триптофан (p=0,02), в сроке «32–35 недель гестации» – треонин (p=0,03) и молочная кислота (p-value=0,05). Представляет интерес выявление различий между пациентками II группы – пациентки группы риска, у которых не развилась ПЭ, и группы III – пациентки с риском развития и клинической манифестацией ПЭ. Так, статистически значимо различались уровни триптофана (p=0,05) и 3-гидрокси-3-метилглутаровой кислоты (p=0,05) в образцах, собранных в сроке «11–14 недель гестации», а также таурина (p=0,05) в сроке «22–25 недель гестации». Полученные результаты позволяют выделить биомаркеры для разработки модели прогнозирования развития ПЭ у пациенток высокого риска.
Для поиска особенностей динамики изменения уровня исследованных метаболитов между тремя группами обследованных вначале рассчитывали относительное стандартное отклонение уровней между тремя обозначенными выше точками исследования для каждой пациентки, а затем выполняли сравнение этих показателей между группами методом Уилкоксона–Манна–Уитни (рис. 1). Статистически значимые различия динамики изменения уровней наблюдались для пролина, аспартата и яблочной кислоты при сравнении групп I и III, а также для пролина, альфа-кетоглутарата и 3-гидрокси-3-метилглутаровой кислоты при сравнении групп II и III.
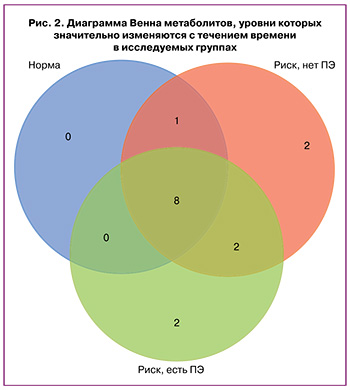
Кроме того, были отмечены метаболиты, у которых усредненное по группе относительное стандартное отклонение превышало 50%, то есть метаболиты, уровни которых заметно изменялись с течением времени. Для группы с неосложненной беременностью таких метаболитов оказалось 9: норвалин, молочная кислота, тирозин, яблочная кислота, фенилаланин, метионин, лимонная кислота, таурин и цистин; для группы II – 13 метаболитов: яблочная кислота, валин, фенилаланин, гомоцитруллин, ацетиласпартат, транс-4-гидроксипролин, норвалин, тирозин, метионин, молочная кислота, лимонная кислота, таурин, цистин; для группы III – 12 метаболитов: гомоцитруллин, пролин, ацетиласпартат, молочная кислота, метионин, норвалин, тирозин, аспартат, фенилаланин, лимонная кислота, цистин, таурин. На рисунке 2 представлена диаграмма Венна для перечисленных метаболитов. Значительное изменение уровней метаболитов, представленных только в группе II, наблюдается для транс-4-гидроксипролина и валина. Уникальными с точки зрения изменения во времени для группы III были аспартат и пролин. Несмотря на то что для этих соединений не было обнаружено межгруппового статистически значимого различия, следует обратить на них внимание, поскольку динамика уровней этих метаболитов отличается от группы с физиологической беременностью и различается между группами II и III.

Оценку возможности прогнозирования развития ПЭ на основании метаболомного состава мочи проводили методом OPLS-DA. Этот подход является модификацией метода главных компонент, разработанной для создания моделей с обучением. Результаты OPLS-DA анализа представлены на рисунке 3 в виде графиков счетов. Точки, соответствующие образцам от пациенток, у которых реализовалась ПЭ, и пациенток без клинических проявлений ПЭ, разделились на 2 кластера, что свидетельствует о заметных различиях профилей органических и аминокислот сравниваемых групп. Наибольший вклад в кластеризацию образцов внесли следующие метаболиты: в «11–14 недель гестации» – альфа-кетоглутаровая кислота, 3-гидрокси-3-метилглутаровая кислота, фенилаланин, триптофан, пролин, транс-4-гидроксипролин, гликолевая кислота, тирозин, 2-гидроксимасляная кислота, таурин, аспарагиновая кислота, метилмалоновая кислота; в «22–25 недель гестации» – метионин, 3-гидрокси-изобутират, таурин, аспарагин, норвалин, серин, аспарагиновая кислота, треонин, ацетиласпарагиновая кислота, пировиноградная кислота, тирозин; в «32–35 недель гестации» – цистин, глутаминовая кислота, тирозин, глутамин, фенилаланин, яблочная кислота, треонин, саркозин, аланин, аспарагиновая кислота, валин, метилмалоновая кислота, аспарагин, норвалин.
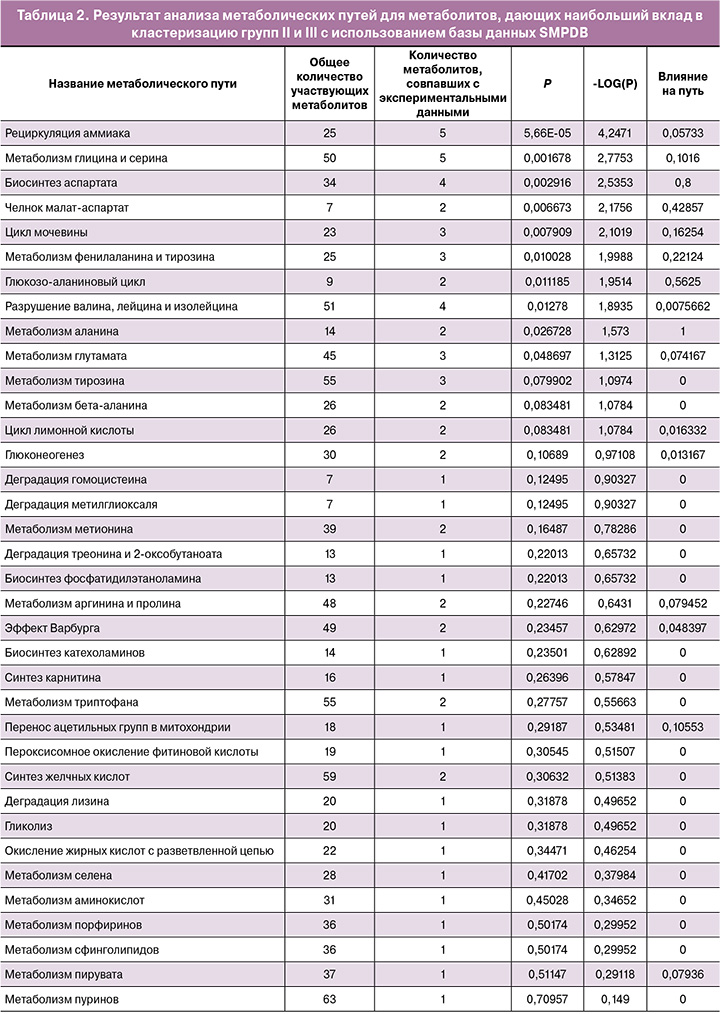
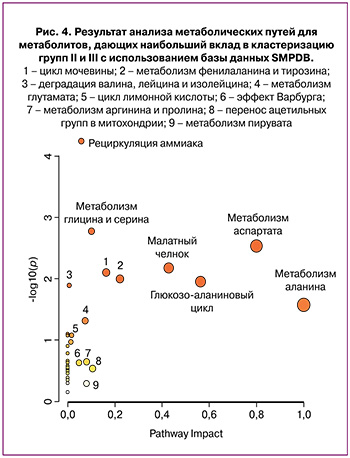
Биоинформатический анализ метаболитов с наибольшим вкладом в кластеризацию образцов проводили с использованием ресурса MetaboAnalyst. Были определены биологические связанные сети, которые потенциально могут быть вовлечены в патофизиологию ПЭ. Сети метаболических путей строили с учетом различий метаболитов в группах II и III (рис. 4). В ходе анализа данных (табл. 2), представленных в базе SMPDB, были выявлены пути, упорядоченные по уровням значимости (анализ обогащения путей – ось ординат на рис. 4) и значениям влияния рассматриваемых метаболитов на путь (анализ топологии пути – ось абсцисс на рис. 4). Цвет узла соответствует уровню значимости, а радиус узла коррелирует с величиной влияния на путь. Влияние на путь рассчитывается как сумма показателей значимости соответствующих метаболитов, нормированная на сумму показателей значимости всех метаболитов в каждом пути. Оценка обогащения метаболических путей выполнена с помощью анализа избыточного представления (Over Representation Analysis, ORA) с использованием гипергеометрического теста.
Обсуждение
Наше исследование показало, что клинико-анамнестические данные пациентки вносят весомый вклад в многопараметрический расчет риска развития ПЭ, а также подтвердило сведения о том, что более раннее начало приема ацетилсалициловой кислоты значительно снижает частоту развития ПЭ [7]. Наибольший интерес представили результаты поиска метаболитов, ответственных за реализацию ПЭ у пациенток высокого риска. Ими оказались уровни триптофана (p=0,05) и 3-гидрокси-3-метилглутаровой кислоты (p=0,05) в образцах, собранных в сроке «11–14 недель гестации», а также таурина (p=0,05) в «22–25 недель гестации».
Известно, что уровни аминокислот в организме матери играют ключевую роль в регуляции роста плода [8]. Однако данные об уровнях аминокислот во время беременности довольно ограничены и получены из исследований с небольшим числом участников [9, 10]. Поэтому дополнительная информация о возможных нарушениях метаболизма аминокислот при ПЭ может играть существенную роль в понимании патогенеза ПЭ. Ранее было показано [11], что метаболизм лейцина, валина и изолейцина связан с различными гипертензивными нарушениями, включая ПЭ. Гидроксиглутамат рассматривается как существенно значимый предиктор ПЭ [12]. Он участвует в пути метаболизма аргинина-пролина, нарушение которого также связывают с гипертензивными расстройствами [13]. Кроме того, гидроксиглутамат является субстратом в реакции, продуцирующей 4-гидрокси-2-оксоглутарат, как промежуточном звене в нескольких путях, связанных с ПЭ [13].
Среди прочих метаболитов, рассмотренных в данной работе, особое внимание обращает на себя лактат, уровень которого статистически значимо различался между тремя обследованными группами. Лактат образуется из пирувата под действием лактатдегидрогеназы на последнем этапе гликолиза и выступает в качестве субстрата для глюконеогенеза. Лактат вырабатывается большинством тканей организма. Концентрация циркулирующего лактата составляет <2 ммоль/л, и в нормальных аэробных условиях он постоянно вырабатывается и потребляется [14, 15]. В условиях гипоксии или при превышении скорости клеточного гликолиза пируват превращается в лактат с образованием аденозинтрифосфата. Факторы, способствующие повышению уровня лактата, включают, среди прочего, гипоперфузию, митохондриальную дисфункцию и наличие гиперметаболического состояния [16]. Лактат метаболизируется в печени, что составляет до 70% клиренса лактата в организме, и в почках [17]. В нормальных условиях образование и потребление лактата одинаковы, что приводит к стабильной концентрации лактата в крови [17]. Сообщается, что фермент лактатдегидрогеназа имеет повышенную активность и экспрессию генов в плаценте при ПЭ, а лактат вырабатывается и секретируется в более высоких концентрациях [18, 19]. При этом в настоящем исследовании уровень лактата в моче у пациенток с риском ПЭ и пациенток с манифестацией ПЭ оказался ниже, чем у участниц с физиологической беременностью. Это может быть связано с особенностями функционирования почек у пациенток с риском ПЭ без клинических проявлений ПЭ и пациенток с реализованным риском ПЭ.
Стоит отметить, что это первое исследование, в котором группа пациенток с высоким риском ПЭ, по данным скрининга I триместра, была разделена на 2 подгруппы: тех, у которых ПЭ не манифестировала, и тех, у которых риск ПЭ клинически реализовался. Полученные результаты свидетельствуют о различных динамических изменениях метаболизма среди изученных групп, что может детализировать риск развития ПЭ, например, в 22–25 недель беременности. По всей видимости, несмотря на высокую предиктивную способность скрининга I триместра [20], необходимо дополнительное обследование метаболомного профиля мочи у женщин высокого риска в более поздние сроки гестации с целью прецизионного прогнозирования ПЭ.
Сильная сторона данного исследования заключается в проведении динамического сравнительного изучения метаболомного профиля мочи при неосложненной беременности, у пациенток высокого риска без реализации ПЭ и пациенток с высоким риском и клинической манифестацией ПЭ.
Слабая сторона данного исследования заключается в небольших выборках наблюдений, что связано, в том числе, с частотой ПЭ и сложностями забора материала в надлежащие сроки беременности у амбулаторных пациенток. Дальнейшие исследования с расширением объема выборки будут способствовать проверке надежности методов, основанных на анализе динамики изменений метаболома мочи, определению возможностей метаболомики в прогнозировании и диагностике ПЭ.
Заключение
В ходе исследования были выявлены метаболиты, уровни которых в моче статистически значимо различаются между группой пациенток с физиологическим течением беременности и группами пациенток с риском развития ПЭ в различные сроки гестации. Метаболиты, определяющие кластеризацию образцов мочи пациенток, у которых развилась ПЭ, и пациенток с риском развития ПЭ вовлечены во множество метаболических путей, связанных с регуляцией роста плода, гипертензивными расстройствами, гипоксией и функционированием митохондрий. Безусловно, необходимы дальнейшие исследования с анализом фактических данных больших объемов и валидацией результатов. Вместе с тем профилирование метаболитов мочи является многообещающим вектором исследования, которое потенциально может быть использовано для прогнозирования ПЭ.
Таким образом, метаболомный анализ мочи с исследовательских позиций позволит определить роль отдельных метаболитов в патогенезе ПЭ, а с практической точки зрения – выявить наиболее специфичные метаболиты-биомаркеры ПЭ для определенных сроков беременности, что поможет в ее полном мониторинге, оценке эффективности лечения и оптимизации сроков родоразрешения.



