Тромбоз церебральных вен (ТЦВ) является редким, угрожающим жизни состоянием, которое в настоящее время стало все чаще встречаться в акушерско-гинекологической практике, в том числе и в связи с широким применением эстрогенсодержащих гормональных препаратов.
В понятие «тромбоз церебральных вен» включены тромбозы поверхностных и глубоких церебральных вен, а также тромбозы синусов головного мозга. Впервые церебральный тромбоз был описан Rides в 1825 г. у пациента с метастатическим опухолевым процессом, а в 1828 г. John Abercrombie («Pathological and Practical Researches on Diseases of the Brain and Spinal Cord». Edinburgh, 1828/«Патологические и практические исследования болезней мозга. Сочинение Иоанна Аберкромби. Спб, 1836) описал церебральный тромбоз у женщины в послеродовом периоде. Данная патология встречается редко – с частотой 3–4 случая на миллион взрослых лиц [1]. В отличие от ишемического инсульта, который в типичных случаях возникает у лиц пожилого возраста, ТЦВ развивается в основном у молодых [2].
Помимо типичных факторов риска венозных тромбозов (тромбофилические состояния, травмы, инфекционные заболевания), наиболее частыми провоцирующими факторами развития ТЦВ становятся прием гормональных контрацептивов, включая трансдермальную и вагинальную формы, беременность и послеродовый период [3, 4]. В одном из исследований [5] ТЦВ развился на фоне приема оральных контрацептивов (ОК), менопаузальной гормональной терапии и беременности у 65% пациенток (n=465). В структуре случаев нарушений мозгового кровообращения, связанных с беременностью, ТЦВ занимают 27–57% [6].
В литературе имеются единичные описания случаев тромбоза венозных синусов при применении вспомогательных репродуктивных технологий (ВРТ), в основном на фоне синдрома гиперстимуляции яичников (СГЯ) [7, 8]. В качестве основных факторов риска называют индукцию овуляции хорионическим гонадотропином, гемоконцентрацию и гиперэстрогению. Стимуляция овуляции высокими дозами гонадотропинов также ассоциирована с риском тромботических осложнений [9, 10]. Описан случай ТБЦ на сроке 6 недель при отсутствии СГЯ после стимуляции овуляции рекомбинантным фолликулостимулирующим гормоном (ФСГ) и искусственной инсеминации [11].
Мы представляем описание клинического случая тромбоза синусов головного мозга во время беременности после ЭКО у пациентки, которая ранее перенесла двустороннюю аднексэктомию и получала заместительную гормональную терапию.
Клиническое наблюдение
Пациентка Я., 36 лет, обратилась с диагнозом тромбоза синусов головного мозга на сроке беременности 10–11 недель. Из анамнеза: в возрасте с 22 по 25 лет пациентка принимала этинилэстрадиол 30 мг + дроспиренон 3 мг с целью контрацепции. В 2007 г. в возрасте 25 лет выполнена аднексэктомия справа в связи с аденокарциномой, проведено 6 курсов полихимиотерапии. В 2012 г. выполнена лапаротомия, резекция левого яичника в связи с пограничной серозной опухолью. В 2014 г. – лапаротомия, аднексэктомия слева в связи с рецидивом пограничной серозной опухоли яичника, произведена консервативная миомэктомия. С 2014 г. в течение 3 лет пациентка получала заместительную гормональную терапию – трансдермальный эстрадиол 1 г с 5-го по 25-й день цикла и микронизированный прогестерон с 16-го по 25-й день цикла. В 2012, 2013 и 2015 гг. проведены 3 попытки ЭКО без эффекта.
Соматический анамнез: хронический аутоиммунный тиреоидит, гипотиреоз, хронический гастродуоденит, жировой гепатоз. Вес 80 кг, рост 162 см, индекс массы тела (ИМТ) 30,5 кг/м2. Семейный анамнез: у дедушки инфаркт миокарда до 55 лет, умер от мезентериального тромбоза.
 В процессе подготовки к криопереносу в течение одного месяца пациентка получала микронизированный прогестерон 600 мг в сутки вагинально, эстрадиол перорально 2 мг, эстрадиол трансдермальный гель 3 г. За 5 дней до переноса эмбриона была начата терапия эноксапарином 0,4 мл (4000 анти-Ха-активности) 1 раз в сутки, однако низкомолекулярный гепарин (НМГ) был отменен в связи с появлением кровянистых выделений из половых путей. Через одну неделю после отмены НМГ на сроке 6 недель беременности пациентка отметила ощущения онемения вокруг рта, кистей рук, наблюдались нарушения речи. Описанные явления носили транзиторный характер, длились по 10–15 минут и наблюдались в течение 4 дней. В дальнейшем присоединилась выраженная стойкая головная боль, тошнота, повышение АД до 150/100 мм рт.ст.
В процессе подготовки к криопереносу в течение одного месяца пациентка получала микронизированный прогестерон 600 мг в сутки вагинально, эстрадиол перорально 2 мг, эстрадиол трансдермальный гель 3 г. За 5 дней до переноса эмбриона была начата терапия эноксапарином 0,4 мл (4000 анти-Ха-активности) 1 раз в сутки, однако низкомолекулярный гепарин (НМГ) был отменен в связи с появлением кровянистых выделений из половых путей. Через одну неделю после отмены НМГ на сроке 6 недель беременности пациентка отметила ощущения онемения вокруг рта, кистей рук, наблюдались нарушения речи. Описанные явления носили транзиторный характер, длились по 10–15 минут и наблюдались в течение 4 дней. В дальнейшем присоединилась выраженная стойкая головная боль, тошнота, повышение АД до 150/100 мм рт.ст.
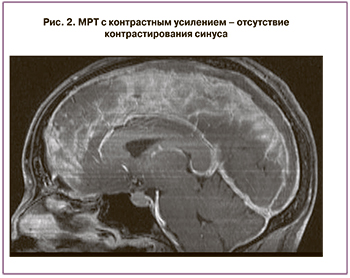
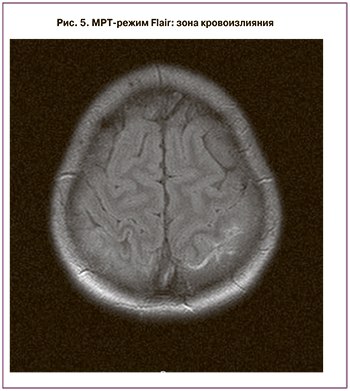
По данным МРТ с контрастированием выявлен тромбоз верхнего и нижнего сагиттального синуса на всем протяжении, верхних анастомотических вен с обеих сторон с субарахноидальным кровоизлиянием в теменные доли с обеих сторон (рис. 1–5).
По результатам анализов, выполненных за 5 дней до переноса эмбриона, стандартные показатели коагулограммы в пределах нормы, Д-димер < 0,5 мкг/мл, фактор VIII 259% (норма 60–150%), фактор Виллебранда (vWF) 270% (норма 50–160%), FIX 150% (норма 60–150%).
 Обследования на тромбофилию: мутация FV Leiden и мутация протромбина G20210A не выявлены, обнаружен полиморфизм гена протромбина T165M в гетерозиготном состоянии. Уровень гомоцистеина 5,91 мкмоль/л (норма до 15 мкмоль/л), протеин С 144% (норма 70–130%), протеин S 130% (норма 56,7–147,2%), антикардиолипины, антифосфолипидные антитела, антитела к аннексину V, к β2-гликопротеину IgG и IgM не обнаружены, антитела к протромбину IgG 4,15 Ед/мл (норма менее 10), Парус-тест 0,91 (норма >0,7), проба на волчаночный антикоагулянт (тест с ядом гадюки Рассела) отрицательная.
Обследования на тромбофилию: мутация FV Leiden и мутация протромбина G20210A не выявлены, обнаружен полиморфизм гена протромбина T165M в гетерозиготном состоянии. Уровень гомоцистеина 5,91 мкмоль/л (норма до 15 мкмоль/л), протеин С 144% (норма 70–130%), протеин S 130% (норма 56,7–147,2%), антикардиолипины, антифосфолипидные антитела, антитела к аннексину V, к β2-гликопротеину IgG и IgM не обнаружены, антитела к протромбину IgG 4,15 Ед/мл (норма менее 10), Парус-тест 0,91 (норма >0,7), проба на волчаночный антикоагулянт (тест с ядом гадюки Рассела) отрицательная.
По данным контрольных гемостазиограмм на сроке 8–9 недель беременности, проведенных через 7 дней от начала терапии нефракционированным гепарином (НФГ), фибриноген 3,46 г/л (норма 2–4 г/л), антитромбин 99,9% (норма 75–125%), Д-димер 0,68 мг/л (норма <0,55 для небеременных), по данным тромбоэластограммы признаки гиперкоагуляции: r+k 19 мм (норма 21–27 мм), ma 48 мм (норма 40–48 мм), ИТП 18,4 у.е. (норма 6–12). На сроке беременности 9–10 недель отмечено падение антитромбина III до 68% (норма 83–123%), Д-димер 653 нг/мл (норма для I триместра менее 300). На сроке 10–11 недель концентрация ADAMTS13 0,57 мкг/мл (норма 0,6–1,6 мкг/мл), ингибитор ADAMTS13 5,71 (норма <12 ед/мл), vWF 100% (норма 50–150%), FVIII 226,3% (норма 60–150%).
 После получения результатов МРТ была начата терапия НФГ 5000 Ед 2 раза в сутки подкожно, продолжена терапия микронизированным прогестероном в дозе 200 мг 2 раза вагинально, эстрогенотерапия была отменена. На сроке беременности 8 недель был диагностирован катетер-ассоциированный тромбоз поверхностных вен левого предплечья. НФГ был заменен на НМГ – эноксапарин исходно в дозе 0,2 мл (2000 анти-Ха-активности) 2 раза в сутки, затем в течение недели доза была повышена до 0,4 мл + 0,2 мл в сутки.
После получения результатов МРТ была начата терапия НФГ 5000 Ед 2 раза в сутки подкожно, продолжена терапия микронизированным прогестероном в дозе 200 мг 2 раза вагинально, эстрогенотерапия была отменена. На сроке беременности 8 недель был диагностирован катетер-ассоциированный тромбоз поверхностных вен левого предплечья. НФГ был заменен на НМГ – эноксапарин исходно в дозе 0,2 мл (2000 анти-Ха-активности) 2 раза в сутки, затем в течение недели доза была повышена до 0,4 мл + 0,2 мл в сутки.
На фоне терапии отмечены постепенный регресс мозговой симптоматики, уменьшение головных болей, нормализация артериального давления. Через 4–5 недель сохранялась незначительно выраженная головная боль при наклонах, при физической нагрузке, чихании. На сроке 12–13 недель беременности на дозе эноксапарина 0,4 и 0,2 мл в сутки повторно появились признаки тромбофлебита в области запястья левой руки. С учетом рецидивирующих тромбозов атипичной локализации на фоне беременности и эстрогенотерапии, пациентка относится к группе крайне высокого риска по развитию повторных тромбозов и акушерских осложнений. Была рекомендована терапия НМГ в терапевтических дозах в течение всей беременности с переходом на терапию пероральными антикоагулянтами в послеродовом периоде. В качестве целевых уровней анти-Ха-активности при применении НМГ 2 раза в сутки были рекомендованы показатели от 0,6 до 1,0. Доза эноксапарина была увеличена до 0,6 мл 2 раза в сутки. В дальнейшем доза НМГ корректировалась в зависимости от показателей анти-Ха-активности, тромбоэластограммы и составляла от 0,4 мл 2 раза в сутки до 0,6 мл+0,4 мл 2 раза в сутки. На фоне терапии отмечалась нормализация уровней антитромбина III, показателей гемостазиограммы, тромбоцитопении не наблюдалось.
При оценке показателей состояния системы гемостаза в динамике сохранялись повышенные уровни фактора VIII и фактора Виллебранда (на сроке 11–12 недель беременности FVIII 225% (норма 50–150%), vWF 258,7% (норма 50–150%)). На сроке 19 недель беременности концентрация ADAMTS13 0,63 (норма 0,4–1,41ед/мл), уровень ингибитора ADAMTS13 25,63 ед/мл (норма < 12).
Клинически беременность протекала гладко. На сроке 36–37 недель произошло преждевременное излитие околоплодных вод, пациентка была родоразрешена путем операции кесарева сечения. Интраоперационная кровопотеря 700 мл. Родился живой мальчик массой 2570 г, рост 48 см с оценкой по шкале Апгар 8/8 баллов. Послеоперационный период протекал гладко. В послеродовом периоде был введен эноксапарин 0,8 мл через 6 ч после операции, затем 0,4 мл 2 раза до 5-х суток, после выписки из стационара пациентка получала эноксапарин в дозе 0,8 мл 2 раза в сутки в течение 6 недель. По данным контрольного обследования, через 2 недели после родов отмечалась нормокоагуляция по тромбоэластограмме, антитромбин 99,8% (норма 80–120%), Парус-тест 0,87 (норма >0,7), Д-димер 763 нг/мл (норма для небеременных <250), ингибитор ADAMTS13 1,93 ед/мл (норма <12), активность ADAMTS13 1,04 ед/мл (норма 0,4–1,3), vWF 0,98 ед/мл (норма 0,5–1,5).
 Через 2 месяца пациентка была переведена на варфарин (МНО 2,0–3,0, доза варфарина 6,25 мг в сутки). Перевод на варфарин производился на фоне одновременного применения эноксапарина 0,6 мл в сутки. Эноксапарин был отменен при достижении МНО 2,0.
Через 2 месяца пациентка была переведена на варфарин (МНО 2,0–3,0, доза варфарина 6,25 мг в сутки). Перевод на варфарин производился на фоне одновременного применения эноксапарина 0,6 мл в сутки. Эноксапарин был отменен при достижении МНО 2,0.
Ребенок растет и развивается нормально, лактация в течение 5 месяцев. После прекращения грудного вскармливания, несмотря на подробные рекомендации о рисках, связанных с гормональной терапией, пациентка самостоятельно приняла решение о возобновлении заместительной гормональной терапии (эстрадиол трансдермальный гель 1 г с 5-го по 25-й день цикла и микронизированный прогестерон 100 мг с 16 по 25-й день вагинально). В перспективе пациентка планирует повторный перенос эмбриона.
В описанном нами случае тромбоз произошел исключительно на фоне высокодозной терапии эстрогенами при отсутствии стимуляции овуляции и СГЯ. Помимо состояния гиперкоагуляции, обусловленного экзогенной гормональной стимуляцией, провоцирующим фактором ТЦВ могли быть отмена профилактической терапии НМГ (эноксапарин 0,4 мл в сутки) в связи с выявлением ретрохориальной гематомы и применение гемостатической терапии.
Тромбофилия в классическом ее понимании, включая мутацию FV Leiden и протромбина G20210A, циркуляцию антифосфолипидных антител, гипергомоцистеинемию, исходный дефицит протеина С, протеина S или антитромбина III, у пациентки выявлена не была. В данном случае мог иметь место синергичный эффект беременности и высоких доз экзогенных эстрогенов в отношении системы гемостаза, что повлекло за собой значительное повышение уровней vWF, FVIII, снижение концентрации ADAMTS13 и транзиторное падение уровней антитромбина III. При этом повышенные уровни FVIII и vWF у пациентки сохранялись по крайней мере до 12 недель беременности несмотря на отмену эстрогенотерапии сразу после подтверждения тромбоза на сроке 6 недель беременности. К 19-й неделе беременности отмечено восстановление концентрации ADAMTS13 (до нижней границы нормы), при этом отмечена циркуляция ингибитора ADAMTS13, которая ранее у пациентки обнаружена не была.
В литературе имеются ссылки на то, что непосредственной причиной ТЦВ может быть повышенный уровень vWF [12]. Кроме того, в одной из работ описаны изменения антигена и активности vWF–ADAMTS 13 в процессе стимуляции овуляции в протоколах ЭКО [13].
Персистирующая головная боль является частым и иногда единственным проявлением ТЦВ. Особой настороженности и углубленного обследования этот симптом требует у пациенток, получающих ОК, при применении ВРТ и во время беременности.
В связи с выявлением на МРТ, помимо ТЦВ, признаков субарахноидального кровоизлияния антикоагулянтная терапия была начата с низких доз НФГ, а затем НМГ. Однако на фоне профилактических доз НМГ (0,4+0,2 мл в сутки с интервалом 12 ч, анти-Ха активность 0,55) развился катетер-ассоциированный тромбоз, что указывает на неэффективность низких доз антикоагулянтов в подобных случаях. Тщательный контроль показателей гемостазиограммы, включая анти-Ха-активность, позволяет обеспечить индивидуализированный подбор безопасной и эффективной антитромботической терапии.
С учетом рецидивирующего характера тромбозов атипичной локализации, развития тромбозов на фоне эстрогенотерапии, риски заместительной гормональной терапии, с нашей точки зрения, являются неприемлемыми. Однако пациентка после детального обсуждения приняла самостоятельное решение о возобновлении приема эстрогенсодержащих препаратов через 5 месяцев после родов на фоне антикоагулянтной терапии варфарином. Данные по безопасности заместительной гормональной терапии у пациенток с венозной тромбоэмболией (ВТЭ) в анамнезе ограничены и получены в основном для тромбозов типичных локализаций – ТГВ и ТЭЛА. Единственное рандомизированное исследование по риску рецидива ВТЭ при применении менопаузальной гормональной терапии (эстрадиол 2 мг + норэтистерона ацетат 1 мг) было завершено досрочно в связи с повышенным риском в группе гормональной терапии (8,5% в год против 1,1% в группе плацебо) [14]. В когортном исследовании (n=1023; 77 рецидивов ВТЭ) было показано, что трансдермальная эстрогенотерапия, в отличие от пероральной вне зависимости от добавления гестагенов, не повышает риск рецидива ВТЭ (1,3% в группе трансдермальной эстрогенотерапии против 1,1% в контрольной группе (ОР 0,9; 95% ДИ 0,4–2,1) [15]. В настоящее время применение трансдермальной терапии рассматривается как наиболее безопасное с точки зрения рецидива ВТЭ [16].
Несмотря на интенсивное внедрение в клиническую практику новых пероральных антикоагулянтов, варфарин остается препаратом выбора у пациентов из группы крайне высокого риска тромботических осложнений (пациенты с искусственными клапанами сердца, с антифосфолипидным синдромом, с рецидивирующими тромбозами). Безопасность заместительной трансдермальной эстрогенотерапии в сочетании с варфарином у пациентки с ТЦВ в анамнезе покажет дальнейшее наблюдение.
Заключение
Использование ВРТ является фактором риска ТЦВ. Провоцирующим фактором может быть не только массивная гормональная нагрузка в условиях стимуляции суперовуляции, но и гиперэстрогения на фоне гормональной поддержки в естественных циклах переноса эмбриона даже при отсутствии классической тромбофилии.
Подбор антикоагулянтной терапии у пациентов с ТЦВ требует тщательной оценки риска прогрессирования тромбоза, тромбозов других локализаций и геморрагических осложнений с учетом частого сочетания с субарахноидальными кровоизлияниями.
Прогнозы на успешное окончание беременности у пациенток с тромбозом церебральных синусов являются благоприятными. Антикоагулянтная терапия в течение беременности, по всей видимости, не только предотвращает рецидивы тромбоза сосудов головного мозга, развитие тромбозов других локализаций, но и обеспечивает профилактику плаценто-ассоциированных акушерских осложнений.



