Совершенствование реанимации и интенсивной терапии глубоконедоношенных новорожденных привело к повышению выживаемости детей с очень низкой массой тела (ОНМТ) и экстремально низкой массой тела (ЭНМТ) при рождении, что повлекло за собой появление новых вопросов, связанных с дальнейшим выхаживанием этих пациентов, а также с диагностикой и терапией особых состояний и заболеваний, встречающихся у данного контингента детей. Одним из таких заболеваний, которое осложняет состояние и развитие глубоконедоношенного ребенка, является метаболическая болезнь костей или остеопения недоношенных [1–4].
Метаболическая болезнь костей недоношенных (МБКН) характеризуется изменениями костей вследствие недостатка минеральных веществ, главным образом кальция и фосфора, и/или витамина D, ассоциированных с недоношенностью [3, 5].
Остеопения развивается у 23–30% детей с ОНМТ и у 31–55% детей с ЭНМТ, при этом частота переломов костей у недоношенных с ЭНМТ может достигать 7–10%, однако, предполагается, что частота остеопении в последние годы снижается [6–8].
До настоящего времени диагностика МБКН продолжает основываться, в основном, на рентгенологических данных. Однако наличие лучевой нагрузки и отсутствие унифицированных рентгенологических критериев остеопении недоношенных затрудняет широкое применение данного метода [1, 4–6, 9]. Ограничение использования рентгенологического метода у недоношенных детей в совокупности с неспецифической клинической картиной и отсутствием четких биохимических маркеров МБКН затрудняет верификацию диагноза.
Цель исследования: определить частоту и представить клинико-диагностическую характеристику МБКН, протекающей с развитием нетравматических переломов.
Материал и методы
Исследование проведено на базе отделений ФГБУ «Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» МЗ РФ в период с января 2013г. по декабрь 2017г. В исследование вошли все недоношенные дети, у которых на фоне МБКН были диагностированы нетравматические переломы. Критерии исключения: дети с синдромальной и наследственной патологией, а также с хирургическими заболеваниями.
В работе учитывались: гестационный возраст (ГВ), масса тела и рост ребенка при рождении, соответствие массы и роста новорожденного гестационному возрасту (по Fenton preterm grows chart, 2013), пол; анализировались данные по питанию (длительность полного парентерального питания, возраст достижения полного энтерального питания, соответствие питания физиологическим потребностям недоношенного), наличие некротизирующего энтероколита нехирургических стадий (НЭК), бронхолегочной дисплазии средне-тяжелой и тяжелой степени (БЛД) и синдрома холестаза.
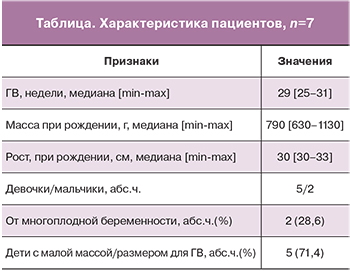
При физикальном осмотре регистрировались клинические признаки МБКН: деформация черепа («башенный» череп, «олимпийский» лоб, уплощение черепа с боков, краниотабес), деформация грудной клетки с образованием Гаррисоновой борозды, относительно короткие конечности, задержка роста.
Диагностика переломов основывалась на рентгенологических методах исследования костей (рентгенография, мультиспиральная компьютерная томография (МСКТ)). Рентгенологические признаки остеопении характеризовались в соответствии с классификацией Koo W.W. et al. (1982–1984): потеря плотности белой линии метафиза и истончение кортекса – «стадия 1», «чашевидные» просветленные метафизы и субпериостальные разрастания – «стадия 2»; переломы на этом фоне – «стадия 3» [4, 5, 10].
Ретроспективно оценивались результаты определения в сыворотке крови уровней общего кальция, фосфора, щелочной фосфатазы (биохимический анализ крови), а также концентрации витамина D (иммуноферментный метод).
Проведен анализ медикаментозной терапии, которая негативно влияет на фосфорно-кальциевый обмен: применение кофеина, фуросемида, дексаметазона, фенобарбитала.
Результаты исследования
За 5 лет наблюдения (2013–2017 гг.) нетравматические переломы вследствие МБКН были диагностированы у 7 недоношенных детей, из них 6 детей были с ЭНМТ и 1 – с ОНМТ (рис. 1).

 Все недоношенные дети с переломами родились до 32 недели гестации, большинство из них были девочками и от одноплодной беременности; отмечался высокий процент новорожденных – 5 (71,4%) – с малым весом/размером для ГВ (таблица).
Все недоношенные дети с переломами родились до 32 недели гестации, большинство из них были девочками и от одноплодной беременности; отмечался высокий процент новорожденных – 5 (71,4%) – с малым весом/размером для ГВ (таблица).
Все обследованные дети получали достаточно длительное полное парентеральное питание – от 9 до 43 суток (медиана 19 суток), являющееся существенным этиопатогенетическим фактором развития МБКН. Расчет кальция для парентерального питания проводился с учетом его уровня в крови. Из-за отсутствия препаратов фосфора для парентерального введения, у всех детей отмечалась гипофосфатемия, коррекция которой становилась возможной лишь с началом энтерального питания. Дотация витамина D при парентеральном питании производилась в составе витаминного раствора для парентерального питания с первого дня жизни в стандартной дозе (160 МЕ/кг/сут., но не более 400 МЕ/сут.).
Полный объем энтерального питания достигался на 20–46 (медиана 31,5) сутки жизни. Энтеральное питание у 4 (57,1%) детей проводилось молочными смесями, у 1 (14,3%) – грудным молоком, у 2 (28,6%) детей вскармливание было смешанным. У 5 (71,4%) недоношенных детей энтеральное питание не в полной мере обеспечивало их физиологические потребности. В связи с перенесенным НЭК и/или интолерантностью к энтеральной нагрузке у 2 детей длительно (в течение 14 дней) использовалась молочная смесь на основе высоко гидролизованного белка, у 3 детей была поздняя и недостаточная фортификация грудного молока.
Дотация витамина D внутрь проводилась всем детям после достижения полного энтерального питания. Дозы витамина D назначались лечащим врачом, они варьировали от 1000 МЕ/сут до 3000 МЕ/сут, в зависимости от клинического состояния ребенка и данных лабораторно-инструментального обследования.
Развитие НЭК (нехирургических стадий) отмечалось у 6 (85,7%) детей; БЛД диагностировались у 3 (42,9%) детей: средне-тяжелое течение – у 2, тяжелое – у 1. Синдром холестаза вследствие длительного парентерального питания был выявлен у 6 (85,7 %) недоношенных.
У всех пациентов, начиная со 2-го месяца жизни, наблюдались клинические признаки МБКН, такие как характерные изменения черепа (рис. 2), рахитическая деформация грудной клетки, укорочение конечностей и задержка роста.
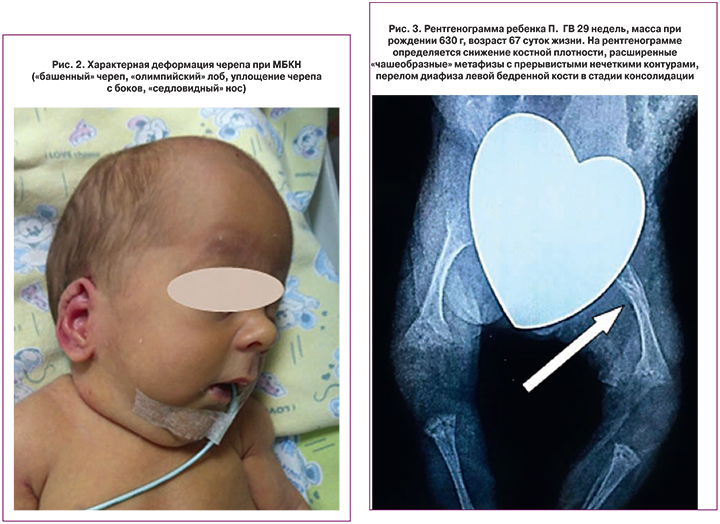
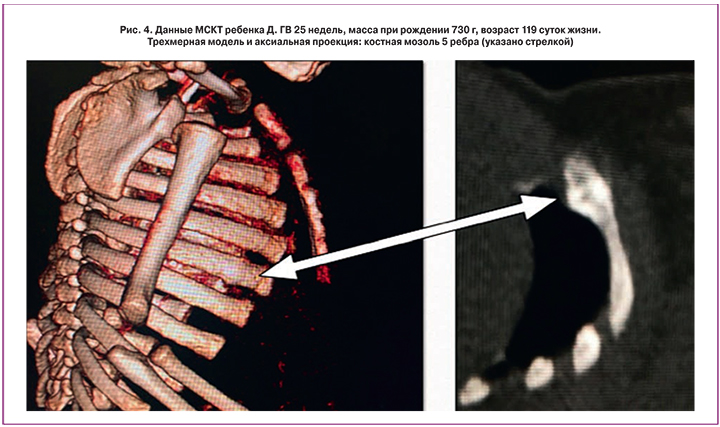
Переломы костей (бедренной, плечевой) непосредственно на стадии их развития были диагностированы у 4 (57,1%) детей в период от 19 до 76 суток жизни. Рентгенография костей в этих случаях выполнялась в связи с подозрением на их перелом (болезненность при пальпации, отек, ограничение движений, выраженное беспокойство ребенка). У 3 (42,8%) детей переломы были диагностированы только на стадии консолидации в возрасте 67, 71 и 119 суток жизни; при этом у 2-х детей консолидированные переломы ребер были выявлены в ходе МСКТ, выполненной по поводу БЛД для оценки структур легких, а у 1 ребенка перелом бедра на стадии консолидации диагностирован при плановой рентгенографии коленных суставов для оценки стадии МБКН. По локализации у обследованных детей отмечались переломы ребер – у 3 (42,9%), переломы бедренной кости – у 3 (42,8%), плечевой – у 2 (28,6%). Несколько переломов наблюдалось у 2 (28,6%) детей: в одном случае – перелом бедренной кости в сочетании с переломом заднего отростка 9 ребра, во втором случае – перелом задних отростков 5–8 ребер. Примеры рентгенографических данных переломов костей у обследованных детей представлены на рис. 3, 4.
Типичная динамика биохимических показателей крови представляла собой выраженную гипофосфатемию на первом месяце жизни, сопровождавшуюся эпизодическим повышением концентрации общего и/или ионизированного кальция крови. Затем, после успешного начала энтерального питания динамика менялась: уровень фосфора приближался к нормальным значениям или нормализовывался, а кальция – часто снижался; на этом фоне уровень щелочной фосфатазы у большинства детей постепенно повышался, достигая максимальных значений в момент перелома. Гипофосфатемия отмечена у всех детей, ее минимальные значения были очень низкими: 0,14–0,30 ммоль/л. Эпизоды гиперкальциемии отмечены у 5 (71,4%) детей, при этом максимальный уровень общего кальция в крови достигал 3,78 ммоль/л. Гипокальциемия в 1,5–2 месяца жизни выявлялась у всех детей, минимальные значения были на уровне 1,4 ммоль/л. Повышение концентрации щелочной фосфатазы отмечено у 5 (71,4%) пациентов до 1254 – 2531 ЕД/л (при условных референсных значениях 50–360 ЕД/л). Типичная динамика сывороточного уровня фосфора, общего кальция и щелочной фосфатазы представлена на рис. 5.

У 5 детей проводился анализ уровня 25(ОН)D в крови в возрасте 57–77 дней жизни. Дефицит витамина D (9,6 нг/мл) наблюдался у 1 ребенка, недостаточность (12,7–28,7 нг/мл) – у 3 детей, нормальный уровень (42,8 нг/мл) – у 1 ребенка. Полученных данных недостаточно для проведения полноценного анализа, однако, можно отметить, что уровень витамина D у наших пациентов значительно варьировал.
Из медикаментозных препаратов, отрицательно влияющих на минерализацию костной ткани, наиболее часто и длительно применялся кофеин (нагрузочная доза 20 мг/кг, поддерживающая – 5–10 мг/кг/сут); кофеин получали все пациенты курсом от 3 до 11 недель (медиана 5,5). Фуросемид назначался только одному ребенку на протяжении 4 дней. Также только один ребенок получал курс дексаметазона на протяжении 8 суток в суммарной дозе 0,85 мг/кг. Фенобарбитал не применялся.
Обсуждение
В нашем исследовании переломы, ассоциированные с МБКН, наблюдались только у глубоконедоношенных детей с массой тела менее 1500 г при рождении. Частота переломов в этой группе составила 2,1%. Частота переломов у детей с ЭНМТ была на уровне 6,25%, у детей с ОНМТ – 0,4%. Как и в других работах, в нашем исследовании в большинстве случаев переломы, ассоциированные с МБКН, встречались у детей с ЭНМТ [5, 6, 11, 12]. Следует отметить, что показатели распространенности МБКН и связанных с ней переломов к настоящему времени снижаются. В исследованиях 1980–90-х годов частота переломов достигала 10,5% – у детей с массой тела менее 1500 г [13] и 17% – у детей с ЭНМТ [14]; в работах 2009–2013 гг. частота переломов у детей с ЭНМТ составляла 7–10% [6, 7]. В последних исследованиях частота переломов костей определялась на уровне 0,6% – у детей с массой тела менее 1500г [2] и 2,5% – у детей с ЭНМТ [11]. Снижение частоты развития остеопении недоношенных происходит благодаря поступательному совершенствованию подходов к энтеральному питанию недоношенных детей: фортификации грудного молока, улучшению формул энтерального питания, более быстрому наращиванию объемов энтерального питания, что происходило и в нашей практике [15, 16].
В отличие от данных Viswanathan S. at all. [6], в нашем исследовании переломы чаще встречались у девочек, однако, возможно это связано с малой выборкой пациентов. В нашем исследовании отмечена высокая частота задержки внутриутробного развития у детей с переломами (71,4%). Задержка развития плода, которая часто возникает вследствие преэклампсии и плацентарной недостаточности, признана существенным фактором риска МБКН [2, 3, 17].
Длительное парентеральное питание признается весомым фактором риска развития МБКН. В работах зарубежных авторов полное парентеральное питание более 4 недель ассоциируется с МБКН [2, 3, 12, 17]. Учитывая отсутствие препаратов фосфора для внутривенного введения в нашей стране, длительность полного парентерального питания более 9 дней уже становится очень высоким фактором риска развития МБКН и переломов, особенно, у детей с ЭНМТ. Соответственно диагноз НЭК, лечение которого требует длительного парентерального питания, будет очень часто ассоциироваться с МБКН. По нашим данным, переломы костей вследствие МБКН в 85,7% случаев сочетались с диагнозом НЭК (нехирургических стадий), в 42,9% – с БЛД (средне-тяжелой и тяжелой) и в 85,7 % – с холестазом. БЛД, которая ассоциируется с недостаточным питанием ребенка, применением метилксантинов, петлевых диуретиков и, особенно, глюкокортикостероидов, в ряде работ отнесена к факторам риска МБКН. Синдром холестаза также признан одним из наиболее значимых факторов риска развития МБКН, вследствие негативного влияния на абсорбцию витамина D, угнетающего действия билирубина и желчных кислот на функцию остеобластов, и, возможно из-за того, что он является маркером тяжести состояния ребенка и длительности парентерального питания [2, 12, 18].
У большинства недоношенных детей с МБКН переломы диагностируются на 2–4 месяцах жизни, когда достигается выраженная деминерализация костей [2, 6]. Особенностью нашего исследования было выявление перелома плечевой кости у одного ребенка в более раннем возрасте (на 19 сутки жизни), а также поздняя диагностика переломов (ребер, бедра) у 3 детей в возрасте 67–119 дней уже на стадии их консолидации. Таким образом, хотя характерным сроком развития переломов костей является период со 2-го по 4-й месяц жизни недоношенного ребенка, но возможно и более раннее развитие перелома, что требует дифференциальной диагностики с, так называемым, «неслучайным переломом» (non-accidental injuries). В нашей работе также показана вероятность пропущенных случаев переломов костей и, следовательно, гиподиагностики МБКН. Данные особенности отражены и другими авторами [2, 5, 7].
У обследованных детей с МБКН преобладали переломы ребер и бедренных костей, реже встречались переломы плечевой кости. Подобная закономерность наблюдалась и в других исследованиях, что, возможно, отражает особенности локализации переломов при МБКН в настоящее время [2, 6, 7]. В более ранних исследованиях при МБКН также наиболее часто встречались переломы ребер, однако, следующими по частоте были переломы лучевой кости, затем плечевой, локтевой, бедренной и реже – других костей [13].
В качестве биохимических маркеров МБКН наиболее часто используют сывороточный уровень фосфора и щелочной фосфатазы, при этом наибольшее значение имеет сочетание низкой концентрации фосфора и повышенного уровня щелочной фосфатазы [3, 9, 17, 18]. В нашем исследовании у всех детей отмечалась выраженная гипофосфатемия, отражающая крайний дефицит поступления фосфора. Дефицит фосфора привел к нарушению формирования гидроксиапатита в костях и развитию переломов на фоне деминерализации костей. У 5 (71,4%) выявлено повышение щелочной фосфатазы; у 2 детей из 7 (28,6%) уровень щелочной фосфатазы не повышался за время госпитализации. На недостаточную прогностическую ценность изолированного повышения уровня щелочной фосфатазы в крови при МБКН обращается внимание и в ряде других работ. С одной стороны, уровень щелочной фосфатазы склонен нарастать у большинства недоношенных детей в течение первых 5–6 недель, с другой стороны, не у всех детей с МБКН данный показатель повышается [8, 19]. В литературе отмечается отрицательное воздействие определенных препаратов на формирование костей у недоношенных детей, таких как кофеин, петлевые диуретики, глюкокортикоиды [3, 4, 20]. В нашей работе оценить влияние данной лекарственной терапии на тяжесть течения МБКН сложно, учитывая небольшую группу пациентов.
Заключение
Нетравматические переломы костей вследствие МБКН наблюдались у 2,1% детей с массой тела при рождении менее 1500г. Наиболее часто данная патология отмечалась у детей с ЭНМТ, достигая 6,25%; у детей с ОНМТ ее встречаемость составила 0,4%. Для развития тяжелой деминерализации костей и переломов имело значение сочетание факторов, таких как ЭНМТ, задержка внутриутробного развития, полное парентеральное питание более 9 дней (без применения препаратов фосфора), НЭК, синдром холестаза и неоптимальное энтеральное питание. Тяжелая гипофосфатемия, которая часто, но не всегда, сочеталась с повышением щелочной фосфатазы была характерным биохимическим признаком МБКН. Наиболее часто при МБКН регистрировались переломы ребер и бедренной кости, реже – переломы плечевой кости. У 42,8% детей была поздняя диагностика на фоне уже консолидированного перелома кости, что указывает на вероятность существования пропущенных случаев МБКН в неонатологической практике.



