Одной из наиболее быстро развивающихся отраслей современной медицины является мини-инвазивная хирургия, начавшая активно развиваться с начала с 1940-х гг., когда для визуализации брюшной полости хирурги стали использовать доступ через задний свод влагалища. Впервые описание хирургического лечения подобным способом было представлено Д.О. Оттом в начале ХХ в. [1]. Постоянная модернизация эндоскопического инструментария и систем передачи изображения создавали условия для расширения объемов эндоскопических вмешательств. Первые публикации об успешно выполненной лапароскопической гистерэктомии, выполненной H. Rich [2], относятся к 1989 г., а уже в 1993 г. D. Nichols [3] представил результаты выполнения лапароскопической тазовой лимфаденэктомии при лечении рака шейки матки (РШМ). Первые реконструктивные вмешательства на матке эндоскопическим доступом были описаны K. Semm и L. Mettler [4]. В начале 1990-х гг. A. Watties [5] предложил лапароскопический вариант абдоминальной сакровагинопексии, впоследствии признанной «золотым стандартом» в лечении апикальных форм генитального пролапса [6]. Несмотря на значимые для практической медицины достижения эндоскопических методов вмешательства, одним из наиболее революционных этапов развития мини-инвазивной хирургии следует признать разработку робототехники, нашедшей за последние 20 лет свое широкое применение в современной хирургии, в том числе и в гинекологии.
Началом повсеместного распространения робот-ассистированной хирургии по всему миру послужил выпуск американской компанией Intuitive Surgical в 1999 г. новой роботизированной системы Da Vinci (DV) [7].
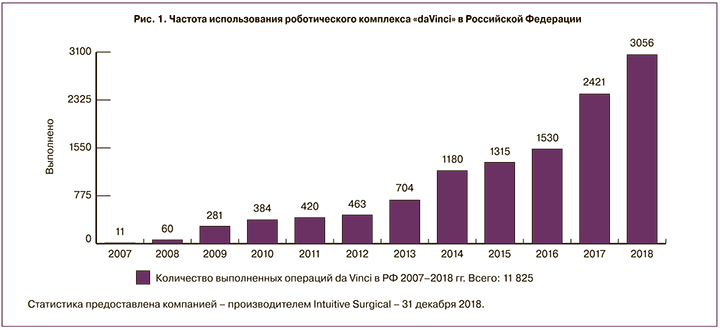
На сегодняшний день, по данным производителя, функционирует около 4400 роботических установок в 64 странах по всему миру. Поскольку данный хирургический комплекс предназначен для оказания оперативных пособий в различных областях медицины, в настоящее время подготовлено и сертифицировано более 43 000 специалистов – консольных хирургов. В РФ установлено 29 подобных роботических комплексов, а первая операция с применением робота DV была выполнена в ноябре 2007 г. в ГУЗ «СОКБ № 1» (Екатеринбург) [8]. Общее число выполняемых с помощью роботического комплекса операций как в мире, так и в РФ ежегодно возрастает. Данные о выполняемых робот-ассистированных операциях представлены на рис. 1.
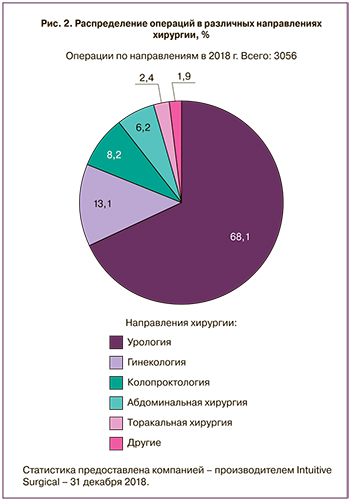 Данные, представленные производителем роботического комплекса, демонстрируют распространенность хирургических вмешательств в различных направлениях хирургии. Сведения о процентном соотношении операций представлены на рис. 2.
Данные, представленные производителем роботического комплекса, демонстрируют распространенность хирургических вмешательств в различных направлениях хирургии. Сведения о процентном соотношении операций представлены на рис. 2.
Материалы и методы
Как видно из представленной диаграммы, наиболее активно операции с использованием DV производятся урологами, составляя 68,1%. В РФ 2-е место среди всех направлений хирургии на протяжении нескольких последних лет остается за гинекологами, выполнившими в 2018 г. 13,1% общего количества вмешательств, при этом практически половина всех гинекологических операций выполнена в МОНИИАГ (200 из 401), а всего опыт института насчитывает 594 подобных хирургических вмешательства. Распределение выполненных операций представлено в табл. 1. В структуре эндоскопических вмешательств в МОНИИАГ роботические операции составляют 14,8%.
Учитывая структуру патологии оперируемых пациенток, мы выделили 3 основные категории операций.
К первой категории вмешательств отнесены пациентки с доброкачественными гинекологическими заболеваниями. В первую очередь с инфильтративными формами эндометриоза и осложненными формами генитального пролапса с недержанием мочи или без него, особенно с морбидным ожирением, хронической обструктивной болезнью легких (ХОБЛ) или другими тяжелыми экстрагенитальными заболеваниями, а также больные с рецидивными формами пролапса гениталий после применения трансвагинальных сетчатых имплантов.
Оперативное лечение пациенток, страдающих инфильтративными формами эндометриоза в сочетании с бесплодием, проводилось совместно с сотрудниками отделения репродуктологии МОНИИАГ. Анализ структуры эндометриоидного поражения органов малого таза у 146 прооперированных пациенток показал, что в 77,6% случаев эндометриоидные инфильтраты располагались в ретроцервикальной области, инфильтрат стенки кишки был диагнострован у 50,3% пациенток, инфильтрат ректовагинальной перегородки – у 23,7%, поражение инфильтратом мочевого пузыря было диагностировано у 6,9% пациенток, поражение мочеточника выявлено у 5,5% больных. Исходя из особенностей расположения определяемых инфильтратов, хирургического анамнеза и индекса массы тела, для 115 пациенток был выбран лапароскопический доступ для оперативного лечения, 31 пациентка прооперирована с использованием роботического комплекса. Информация о длительности операции, кровопотере, частоте осложнений отражена в табл. 2.
К осложнениям оперативного вмешательства были отнесены: вскрытие просвета кишки, формирование гематомы малого таза, задержка мочеиспускания в послеоперационном периоде и необходимость стентирования мочеточников.
Безусловным критерием успеха оперативного лечения у подобных пациенток является частота наступления как спонтанной беременности, так и по программе экстракорпорального оплодотворения (ЭКО). Данные, полученные нами, показали, что суммарная частота наступления спонтанной беременности и в цикле ЭКО в группе с использованием лапароскопии составила 49,56% (57 пациенток из 115). В группе пациенток, оперированных с использованием роботического комплекса, показатели оказались сопоставимыми – 45,16% (14 пациенток из 31).
В результате проведенного исследования нами были определены критерии для использования хирургического комплекса для выполнения реконструктивных оперативных вмешательств у пациенток с поражением стенки кишки эндометриоидным инфильтратом. Согласно нашим данным, показанием к подобному методу лечения является наличие ретроцервикального инфильтрата с поражением параметрия или частичным поражением прямой и сигмовидной кишки без прорастания слизистой, при котором имеются условия для «сбривания» инфильтрата без вскрытия просвета кишки. При тотальном поражении прямой и сигмовидной кишки оптимальным методом лечения является циркулярная резекция кишки с аппаратным анастомозом лапароскопическим доступом, поскольку подобный вид вмешательства технически неудобен во время робот-ассистированной лапароскопии.
Немаловажными факторами, влияющими на репродуктивный прогноз, являлся возраст пациенток, наличие поражения маточных труб и состояние овариального резерва. Нами было выявлено, что наилучшие результаты были достигнуты в группе больных моложе 35 лет. Результаты хирургического леченияпредставлены на рис. 3.

Как видно из представленной на рисунке схемы, в исследование были включены пациентки моложе 35 лет с сохраненным овариальным резервом. Как в группе лапароскопических, так и в группе роботических операций все спонтанные беременности наступили в течение первого года после хирургического вмешательства, при этом частота наступления беременности (ЧНБ) у пациенток с неизмененными маточными трубами в роботической группе превосходила данный показатель в лапароскопической группе и достигала 66%. Всем пациенткам с компрометированными маточными трубами выполнено ЭКО.
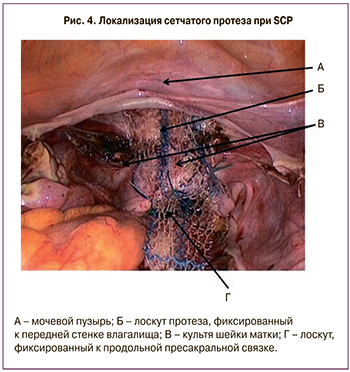 В группе пациенток с доброкачественными заболеваниями органов малого таза встречались и сложные, рецидивные формы генитального пролапса, требующие выполнения сакрокольпопексии (SCP) как для устранения выпадения внутренних половых органов, так и коррекции сопутствующего недержания мочи. В исследование были включены 173 пациентки с пролапсом гениталий II–IV стадии (POP-Q), которым c января 2010 г. по февраль 2015 г. была произведена SCP. В 1-й группе (115 пациенток) была выполнена LsSCP. С 2013 г. стала применяться RASCP, которая была выполнена у 58 пациенток, составивших 2-ю группу. Использовалась стандартная хирургическая техника SCP, методика операции была стандартизирована. После диссекции паравагинальных тканей и выделения продольной пресакральной связки из сетчатого протезa (полипропилен тип I с индексом soft) выкраивали задний лоскут 15×3 см и передний лоскут размером 3×5 см. Лигатурами лоскуты фиксировались к m. pubococcigeus с обеих сторон, крестцово-маточным связкам и задней поверхности шейки матки или купола влагалища, передней стенке влагалища, передней поверхности культи шейки матки или купола влагалища (рис. 4). Свободный конец I лоскута фиксировали к продольной пресакральной связке в состоянии умеренного натяжения.
В группе пациенток с доброкачественными заболеваниями органов малого таза встречались и сложные, рецидивные формы генитального пролапса, требующие выполнения сакрокольпопексии (SCP) как для устранения выпадения внутренних половых органов, так и коррекции сопутствующего недержания мочи. В исследование были включены 173 пациентки с пролапсом гениталий II–IV стадии (POP-Q), которым c января 2010 г. по февраль 2015 г. была произведена SCP. В 1-й группе (115 пациенток) была выполнена LsSCP. С 2013 г. стала применяться RASCP, которая была выполнена у 58 пациенток, составивших 2-ю группу. Использовалась стандартная хирургическая техника SCP, методика операции была стандартизирована. После диссекции паравагинальных тканей и выделения продольной пресакральной связки из сетчатого протезa (полипропилен тип I с индексом soft) выкраивали задний лоскут 15×3 см и передний лоскут размером 3×5 см. Лигатурами лоскуты фиксировались к m. pubococcigeus с обеих сторон, крестцово-маточным связкам и задней поверхности шейки матки или купола влагалища, передней стенке влагалища, передней поверхности культи шейки матки или купола влагалища (рис. 4). Свободный конец I лоскута фиксировали к продольной пресакральной связке в состоянии умеренного натяжения.
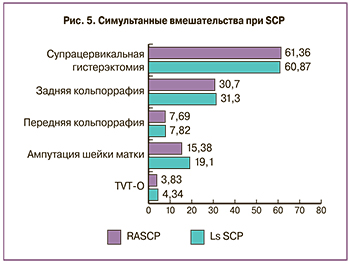 В связи с осложненными формами пролапса гениталий пациенткам, помимо SCP, производился ряд симультанных операций, процентное соотношение которых представлено на рис. 5.
В связи с осложненными формами пролапса гениталий пациенткам, помимо SCP, производился ряд симультанных операций, процентное соотношение которых представлено на рис. 5.
Результаты и обсуждение
Клинические данные о пациентках, прооперированных лапароскопически (1-я группа) и с использованием хирургического робота (2-я группа), представлены в табл. 3. Пациентки в обеих группах были сопоставимы по возрасту, однако число сексуально активных женщин преобладало в 1-й группе. Отличий по паритету, индексу массы тела (ИМТ), числу рецидивных форм генитального пролапса не наблюдалось.
В большинстве случаев в обеих группах производилась супрацервикальная гистерэктомия. У каждой пятой больной (19% случаев в 1-й группе и более 15% случаев – во 2-й) также выполнялась ампутация шейки матки в связи с ее элонгацией. Главная задача состояла в сохранении культи шейки матки и фиксации к ней сетчатого протеза, что позволяло избежать кольпотомии как этапа тотальной гистерэктомии и снизить риск возникновения эрозии влагалища [9, 10].
Длительность пребывания в операционной, анестезиологического пособия, оперативного вмешательства и непосредственно SСP были продолжительнее во 2-й группе (табл. 4).
Интенсивность послеоперационных болей, оцененных по 10-балльной визуальной аналоговой шкале (ВАШ), также была более выражена во 2-й группе (табл. 4).
Отдаленные результаты были прослежены в течение 18±9 месяцев в 1-й группе и 12±6 месяцев – во 2-й. Обследование пациенток проводилось спустя 3, 6, 12 и 24 месяца после операции. Анатомические результаты хирургического лечения через 12 месяцев после операции представлены в табл. 5. Рецидив генитального пролапса, соответствующий III и IV стадиям (POP-Q), отмечен в 3 (5,2%) случаях в 1-й группе. Повторная операция потребовалась 1 пациентке.
Оценивая результаты операций, мы отнесли к недостаткам RASСP лишь только дополнительное время на осуществление установки консоли пациента (докинг). В некоторых источниках литературы отражена значительная разница операционного и анестезиологического времени между LsSСP и RASСP (+67 минут разница; 95% доверительный интервал (ДИ) 43–89; р<0,001*) [11].
Таким образом, к наиболее важным преимуществам RASСP следует отнести: эргономичность работы хирурга, трехмерное изображение, возможность работать в труднодоступных областях малого таза, упрощение наложения хирургических швов. К недостаткам RASСP следует отнести более продолжительное операционное время, продолжительность анестезиологического пособия, более выраженный послеоперационный болевой синдром по сравнению с LsSСP. Областью применения RASCP следует признать коррекцию преимущественно апикального пролапса, так как данная операция является наиболее эффективной и физиологичной, особенно при рецидивных формах патологии.
Больные с выраженным тяжелым морбидным ожирением составили 2-ю и 3-ю группы оперируемых с помощью хирургического комплекса пациенток. Во 2-ю группу вошли пациентки со злокачественными заболеваниями эндометрия в сочетании с морбидным ожирением. Основным показанием к оперативному лечению являлось наличие инвазивного рака эндометрия и РШМ. Все пациентки были консультированы онкоконсилиумом, согласно рекомендациям которого проводилось оперативное лечение в объеме гистерэктомии с расширением объема до тазовой лимфаденэктомии. Особенностями оперативного лечения являлось комфортное для хирурга выполнение лимфодиссекции при наличии сопутствующего повышенного ИМТ. Завершение лечения у этих больных проводилось в онкологических стационарах.
В 3-ю группу были включены пациентки с морбидным ожирением и высоким хирургическим риском, основным показанием к оперативному вмешательству у которых являлись большие размеры опухолей гениталий и атипическое их расположение.
 Поскольку соматически пациентки 2-й и 3-й групп были сопоставимы, следует выделить основные параметры, влияющие на выбор хирургического доступа у этих больных. В первую очередь следует акцентировать внимание на морбидном ожирении, поскольку максимальный ИМТ составлял 75,1, а максимальная масса пациентки – 228 кг. Вторым фактором являлось наличие ХОБЛ в сочетании с другой тяжелой экстрагенитальной патологией у этих больных. Повышенные требования в подобной ситуации относились к квалификации анестезиологической бригады и необходимости использования наркозного аппарата экспертного класса.
Поскольку соматически пациентки 2-й и 3-й групп были сопоставимы, следует выделить основные параметры, влияющие на выбор хирургического доступа у этих больных. В первую очередь следует акцентировать внимание на морбидном ожирении, поскольку максимальный ИМТ составлял 75,1, а максимальная масса пациентки – 228 кг. Вторым фактором являлось наличие ХОБЛ в сочетании с другой тяжелой экстрагенитальной патологией у этих больных. Повышенные требования в подобной ситуации относились к квалификации анестезиологической бригады и необходимости использования наркозного аппарата экспертного класса.
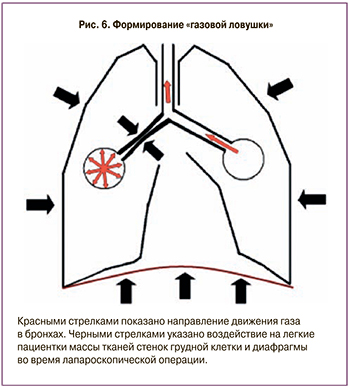
Особенностью эндотрахеального наркоза у подобных пациенток является формирование экспираторного закрытия дыхательных путей (ЭЗДП), так называемая «газовая ловушка», связанная с нарушением эвакуации газа из альвеол вследствие сдавления дыхательных путей (рис. 6). Феномен «газовой ловушки» приводит к нарушению вентиляционно-перфузионного соотношения и увеличению внутрилегочного шунтирования.
Проведение искусственной вентиляции легких (ИВЛ) у таких пациенток осложнено еще и вынужденным положением Тренделенбурга с углом наклона не менее 20°. Особые требования в подобной ситуации предъявляются и к способности операционного стола выдерживать подобную нагрузку. Для предотвращения ЭЗДП и формирования пневмоторакса анестезиологу необходимо создание положительного давления конца выдоха при проведении эндотрахеального наркоза (ЭТН) у подобных пациенток для преодоления компрессии дыхательных путей.
С целью изучения влияния ожирения на исходы эндоскопических операций были обследованы 82 больных с доброкачественными, злокачественными и предраковыми заболеваниями внутренних половых органов. Критериями наличия метаболического синдрома являлись: ИМТ более 40 кг/м2 или более 35 кг/м2 в сочетании с ассоциированными с ожирением заболеваниями: ишемическая болезнь сердца (ИБС), гипертоническая болезнь (ГБ), сердечная недостаточность (СН), сахарный диабет (СД), желчекаменная болезнь, синдром обструктивного апноэ, остеоартрозы.
В основную (1-ю) группу включены 52 пациентки, оперированные с использованием роботического хирургического комплекса, 2-ю (группу сравнения) составили 30 больных с заболеваниями внутренних половых органов, которые имели нормальную массу тела (ИМТ в пределах от 18,5 до 25 кг/м2).
Весо-ростовые показатели больных 1-й и 2-й групп имели достоверные статистические различия. Большинство больных с морбидным ожирением имели массу тела в пределах от 100 до 130 кг (n=35, 67,3%) со средним значением 127,1±19,7 кг и ИМТ в пределах от 40 до 50 кг/м2 (n=34, 65,4%) cо средним значением 48,82±8,0 кг/м2. В группе сравнения средняя масса тела пациенток составляла 64,7±6,4 кг, при этом чаще вес находился в пределах от 60 до 70 кг (n=19,63,3%), а средний ИМТ – 23,1±1,9 кг/м2, с преобладанием значений в диапазоне от 23 до 25 кг/м2 (n=19,63,3%).
Важным представляется анализ структуры экстрагенитальных заболеваний больных. У больных с ожирением отмечена выраженная коморбидность. У всех женщин в 1-й группе наблюдались заболевания сердечно-сосудистой системы, такие как ГБ (100%), ИБС (53,8%), варикозная болезнь нижних конечностей (55,8%). У каждой 2-й больной с ожирением встречались эндокринные заболевания преимущественно в виде СД 2 типа (42,3%), у каждой 3-й – заболевания дыхательной системы преимущественно в виде бронхиальной астмы и ХОБЛ (30,8%). Среди сопутствующих заболеваний у пациенток с нормальным весом лидирующую позицию занимали анемии различной степени (33,3%), что связано с наличием симптомной миомы матки.
При объективной оценке состояния больных и риска анестезиологического пособия по шкале ASA также подтверждалась выраженная статистически значимая коморбидность больных с ожирением. Результаты оценки анестезиологического риска представлены в табл. 6.
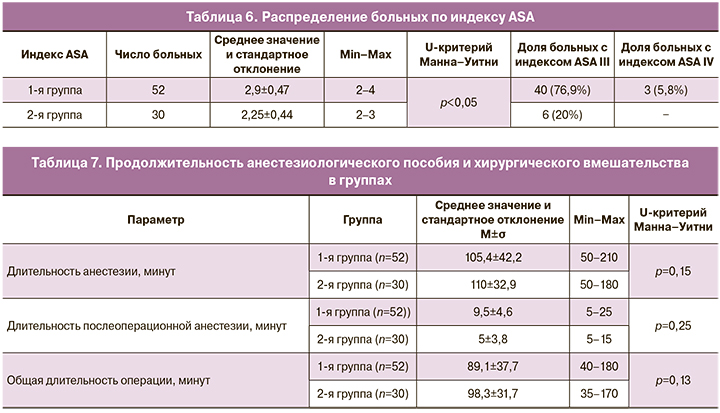
Результаты сравнительной оценки по длительности анестезиологического пособия и оперативного лечения у больных с ожирением и нормальной массой тела представлены в табл. 7.
Как видно из таблицы, мы не выявили корреляционной зависимости между продолжительностью анестезиологического пособия, длительностью операции и индексом массы тела больных. По объему кровопотери также не было выявлено статистически значимой разницы между больными с ожирением и нормальной массой тела.
Для сравнения частоты осложнений гистерэктомии у пациенток с морбидным ожирением мы провели сравнение изучаемых групп с данными работы отделения эндоскопической хирургии МОНИИАГ за аналогичный период времени. Данные о частоте интра- и послеоперационных осложнений представлены в табл. 8.
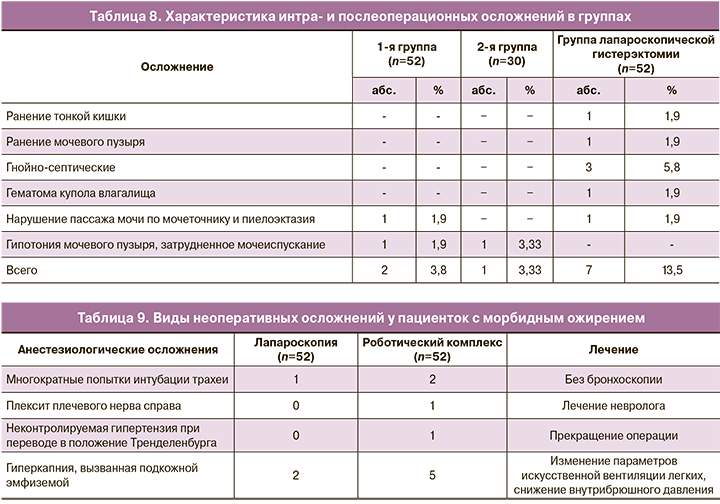
Полученные результаты показывают, что у больных с морбидным ожирением, оперированных лапароскопически, была зарегистрирована более высокая частота осложнений, чем у пациенток с нормальным телосложением: 13,5% (n=7) и 3,33% (n=1) соответственно. При этом частота осложнений у пациенток с ожирением в группе робот-ассистированных лапароскопий составила 3,8%, что значительно ниже, чем в группе с применением лапароскопий. Наличие осложнений у пациенток, оперированных с помощью роботического комплекса, обусловлено в том числе большим объемом оперативного вмешательства. Данные показатели были сопоставимы с частотой осложнений в группе пациенток с нормальным ИМТ. Однако во всех группах были только легкие и среднетяжелые осложнения. Не было зафиксировано ни одного случая тяжелого осложнения, дыхательных и кардиоваскулярных нарушений.
Проведенный анализ анестезиологических или неоперативных осложнений представлен в табл. 9.
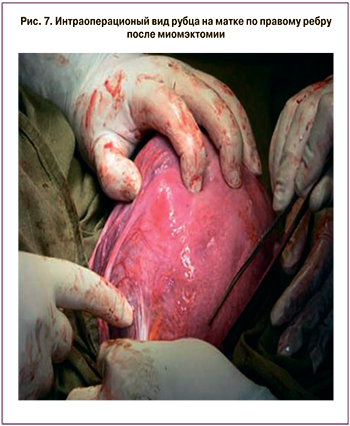 Спектр хирургических пособий, выполняемых с помощью роботического комплекса, можно дополнить реконструктивными операциями на матке. В первую очередь это миомэктомии (всего 11 операций), пластики несостоятельного рубца на матке на этапе планирования беременности (всего 5 операций) и прегравидарный циркляж матки. Наш опыт показывает, что выполнение прегравидарного циркляжа матки роботическим доступом не имеет преимуществ в сравнении с лапароскопическим пособием. Оценивая особенности выполнения миомэктомии и метропластики, мы обнаружили, что наложение интракорпоральных швов с помощью роботического комплекса позволяет прецизионно выполнять миорафию, особенно в некомфортных анатомических областях. Изучая исходы реконструктивных операций, выполненных роботическим доступом, мы не выявили признаков несостоятельности рубцов на матке как после миомэктомии, так и после метропластики. Все прооперированные пациентки были родоразрешены при доношенном сроке гестации. На рис. 7 представлен вид матки после извлечения плода у пациентки с роботическим удалением атипичного узла миомы диаметром 8 см на прегравидарном этапе.
Спектр хирургических пособий, выполняемых с помощью роботического комплекса, можно дополнить реконструктивными операциями на матке. В первую очередь это миомэктомии (всего 11 операций), пластики несостоятельного рубца на матке на этапе планирования беременности (всего 5 операций) и прегравидарный циркляж матки. Наш опыт показывает, что выполнение прегравидарного циркляжа матки роботическим доступом не имеет преимуществ в сравнении с лапароскопическим пособием. Оценивая особенности выполнения миомэктомии и метропластики, мы обнаружили, что наложение интракорпоральных швов с помощью роботического комплекса позволяет прецизионно выполнять миорафию, особенно в некомфортных анатомических областях. Изучая исходы реконструктивных операций, выполненных роботическим доступом, мы не выявили признаков несостоятельности рубцов на матке как после миомэктомии, так и после метропластики. Все прооперированные пациентки были родоразрешены при доношенном сроке гестации. На рис. 7 представлен вид матки после извлечения плода у пациентки с роботическим удалением атипичного узла миомы диаметром 8 см на прегравидарном этапе.
Анализ полученных нами результатов оперативного лечения позволил сформулировать относительные противопоказания к использованию роботического комплекса в гинекологии. Это в первую очередь многочисленные оперативные вмешательства в анамнезе и выраженный спаечный процесс брюшной полости. Дискутабельным является применение роботического доступа у пациенток с низкой массой тела в связи с коллизией инструментов, требующих дистанции портов не менее 8 см. Вероятно, следующее поколение инструментов и самой системы позволит использовать инструменты меньшего диаметра и иной путь докинга, в сочетании однопортовым доступом, что позволит выполнять подобные вмешательства у пациенток с низким ИМТ. По данным литературных источников, данные операции могут быть малоцелесообразны при РШМ и не показаны при раке яичников.
Заключение
Робот-ассистированная хирургия обладает безусловными преимуществами в хирургическом лечении сложных гинекологических заболеваний не только злокачественного характера, но и доброкачественных, в первую очередь сочетанных форм тяжелого инфильтративного эндометриоза (позволяющего в определенных ситуациях существенно повлиять на восстановление репродуктивной функции пациентки).
Современная система оказания хирургической помощи в комплексе роботической системы Da Vinci в сочетании с высокотехнологичным анестезиологическим обеспечением позволяет решать наиболее сложные проблемы хирургического лечения больных с тяжелой экстрагенитальной патологией (морбидным ожирением, хроническими обструктивными заболеваниями легких, сердечно-сосудистыми заболеваниями, особенно в сочетании с высоким ИМТ).
У больных со злокачественными заболеваниями внутренних половых органов использование комплекса Da Vinci целесообразно при раке эндометрия, однако в случае РШМ преимущество следует отдавать открытой хирургии, при этом эндоскопические методы информативны для стадирования заболевания.
Безусловно преимущественным по сравнению со всеми имеющимися методами лечения тяжелого пролапса гениталий в сочетании с недержанием мочи и без такового является использование роботической хирургии, особенно у женщин с рецидивными формами пролапса.
Комплекс Da Vinci должен использоваться в сочетании с высокотехнологичным анестезиологическим пособием. Именно при таком сочетании обеспечивается благоприятный исход как операции, так и наркоза.



