Актуальность
Лечение пациентов с отеком головного мозга остается сложной и нерешенной задачей до настоящего времени. Отек головного мозга (ОГМ), развивающийся у тяжелых пациентов не только с первичным повреждением мозга, но и с различными экстракраниальными процессами, представляет одну из главных проблем ведения реанимационных больных. Предлагаемое на сегодня лечение акцентировано преимущественно на осложнении ОГМ – внутричерепной гипертензии (ВЧГ), а не на ранних этапах развития отека [1, 2]. Успехи молекулярной биологии и экспериментальных исследований позволили начать разработку препаратов, действие которых направлено на ферменты, рецепторы, ионные каналы, задействованные в формировании ОГМ [2–5]. Это таргетное лечение, нацеленное на ранние фазы развития отека, вероятно, и будет определяющим направлением в борьбе с ОГМ в будущем.
Современные подходы к лечению ОГМ
Применяемые в наше время методы лечения ОГМ ориентированы на снижение внутричерепного давления (ВЧД). Достигается это с помощью гиперосмолярной терапии, коротких эпизодов гипервентиляции, отведения цереброспинальной жидкости, декомпрессионной трепанации черепа, подавления метаболизма мозга [6–8].
Убедительных рекомендаций по лечению ОГМ и ВЧГ, основанных на доказательной базе, в настоящее время не существует. В последнем руководстве по лечению ОГМ у пациентов с тяжелой церебральной патологией (Guidelines for the acute treatment of cerebral edema in neurocritical care patients, 2020) большинство предлагаемых рекомендаций оцениваются экспертами как условные с очень низким качеством доказательств или же базирующиеся только на результатах успешной практической деятельности [9]. В то же время выделено и несколько «сильных рекомендаций» к которым относятся:
- отказ от применения на догоспитальном этапе гиперосмолярной терапии;
- отказ от назначения глюкокортикостероидов (ГКС) при геморрагическом инсульте;
- применение коротких курсов гипервентиляции в отношении пациентов с резким повышением ВЧД;
- назначение ГКС при бактериальном, в т.ч. и туберкулезном, менингите [9].
Гиперосмолярная терапия ОГМ
Гиперосмолярная терапия является наиболее применяемой в лечении ОГМ у пациентов с разной ургентной патологией, такой как черепно-мозговая травма (ЧМТ), ишемический инсульт (ИИ), внутричерепные кровоизлияния, печеночная энцефалопатия [9–12]. Основным механизмом действия гиперосмолярной терапии является создание осмолярного градиента между тканями мозга и сосудистым руслом, что обеспечивает выход жидкости из полости черепа и приводит к снижению ВЧД [10, 13].
К данному виду терапии при ОГМ относятся гипертонический раствор хлорида натрия (ГРН) – 3,0%, 7,5, а также 23,4% и маннитол (в концентрациях от 5 до 25%) [9, 10, 13, 14]. Действие ГРН начинается через 5 минут и продолжается до 12 часов. Временные рамки эффективного воздействия маннитола на ВЧД составляют 10–20 минут (от начала введения) и продолжаются до 4–6 часов [13]. Высказываются осторожные мнения, согласно которым терапия ГРН может превосходить маннитол в снижении ВЧД, в частности, у пациентов с тяжелой ЧМТ [15]. Однако по результатам последнего крупного анализа эффективность их в отношении снижения ВЧД и ОГМ приблизительно одинаковая [9]. В связи с этим в отсутствие адекватного ответа на один из представителей гиперосмолярной терапии эксперты рекомендуют применение другого. В частности, при ИИ и ЧМТ отсутствие эффекта от маннитола не исключает наличия противоотечного ответа на применение ГРН [9]. Следует заметить, что, по заключению А.А. Галушко и А.М. Богдан, вводить маннитол целесообразно только в первые трое суток от развития инсульта, позже не имеет смысла [14].
Четких рекомендаций по выбору дозы осмотических агентов не существует [9]. Индивидуальный подбор определяется тяжестью процесса, фоновыми и сопутствующими заболеваниями. В качестве ориентировочных доз в литературе предлагаются 0,25–1,5 г/кг 15%, 20%, 25% маннитола, 4 мл/кг или 150–250 мл 3%-ного ГРН, 0,5 мл/кг 10%-ного ГРН и 30 мл 23,4%-ного ГРН [8, 13].
При применении гиперосмолярной терапии необходимо оценивать не только ее эффективность, но и безопасность. Данная терапия может осложниться развитием электролитного дисбаланса, метаболического ацидоза, острого повреждения почек (ОПП), нарушениями со стороны сердечно-сосудистой и дыхательной систем [9, 13, 14, 16]. Гиперосмолярная терапия может приводить к повтороному повышению ВЧД («феномен рикошета»). Однако данные по распространенности этого потенциального побочного эффекта весьма ограниченны [13] и при правильном применении указанных препаратов подобного осложнения можно избежать.
Первоначальный выбор гиперосмолярного агента зависит от концентрации натрия. При гипернатриемии предпочтение отдается маннитолу, тогда как при гиповолемии, артериальной гипотензии и наличии преморбидной патологии почек лучше начинать с ГРН [9, 13]. Остро возникшая гипернатриемия на фоне быстрого введения ГРН, особенно у лиц с хронической гипонатриемией, может приводить к развитию центрального понтийного миелинолиза [13]. Данный процесс, заключающийся в демиелинизации проводящих путей на уровне моста мозга, приводит к значительным неврологическим осложнениям. Опасным в плане нарастания ОГМ является не только повышение концентрации натрия, но и гипонатриемия (менее 135 мэкв/л) [9]. Гиперхлоремия способна вызывать метаболический ацидоз, который может стимулировать респираторные расстройства [9]. При введении ГРН в периферическую вену возможно развитие ишемии тканей, местного тромбофлебита и тромбоза [13]. ГРН выше 3% и раствор маннитола более 15% рекомендуется вводить только через центральную вену [8, 13].
Следует также отметить, что в инструкции по применению маннитола его введение противопоказано при наличии геморрагического инсульта и субарахноидального кровоизлияния, но допустимо при проведении трепанации у пациентов с указанной патологией [17].
Наиболее тяжелым осложнением гиперосмолярной терапии является ОПП. Для диагностики этого состояния используются критерии KDIGO (Kidney Disease: Improving Global Outcomes): повышение концентрации креатинина в сыворотке на 26,5 мкмоль/л и более в течение 48 часов; или повышение концентрации креатинина в 1,5 раза и более по сравнению с исходным уровнем (если таковой известен, или предполагается, что это произошло в течение предшествовавших семи дней); или объем мочи менее 0,5 мл/кг/ч за 6 часов [18].
Маннитол-ассоциированное ОПП отмечается у 6–12% пациентов, в основном имеющих сердечную недостаточность, сахарный диабет, предшествующую почечную дисфункцию и тяжелое течение основного заболевания [9, 14, 19]. Предполагается, что токсическое действие маннитола на почки зависит от его концентрации в сыворотке. Косвенным показателем концентрации считается осмолярность, а показателем токсичности – осмолярный зазор (osmolar gap). Осмолярный зазор представляет собой разницу между измеряемой с помощью осмометра и рассчитанной по формуле осмолярностью. В норме эта разница не превышает 10 мОсм/л [9, 13, 18, 20]. Следует избегать введения маннитола, когда осмолярность сыворотки более 320 и осмолярный зазор более 20 мОсм/л [13, 20].
Для снижения риска ОПП на фоне применения ГРН предлагается удерживать уровень натрия в сыворотке крови не выше 155–160 и хлорида не более 110–115 мэкв/л [9]. Кроме того, замечено, что ОПП чаще наблюдалось в когорте пациентов с непрерывной инфузией по сравнению с болюсным введением 3%-ного раствора хлорида натрия [9]. В связи с этим авторы рекомендуют использовать болюсное введение ГРН, ориентируясь не только на достижение уровня натрия в сыворотке до целевых значений – 145–155 мэкв/л, но и на клиническую симптоматику [9].
Резюмируя вышеизложенное, следует подчеркнуть, что гиперосмолярная терапия не оказывает профилактического действия на развитие ОГМ, назначают ее только при наличии признаков повышения ВЧД. С учетом возможности развития побочных эффектов проводиться гиперосмолярная терапия должна под тщательным контролем способов, скорости, концентрации введения, мониторированием показателей гомеостаза, уровня электролитов в сыворотке, осмолярности, осмолярного зазора. Весьма желательно осуществлять мониторинг ВЧД, а также электрокардиограммы и электроэнцефалограммы [13].
Глюкокортикостероиды
Положительный эффект ГКС на уменьшение ОГМ/ВЧД проявляется преимущественно у пациентов с опухолью головного мозга. Из этой группы препаратов чаще всего применяется дексаметазон. Его действие направлено на поддержание стабильности гематоэнцефалического барьера путем ослабления воспалительных реакций цитокинов и хемокинов, способных разрушать данный барьер, а также путем оказания регулирующего влияния на концентрацию веществ, изменяющих проницаемость барьера, таких как ангио-поэтин-1 и васкулоэндотелиальный фактор роста [3].
Противоотечный эффект дексаметазона в сочетании с уменьшением числа осложнений (в частности, снижения слуха) отмечен и у больных бактериальным менингитом, которым назначали данный препарат по 10 мг каждые 6 часов в течение 4 дней [21]. Прием ГКС лицами с туберкулезным менингитом способствовал снижению частоты летальных исходов [22]. Назначать дексаметазон пациентам с бактериальным менингитом следует за 15–20 минут до или вместе с первой дозой антибиотика [9, 23].
Короткий курс гипервентиляции
Назначается при резком повышении ВЧД. Данная стратегия подтверждена обширным практическим опытом. Метод основан на развитии церебральной вазоконстрикции и уменьшении притока крови в полость черепа, что достигается снижением парциального давления углекислого газа (РаСО2) на фоне гипервентиляции. При применении этой методики необходим контроль церебрального кровотока и степени снижения РаСО2 (рекомендуется не ниже 28–33 мм рт.ст.) из-за риска падения церебральной перфузии [8, 9]. Эффект данной процедуры кратковременный, и ее рассматривают как переходный «мост» к дальнейшей тактике лечения, в основном хирургической [24].
Отведение цереброспинальной жидкости
Данный способ снижения ВЧГ проводится только через наружный вентрикулярный дренаж под контролем ВЧД [8, 9]. Вентрикулостомия является основным методом лечения обструктивной гидроцефалии, развившейся в результате инфаркта мозжечка. Нередко при данной патологии в последующем прибегают к декомпрессии задней черепной ямки [24, 25].
Декомпрессивная трепанация черепа
Применяется в отношении тяжелых пациентов с рефрактерной ВЧГ. Это хирургическое воздействие уменьшает ВЧД только при наличии большого размера трепанационного отверстия (не менее 12×15 см) и при расширении подоболочечного пространства во время пластики твердой мозговой оболочки. [8, 26]. Метод способствует снижению летальных исходов, но мало влияет на восстановление функциональных возможностей, поэтому его применение остается спорным, в частности при ЧМТ [26]. В то же время декомпрессия черепа признается единственным эффективным способом лечения пациентов со злокачественным течением инфаркта мозга, что было продемонстрировано в исследованиях DESTINY, HAMLET, DECIMAL. Если операция проводится в первые 48 часов от развития инсульта, это способствует не только сохранению жизни, но и улучшению функционального исхода [24, 27].
Методы, основанные на подавлении метаболизма мозга
Снижение скорости обмена веществ в мозге приводит к сокращению мозгового кровотока, следовательно – к уменьшению ВЧД. Достигается это препаратами, используемыми при анестезии (пропофол, фенобарбитал), и гипотермией. Применяются эти методы при резистентности к другим способам снижения ВЧД и не назначаются с профилактической целью. Понижение температуры тела до 32–34°С может снизить ВЧД на 10 мм рт.ст. Однако такие осложнения, как пневмония, коагулопатия, брадикардия, электролитные нарушения и возможность нарастания ОГМ на фоне согревания, лишают данный метод широкого применения [16]. Эффективность гипотермии при ИИ и ЧМТ не доказана [24, 27]. Снизить метаболические потребности мозга можно также путем устранения двигательного возбуждения и судорог, купирования боли, ликвидации гипертермии [2, 8, 16, 25].
Дополнительные методы, применяемые для снижения ВЧД
В практической медицине с целью снижения ВЧД используются методы, не нашедшие подтверждения в доказательной медицине, но широко применяющиеся в качестве базисной терапии при лечении ургентных пациентов в реанимационных отделениях. Среди этих методов следует отметить подъем изголовья кровати, контроль и при необходимости снижение внутригрудного и внутрибрюшного давления, адекватное обезболивание и седацию.
Оптимальным считается подъем изголовья кровати на 30 градусов (но не более 45 градусов). Показано, что дальнейшее увеличение угла подъема головы может увеличить ВЧД и снизить церебральное перфузионное давление [9, 28]. Необходимо следить за тем, чтобы при подъеме головы не происходило ее сгибания, приводящего к сдавливанию яремных вен [25].
Контроль проходимости дыхательных путей, синхронизации с аппаратом искусственной вентиляции легких, пневматизации кишечника, эвакуации содержимого из желудка, кишечника и мочевого пузыря способствует поддержанию не только внутрибрюшного и внутригрудного давления, но и связанного с ними ВЧД [18, 25].
Будущее в лечении ОГМ
Основатель патофизиологической классификации ОГМ I. Klatzo, поделивший отек на два основных вида (цитотоксический и вазогенный), подчеркивал, что «…необходимо понимать патофизиологию патологических процессов в мозге. Только в этом случае терапевтическое воздействие будет эффективным». Г.И. Мчедлишвили и И.В. Ганнушкина добавляли необходимость разобраться в том, какие процессы приводят к развитию ОГМ, а какие участвуют в его ликвидации [29]. В современных обзорных статьях отражены достижения в понимании молекулярных механизмов формирования ОГМ и выделены потенциальные мишени (ионные каналы, дополнительные переносчики, ферменты, рецепторы, пептидные факторы), на которые направлены многообещающие терапевтические стратегии [2–5, 30–32]. Однако R.M. Jha et al. констатируют, что наше понимание молекулярных механизмов образования ОГМ еще находится в зачаточном состоянии [2].
Разработки таргетной терапии ОГМ
На основании экспериментальных данных с созданием относительно «чистых» моделей цитотоксического и вазогенного ОГМ предполагается таргетная терапия того или иного вида отека [3–5]. Кроме заново создаваемых противоотечных фармакологических средств изучается возможность целевого воздействия на ключевые молекулярные события развития ОГМ и ранее применяемых, но с иной целью медикаментов, таких как диуретик буметанид и антидиабетический препарат глибенкламид [33–35]. S. Michinaga и Y. Koyama кандидатами в антивазогенные противоотечные препараты рассматривают ингибиторы матриксных металлопротеиназ (ММП), ингибиторы васкулоэндотелиального фактора роста (VEGF), антагонисты эндотелиальных рецепторов (ETB-R), активаторы глюкокортикоидных рецепторов (дексаметазон). К антицитотоксическим противоотечным лекарственным средствам указанные авторы относят ингибиторы ионного контранспортера1 NKCC1 (буметанид), ингибиторы неселективных катионных каналов, регулируемых рецептором сульфонилмочевины 1, SUR1-regulated NCCa-ATP (глибенкламид) [3].
Буметанид в низких дозах рассматривается как специфический ингибитор NKCC1-каналов, который активируется при острой патологии мозга и способствует образованию ОГМ [35]. Применять этот препарат следует на ранних стадиях формирования ОГМ, когда еще не наступил выраженный дефицит аденозинтрифосфата (АТФ) [35]. При дефиците АТФ создаются заново и открываются SUR1-regulated NCCa-ATP-каналы, способствуя притоку натрия и нарастанию ОГМ [31, 33]. Активированные SUR1 рецепторы объединяются с порообразующими субъединицами, в частности с Trpm 4, образуя новый Sur1-Trpm4-канал. Его формирование в условиях патологии делает его идеальной мишенью для терапевтического вмешательства [2]. Впервые связь этого канала с ОГМ показана J.M. Simard et al. на экспериментальных моделях ИИ [34]; в настоящее время подобный альянс выявлен и при других заболеваниях, в частности при ЧМТ [36–38].
Применение глибенкламида при ОГМ
Ингибировать рецепторы SUR1 можно низкими дозами глибенкламида [34]. На экспериментальных моделях инсульта у крыс было выделено «терапевтическое окно» введения глибенкламида – 6–10 часов от момента наступления ишемии [39]. Выявленные дополнительные противоотечное и нейропротективное свойства длительно и успешно применяемого в клинической практике противодиабетического препарата глибенкламида [40, 41], успешные результаты доклинических исследований [30, 34, 42] позволили перейти к клиническому испытанию этого препарата.
К настоящему времени глибенкламид – единственный из предполагаемых таргетных препаратов, применение которого проверено в клиническом испытании пациентов со злокачественным инсультом, осложненным ОГМ – GAMES (Glyburide Advantage in Malignant Edema and Stroke). На первом этапе в пилотном исследовании участвовали 10 пациентов с обширным (более 100 см3) ИИ в каротидной системе [43]. Специально разработанную внутривенную форму глибенкламида вводили в течение 72 часов в малых дозах (3 мг/сут.). Выжили 9 больных из 10. Малые дозы позволили избежать развития эпизодов гипогликемии и проблем с сердечно-сосудистой системой [44]. Вторым этапом было двойное слепое плацебо-контролируемое многоцентровое исследование 83 пациентов с ИИ, рандомизированных в 2 группы, одна из которых получала глибенкламид, другая – плацебо [45]. Статистически достоверных отличий между группами по частоте основных исходов (эффективность и безопасность) выявлено не было. Однако такие косвенные признаки ОГМ, как смещение структур мозга, отмеченное при нейровизуализации, и концентрация в крови ММП-9, были достоверно ниже в группе, получавшей глибенкламид [46, 47]. Среди умерших пациентов ОГМ наблюдался почти в 10 раз чаще в группе плацебо, чем у тех, кто получал глибенкламид (22,2 и 2,4% соответственно) [48]. В настоящее время продолжается субанализ исследования GAMES с целью конкретизации показаний к назначению глибенкламида в зависимости от возраста пациента, зоны поражения. Остаются неуточненными дозы и сроки введения препарата.
Хорошие результаты применения глибенкламида показаны и в клинических исследованиях пациентов с ЧМТ. Отмечено улучшение исходов у пациентов с диффузным аксональным повреждением [36]. В Иранском рандомизированном исследовании [37] продемонстрировано уменьшение скорости и объема расширения зоны ушиба на фоне применения 10 мг глибенкламида в течение 10 дней по сравнению с пациентами, не получавшими этот препарат. Однако оценки влияния препарата на ОГМ в указанных исследованиях не проводилось.
Кроме специальной внутривенной формы глибенкламида имеются сведения по применению доступной пероральной формы этого препарата [37, 49]. Т. Pallan и I. Ahmed вводили глибенкламид через желудочный зонд для кормления 7 реанимационных пациентов (у 3 был инсульт, у 2 – ЧМТ и у 2 – грибковый менингит на фоне ВИЧ-инфекции), имевших высокое ВЧД и умеренную гипергликемию [49]. Глибенкламид начали применять после неэффективной попытки снижения ВЧД маннитолом и стероидами. Препарат вводили в течение двух дней, начинали с 2,5 мг и постепенно увеличивали дозу максимально до 12,5 мг. Через 2 дня применения глибенкламида средняя величина ВЧД снизилась с 32 до 12 мм рт.ст. [49]. Перспективной для лечения ОГМ и ВЧГ можно рассматривать микронизированную форму препарата, которая по биодоступности близка к внутривенному введению [1]. Специалисты считают, что еще одним плюсом к назначению глибенкламида тяжелым реанимационным больным является его способность ограничивать повреждения почек, кишечника и легких, развивающиеся в рамках постреанимационной болезни [1].
При назначении глибенкламида необходимо контролировать уровень гликемии, состояние сердечно-сосудистой системы и функции печени [1]. Авторы обзора по применению глибенкламида при ОГМ считают, что перспективным может быть создание нового препарата сульфонилмочевины, который бы избирательно влиял на SUR1-NCCa-ATP в головном мозге и не влиял на каналы SUR1-KATP в миокарде [1].
Сложности на пути разработки и внедрения таргетной терапии ОГМ
R.M. Jha et al. предполагают, что многоцелевой подход с воздействием на различные мишени (Sur1-Trpm4, аквапорин, VEGF и MMП-9) может оказаться более эффективным, чем воздействие только на одну цель. Авторы исследования сомневаются относительно избирательного лечения вазогенного и цитотоксического отека, т.к. молекулярные процессы, приводящие к развитию этих видов ОГМ, взаимосвязаны [2].
Важно отметить, что нередко одни и те же биологически активные вещества могут оказывать противоположные действия, внося сложность в назначение целевого лечения пациентов с ОГМ.
В доклинических испытаниях показано, что подобно двуликому Янусу VEGF-А может оказывать разнонаправленные действия на поврежденный мозг, что зависит от времени его активации [2, 50]. Активация VEGF-А в раннюю фазу поражения мозга приводит к снижению синтеза белков межклеточных плотных контактов эндотелия и к усилению ОГМ, но позже этот пептид требуется для восстановления нейронов [2, 5, 50, 51]. Подобные противоположные эффекты выявлены и у аквапорина 4. Его экспресcия способствует развитию ОГМ в фазу цитотоксического отека, но аквапорин 4 также участвует в разрешении отека и его блокирование приводит к замедлению саногенетических процессов, направленных на ликвидацию ОГМ [3, 5, 52].
Основные направления лечения пациентов с ОГМ в зависимости от периода формирования и присоединения осложнения – ВЧГ
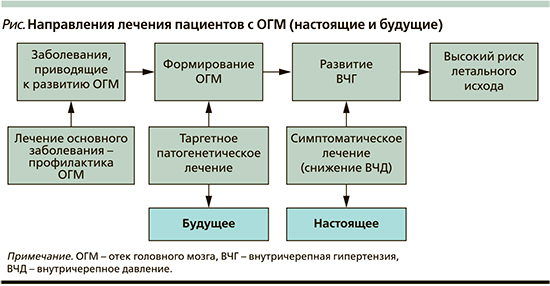 Анализ литературы позволяет суммировать возможные направления лечения в зависимости от фаз развития ОГМ, что схематически представлено на рисунке. В период, предшествовавший развитию ОГМ, большое значение имеет правильная диагностика и адекватное этиопатогенетическое лечение заболевания, потенциально опасного для развития ОГМ. Как показывает практика, привести к ОГМ может любой соматический и церебральный процесс. Данное направление лечения можно рассматривать как профилактическое относительно ОГМ. Во время формирования ОГМ, характеризующегося молекулярно-биологическими нарушениями, основным направлением, вероятно, будет таргетное лечение, нацеленное на имеющиеся ультраструктурные поломки. Применяемое в настоящее время симптоматическое лечение – это борьба не с самим ОГМ, а с его осложнением в виде повышения ВЧД. В этом состоянии лечение не всегда бывает эффективным из-за формирования необратимых изменений в мозге.
Анализ литературы позволяет суммировать возможные направления лечения в зависимости от фаз развития ОГМ, что схематически представлено на рисунке. В период, предшествовавший развитию ОГМ, большое значение имеет правильная диагностика и адекватное этиопатогенетическое лечение заболевания, потенциально опасного для развития ОГМ. Как показывает практика, привести к ОГМ может любой соматический и церебральный процесс. Данное направление лечения можно рассматривать как профилактическое относительно ОГМ. Во время формирования ОГМ, характеризующегося молекулярно-биологическими нарушениями, основным направлением, вероятно, будет таргетное лечение, нацеленное на имеющиеся ультраструктурные поломки. Применяемое в настоящее время симптоматическое лечение – это борьба не с самим ОГМ, а с его осложнением в виде повышения ВЧД. В этом состоянии лечение не всегда бывает эффективным из-за формирования необратимых изменений в мозге.
Заключение
Таким образом, как сам ОГМ, так и его лечение остаются нерешенной задачей. Формируется ОГМ не одновременно с фоновым процессом, а отсроченно, что диктует необходимость проведения своевременной диагностики и адекватного этиопатогенетческого лечения основного заболевания с целью предотвращения развития отека. Проводимое в настоящее время симптоматическое лечение ВЧГ вряд ли можно признать оптимальным способом разрешения проблемы. Будущая стратегия лечения ориентирована на целевую коррекцию тонких молекулярных механизмов, запускающих процесс формирования ОГМ.



