Введение
Щитовидная железа (ЩЖ) – орган, особенно уязвимый в плане воздействия различных внешних факторов, что проявляется изменениями в ее функционировании и физиологической регуляции деятельности. К одним из наиболее частых проявлений нарушения функции ЩЖ относится гипотиреоз (ГТ) – эндокринопатия, характеризующаяся дефицитом тиреоидных гормонов в организме [1]. По эпидемиологическим данным, во всем мире от ГТ страдают от 0,25 до 4,2% населения. В странах с выраженным йододефицитом преобладают врожденный ГТ, ГТ беременных и аутоиммунные поражения (тиреоидит Хашимото).
В регионах с достаточным количеством йода распространенность ГТ колеблется от 1 до 2%, повышаясь до 7% у лиц пожилого возраста [2]. Однако в последние годы в связи с развитием фармацевтической промышленности отмечается увеличение числа случаев патологии ЩЖ, которая вызывается приемом тиреотоксичных лекарственных средств (ЛС).
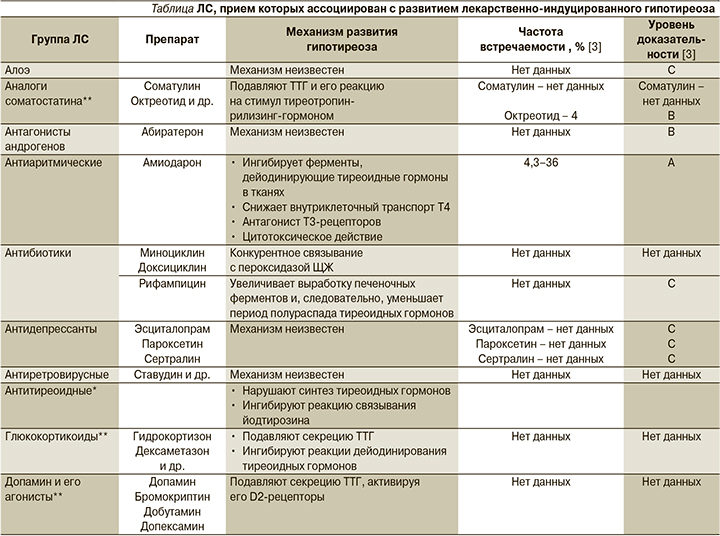
Имеются исследования, подтверждающие развитие ГТ, ассоциированного с приемом достаточно большого количества лекарственных средств (ЛС). Помимо антитиреоидных ЛС, угнетающее влияние которых на работу ЩЖ не считают нежелательным, поскольку они используются для лечения ее гиперфункции, ГТ могут вызывать следующие препараты и группы препаратов [1, 3–5]: аналоги соматостатина, амиодарон (антиаритмическое йодсодержащее ЛС), антибиотики (миноциклин, доксициклин, рифампицин), антиретровирусные ЛС, дофамин и его агонисты, глюкокортикоиды, ингибиторы тирозинкиназы, контрастные вещества (йодосодержащие), противоопухолевые ЛС, противотуберкулезные ЛС, противоэпилептические ЛС, психотропные ЛС (соли лития), цитокины (интерферон α), эстрогены. Подробный перечень этих препаратов и механизмы развития ГТ на фоне их приема указаны в таблице.
Распространенность
Распространенность лекарственно-индуцированного ГТ точно не установлена. Однако имеются ретроспективные исследования, касающиеся его распространенности, индуцированного приемом отдельных препаратов. Например, по данным ретроспективного анализа, в Великобритании и США в регионах с достаточным потреблением йода распространенность амиодарон-индуцированного ГТ составила 1,7–3%, в регионах с йододефицитом – 6,4% [3]. По данным последних исследований, он может возникать у 5–25% больных, принимающих амиодарон [1]. Хорошо изучена распространенность ГТ, вызываемого приемом препаратов лития: он встречается у 4–34% пациентов [3], по данным некоторых исследований, частота его возникновения может достигать 52% [1, 6]. Ретроспективные исследования свидетельствуют о том, что распространенность ГТ, индуцированного приемом ингибиторов тирозинкиназы, составляет порядка 38,5–68% [3].
Рост случаев лекарственно-индуцированного ГТ в настоящее время требует систематизации данных о его патогенезе, уточнения перечня ЛС, способных его индуцировать, разработки методов профилактики и тактики ведения таких пациентов.
Патофизиология
Механизмы лекарственно-индуцированного ГТ включают дефицит гормонов ЩЖ как центрального, так и периферического генеза и делятся на следующие основные группы: ингибирование синтеза и/или высвобождение тиреоидных гормонов в организме, иммунные воздействия, воспалительные реакции, ингибирование тирозинкиназы, ингибирование синтеза тиреотропного гормона гипофиза (ТТГ), нарушение всасывания левотироксина при одновременном приеме с рядом других препаратов [1]. Большую роль играют нарушения ферментативных процессов, которые могут обусловливаться ингибированием протеолитических ферментов, ответственных за отщепление трийодтиронина (Т3) и тироксина (Т4) от тиреоглобулина, а также ингибированием 5’-монодейодиназы, катализирующей превращение Т3 в Т4. Часто встречается лекарственно-индуцированный ГТ после перенесенных аутоиммунных заболеваний ЩЖ у пациентов, не получающих заместительной терапии [3]. Механизмы развития ГТ, индуцированного приемом отдельных препаратов, описаны в таблице.
Клинические проявления
Лекарственно-индуцированный ГТ может протекать без выраженных проявлений, что сопровождается отклонениями уровней тиреоидных гормонов и неспецифическими симптомами: общей слабостью, сонливостью, ухудшением внимания и памяти, увеличением времени реакции, признаками депрессии [7]. Развитию клинической симптоматики ГТ, как правило, способствуют более высокие дозы индуцирующих его ЛС и поздняя диагностика гормонального дефицита [8, 9]. Клинические проявления лекарственно-индуцированного ГТ очень разнообразны и могут не отличаться от ГТ иной этиологии, при этом в последнее время все чаще встречаются атипичные формы [10]. В таких случаях уместно говорить о т.н. масках ГТ. Выделяют терапевтические, гематологические, гинекологические, эндокринологические, дерматологические неврологические, психиатрические заболевания-маски, под видом которых может протекать ГТ [10]. Особенно затруднена диагностика атипичных форм ГТ у пациентов пожилого возраста, что может быть связано как с тяжестью сопутствующих заболеваний и их медикаментозным лечением, так и с психосоматическим состоянием таких пациентов [10]. Дефицит тиреоидных гормонов, вызванный приемом ЛС, часто выявляется при наличии уже диагностированной патологии ЩЖ (например, диффузного токсического зоба), однако может возникать и на фоне эутиреоза.
Среди клинических симптомов лекарственно-индуцированного ГТ выделяют следующие [3]: атаксия, брадикардия, жесткость волос или алопеция, запоры, повышенная влажность кожи, депрессия, одышка, усталость, слабость, зоб, охриплость голоса, гипотермия, особенно дистальных отделов конечностей, нарушения менструального цикла, ослабление слуха, нарушения памяти и мышления, миалгии, парестезии, отеки на лице, конечностях (микседема), набор массы тела, вызванный задержкой жидкости, желтуха.
Факторы риска
Исходя из вышеизложенных патофизиологических механизмов лекарственно-индуцированного ГТ, выделяют следующие факторы риска его развития, общие для всех случаев (всех ЛС) [3]: уже существующий ГТ, сопутствующие аутоиммунные заболевания, ранее существовавший тиреоидит Хашимото, тироидэктомия, реализация эффекта Вольфа–Чайкова (блокада синтеза тиреоидных гормонов при введении в организм большого количества йода), йодная нагрузка, проживание в районах с достаточным потреблением йода, пожилой возраст, женский пол, наследственный анамнез (наличие заболеваний ЩЖ у родственников), нарушения питания.
Повышенный риск развития лекарственно-индуцированного ГТ связан с наличием в организме пациента циркулирующих антител к структурам ЩЖ, возникновением у его ближайших родственников ГТ такой этиологии. Большую роль играет срыв механизмов адаптации ЩЖ после значительной йодной нагрузки. Имеются исследования по выявлению факторов риска развития отдельных случаев лекарственно-индуцированного ГТ. Так, возникновение ГТ, вызванного приемом интерферона α связывают с такими факторами, как женский пол, европеоидная раса, отсутствие табачной зависимости, наличие антител к пероксидазе ЩЖ и предшествующего заболевания ЩЖ [3].
Рассмотрим более подробно отдельные препараты, вызывающие лекарственно-индуцированный ГТ (за исключением антитиреоидных ЛС).
Отдельные препараты, вызывающие лекарственно-индуцированный ГТ
Алоэ. Имеются отдельные сообщения о влиянии сока алоэ на развитие ГТ. Например, в 2005 г. был зафиксирован случай субклинического ГТ у женщины 56 лет, вызванный приемом 10 мл сока алоэ ежедневно на протяжении 11 месяцев. Пациентка жаловалась на вялость, усталость, общую слабость. Лабораторные показатели Т3 и Т4 были снижены относительно нормы, в то время как уровень ТТГ оказался нормальным. При проведении ультразвукового исследования (УЗИ) ЩЖ было обнаружено гипоэхогенное узловое образование, которое подвергалось спонтанной редукции в течение 6 месяцев после отмены приема сока алоэ, уровни тиреоидных гормонов также пришли в норму [11].
Аналоги соматостатина. Доказана терапевтическая эффективность аналогов соматостатина для пациентов с синдромом гипофизарной резистентности к тиреоидным гормонам и тиреотропиномам [1]. Длительное использование аналогов соматостатина снижает уровень ТТГ и его реакцию на стимул тиреотропин-рилизинг-гормоном, не влияя на уровень сывороточных гормонов ЩЖ [12]. По данным исследований, для развития центрального ГТ, вызванного приемом аналогов соматостатина, необходимы крайне высокие дозы.
Антагонисты андрогенов. Абира-терона ацетат используется для терапии опухолей предстательной железы. Одновременно с противоопухолевым действием абиратерон вызывает субклинический ГТ, однако остается неизвестным, является ли индукция ГТ одним из его побочных эффектов или же это просто фармакокинетический феномен [13].
Амиодарон. Хорошо изучены аспекты возникновения ГТ при приеме амиодарона (амиодарон-индуцированная тиреопатия), возникающего благодаря высокому содержанию йода в препарате, он обычно развивается в первые 6–18 месяцев лечения. Индуцированный приемом амиодарона ГТ встречается примерно у 5–25% пациентов, чаще у женщин и лиц пожилого возраста на фоне существующей патологии ЩЖ [1, 14–16]. Амиодарон – антиаритмический препарат, производное бензофурана, содержание йода в котором составляет 37–39% от его молекулярной массы. В связи с этим имеется структурное сходство амиодарона, его метаболитов и гормонов ЩЖ, поэтому амиодарон ведет себя как их частичный агонист. Каждая таблетка амиодарона (200 мг) содержит около 75 мг йода, а суточная доза амиодарона у различных пациентов может достигать 600 мг. Рекомендуемая суточная норма поступления йода в организм человека составляет 150–250 мкг, следовательно, объем поступающего с амиодароном йода в 50–100 раз выше нормы у пациентов, которые его принимают [1, 17]. Кроме того, период полувыведения амиодарона составляет около 100 дней, при этом он снижается у пациентов с ожирением на 22%, у пациентов старше 65 лет – на 46% [1]. В организме амиодарон накапливается в мышечной (включая скелетную мускулатуру и миокард), соединительной, жировой тканях, в печени, а также в самой ЩЖ, поэтому его антитиреоидный эффект сохраняется достаточно долгое время после отмены (месяцы и годы) [1].
Антитиреоидное действие амиодарона обусловливается как наличием в его структуре большого количества йода, так и его собственными свойствами. Среди причин ГТ, вызванного присутствием йода в препарате, выделяют снижение транспорта йода, снижение синтеза гормонов ЩЖ (эффект Вольфа–Чайкова), блокирование выделения гормонов ЩЖ [1].
Выделяют собственные антитиреоидные эффекты амиодарона на ЩЖ: ингибирование 5’-дейодиназы типа I и/или типа II, ингибирование 5’-дейодиназы типа II, снижение внутриклеточного транспорта Т4, антагонистическое действие на рецепторы Т3, прямое цитотоксическое действие на клетки ЩЖ [1].
Амиодарон-индуцированный ГТ, по данным исследований, обычно проявляется в первые 6–18 месяцев лечения пациентов и чаще возникает у женщин, пожилых пациентов, в районах с достаточным потреблением йода [1, 16]. ГТ, вызванный приемом амиодарона, часто сопутствует аутоиммунному тиреоидиту, лечению радиоактивным йодом, послеоперационным осложнениям после резекции ЩЖ, предрасполагающим хроническим заболеваниям (таким, как талассемия) или потенцирует уже существующий ГТ. Стоит отметить, что концентрация амиодарона и его кумулятивные дозы могут быть одинаковыми для пациентов как с эутиреозом, так и с амиодарон-индуцированным ГТ.
Прекращение приема препарата пациентами с ранее нормальной функцией ЩЖ способствует восстановлению ее функции в течение 2–4 месяцев в 60% случаев. В 40% ГТ может сохраняться еще 5–8 месяцев [1]. У пациентов с предшествовавшей дисфункцией ЩЖ ГТ будет сохраняться даже после прекращения приема амиодарона, что требует назначения заместительной терапии левотироксином [18].
Амиодарон также может вызывать деструктивный тиреоидит из-за прямого цитотоксического повреждения фолликулярных клеток ЩЖ, вызванного тиреотоксикозом. Примерно в 15% случаев впоследствии развивается ГТ, также требующий своевременной диагностики и коррекции.
Поскольку амиодарон – это антиаритмический препарат, решение о терапии кордарон-индуцированного ГТ принимается с учетом состояния сердечно-сосудистой системы, а также степени дисфункции ЩЖ и возраста пациента [1, 18]. Многие авторы отмечают, что субклинический ГТ, вызванный приемом амиодарона, чаще всего не требует отмены препарата или назначения специальной терапии, однако обязательным указывают контроль уровней тиреоидных гормонов у пациентов с уже выявленным ГТ. Если необходима заместительная терапия левотироксином, начинают с низких доз, которые затем постепенно повышают каждые 4 недели под контролем оценки сердечно-сосудистой системы и уровня сывороточного ТТГ [19]. В связи с вышеуказанными особенностями развития и лечения амиодарон-индуцированного ГТ у пациентов, принимающих амиодарон, необходимо каждые 3–12 месяцев проводить исследование уровней тиреоидных гормонов и ТТГ.
Антибиотики. Кроме того, в некоторых исследованиях сообщается о возможности развития дефицита гормонов ЩЖ, вызванного приемом антибиотиков тетрациклинового ряда (например, миноциклина, доксициклина, рифампицина) [1].
Миноциклин, доксициклин. Среди тетрациклинов наибольшим антитиреоидным эффектом обладает миноциклин [1]. Черная ЩЖ, ставшая такой благодаря приему миноциклина, была описана еще в 1967 г. Однако другие тетрациклины, особенно доксициклин, также способны вызывать изменение функции ЩЖ, хотя и на порядок медленнее, чем миноциклин. К настоящему времени зарегистрировано около 150 случаев развития черной пигментации ЩЖ в результате окисления миноциклина пероксидазой ЩЖ. Кроме того, миноциклин обладает зобогенным действием, т.к. конкурентно связывается с пероксидазой и таким образом ингибирует процессы синтеза тиреоидных гормонов [1].
Рифампицин индуцирует работу оксигеназ печени, что уменьшает период полувыведения тиреоидных гормонов в организме и также может приводить к развитию лекарственно-индуцированного ГТ [5].
Антидепрессанты. Имеются описания отдельных клинических случаев возникновения ГТ, индуцированного приемом антидепрессантов-ингибиторов обратного захвата серотонина: эсциталопрама, пароксетина, сертралина. При этом симптомы депрессии могли не только не купироваться, но и ухудшаться, а ГТ мог протекать как бессимптомно, так и с прогрессирующим ухудшением состояния пациента [20–22].
Антиретровирусные препараты. Данные о функции ЩЖ у пациентов, получающих антиретровирусную терапию, разнятся. Однако имеются сообщения о развитии субклинического ГТ у пациентов, которым была назначена высокоактивная антиретровирусная терапия (особенно ставудин) [23].
Глюкокортикостероиды (ГКС). Суточные колебания уровня ТТГ у здорового человека зависят в т.ч. от действия ГКС (утром уровень ТТГ низкий, ночью – высокий). Прием ГКС в высоких дозах способствует подавлению ТТГ путем угнетения его секреции из передней доли гипофиза, однако обычно не вызывает центрального ГТ. По другим сообщениям, высокие дозы ГКС вызывают стойкое снижение концентрации Т3 в сыворотке на 30% в течение нескольких дней после начала терапии благодаря ингибированию дейодиназы ЩЖ, при этом также снижается секреция Т4 [4]. Имеются данные о возникновении ГТ у пациентов с кортикотрофными микроаденомами, т.к. у таких пациентов избыток кортизола в организме оказывает ингибирующее действие на ось «гипоталамус–гипофиз–щитовидная железа» [24].
Дофамин и его агонисты. Дофамин и его агонисты подавляют секрецию ТТГ, активируя его D2-рецепторы. Как и в случае с аналогами соматостатина и ГКС, для развития дофамин-индуцированного ГТ чаще всего необходимы дозы, превышающие терапевтические.
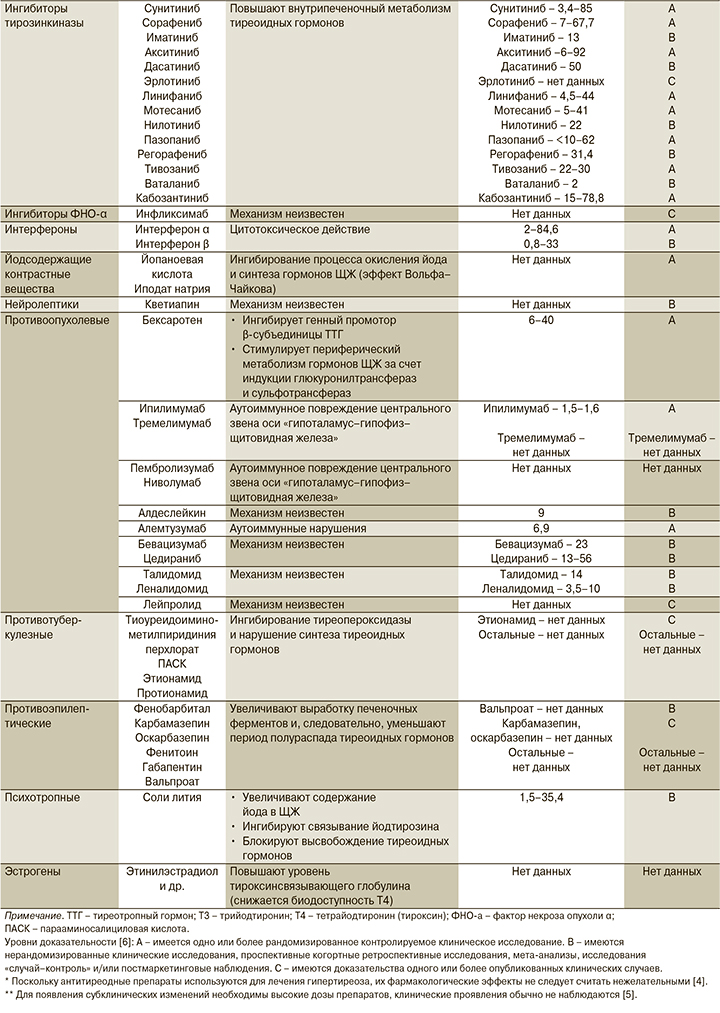
Ингибиторы тирозинкиназы. Ингибиторы тирозинкиназы применяются для лечения онкологических заболеваний, в т.ч. рака ЩЖ. Вследствие активации ими печеночных ферментов ускоряется метаболизм тиреоидных гормонов и развивается ГТ у 27% пациентов [2, 5]. Известно, что сунитиниб, используемый в лечении почечно-клеточного рака, иматиниб-резистентных стромальных опухолей желудочно-кишечного тракта, папиллярного рака ЩЖ и других заболеваний, индуцирует возникновение ГТ примерно в 40% случаев [25]. Сорафениб, применяемый в лечении нескольких типов сóлидных опухолей, способен вызывать ГТ примерно в 25% случаев. Подобные изменения возникают и при приеме других ингибиторов тирозинкиназы, особенно акситиниба (распространенность – 6–92%) кабозантиниба (15–78,8%), линифаниба (4,5–44%), мотесаниба (5–41%) и т.д. [3] Возможность развития индуцированного ингибиторами тирозинкиназы ГТ различные авторы связывают с возникновением деструктивного тиреоидита, проявлением антипероксидазного эффекта, запуском или обострением аутоиммунного действия на клетки ЩЖ [25], однако точный механизм остается неизвестным.
Ингибиторы фактора некроза опухоли а (ФНО-α). В ряде случаев инфликсимаб – ингибитор ФНО-α может вызывать ГТ, что подтверждается описаниями нескольких клинических случаев. В частности, в одном из них у пациента, принимавшего инфликсимаб для терапии системной красной волчанки, симптомы основного заболевания полностью купировались, однако развилась симптоматика ГТ, а также в крови снизился уровень свободного Т4 до 0,28 нг/л и повысился уровень ТТГ. По данным УЗИ в ЩЖ были обнаружены гетерогенные участки, соответствующие аутоиммунному тиреоидиту, но антитела к пероксидазе ЩЖ не были обнаружены. Пациенту была назначена заместительная терапия левотироксином натрия, после чего симптомы ГТ купировались в течение 3 месяцев [26].
Интерфероны. У пациентов с хроническими воспалительными или онкологическими заболеваниями часто развивается ГТ, индуцированный приемом цитокинов. Терапия интерфероном α может вызывать выработку антител к пероксидазе ЩЖ [22], ингибируя таким образом процессы синтеза Т3 и Т4 примерно в 2–8% случаев [24]. Интерферон β, применяемый в лечении рассеянного склероза, также может вызывать различные тиреопатии, включая ГТ [27, 28].
Антипсихотические ЛС. Имеются описания случаев развития ГТ, индуцированного приемом кветиапина, причем у одной пациентки была купированная тиреопатия в анамнезе [29], у другой – ГТ у ближайших родственников [30]. По данным клинических исследований считается, что кветиапин-индуцированный ГТ возникает у 0,4% пациентов (10 из 2386 человек), из которых 6 нуждаются в заместительной терапии [29].
Противоопухолевые ЛС. Описаны случаи ГТ при приеме противоопухолевых препаратов и проведении лучевой терапии пациентов с онкологическими заболеваниями различной локализации, причем радиационный риск сохранялся более 25 лет после окончания лечения, а функциональные нарушения наблюдались на любом из звеньев оси «гипоталамус–гипофиз-щитовидная железа» [31–33].
Бексаротен. Бексаротен используется в терапии кожной Т-клеточной лимфомы и вызывает ГТ в 90% случаев его применения благодаря центральному действию на гипофиз и подавлению выработки ТТГ [1]. Однако бексаротен обладает также периферическим антитиреоидным действием, стимулируя метаболизм гормонов ЩЖ за счет индукции глюкуронилтрансфераз и сульфотрансфераз. Бексаротен-индуцированный ГТ возникает через несколько дней после начала терапии и полностью купируется отменой препарата [1].
Ипилимумаб, тремелимумаб. По данным зарубежных источников, ГТ, индуцированный приемом анти-CTLA4 антител, встречается у 1,5–6,8% пациентов [2].
Пембролизумаб, ниволумаб. Анти-PD-1 антитела, такие как пембролизумаб, ниволумаб, способны вызывать аутоиммунное повреждение центрального звена оси «гипоталамус–гипофиз–щитовидная железа» путем индукции аутоиммунного гипофизита [32]. Однако число подобных случаев, описанных в литературе, невелико. Имеется сообщение о ниволумаб-индуцированном ГТ, возникшем через 4 месяца после начала терапии у пожилой пациентки, страдавшей колоректальным раком. Наблюдалось снижение уровней тиреоидных гормонов и повышение уровня ТТГ, что было связано с аутоиммунным поражением ЩЖ на фоне приема препарата. После прекращения лечения ниволумабом и проведения заместительной терапии тироксином функция ЩЖ была восстановлена [32].
Важно отметить, что вероятность развития ГТ при комбинации анти-CTLA4 антител и анти-PD-1 антител (например, ипилимумаба и ниволумаба) увеличивается и составляет 4–27% [2].
Алдеслейкин. Алдеслейкин – препарат рекомбинантного интерлейкина-2 человека, который может индуцировать ГТ, причем развитие ГТ значительно коррелирует с благоприятным ответом на лечение [33].
Алемтузумаб. Препарат анти-CD52 антител, используемый в терапии рассеянного склероза, также вызывает ГТ [34].
Бевацизумаб, цедираниб. Бевацизумаб – препарат рекомбинантных гиперхимерных моноклональных IgG1 антител, ингибирующих фактор роста эндотелия сосудов. Исследованы его побочные эффекты в отношении детей с опухолями центральной нервной системы, среди которых выявлен ГТ [35]. Цедираниб также ингибирует фактор роста эндотелия сосудов; ГТ, вызванный его приемом, обнаружен у 43% пациентов в одном из исследований [36].
Талидомид, леналидомид. Талидомид первоначально применялся в качестве седативного средства с 1956 г., однако через 5 лет был запрещен из-за его тератогенного действия. В последние десятилетия у талидомида были обнаружены иммуномодулирующие, противовоспалительные и антиангиогенные свойства, что позволило применять его в терапии новообразований, а также ВИЧ-инфекции, реакции «трансплантат против хозяина», саркоидоза, болезни Крона и других. С 1960-х гг. зарегистрировано несколько случаев талидомид-индуцированного ГТ, симптомами которых были в т.ч. усталость, запор и брадикардия. Патогенез ГТ, вызванного талидомидом, неизвестен, однако предполагают, что препарат либо ингибирует секрецию гормонов ЩЖ путем прямого воздействия на тиреоциты, либо индуцирует аутоиммунное повреждение ЩЖ [37]. ГТ может также вызывать другой антиангиогенный препарат – леналидомид, который используется в гематологии. Ретроспективные исследования возникновения тиреопатий после приема леналидомида показывают, что у пациентов с предшествовавшей дисфункцией ЩЖ распространенность ГТ, индуцированного леналидомидом, оказалась выше, чем у пациентов с эутиреозом (17 и 6% соответственно) [38].
Лейпролид. Агонист гонадотропин-рилизинг гормона, ингибирует секрецию гонадотропина, применяется в терапии некоторых гормонально-зависимых опухолей. Имеются отдельные сообщения о ГТ, индуцированном приемом лейпролида [39].
Противотуберкулезные препараты.
В отечественной и зарубежной литературе имеются сведения о возникновении лекарственно-индуцированного ГТ у пациентов, получающих противотуберкулезные препараты второй линии [40–42].
Существует вероятность развития ГТ у пациентов, получающих противотуберкулезную терапию, особенно при туберкулезе с множественной лекарственной устойчивостью. Клиника ГТ, вызванного приемом ПАСК, этионамида и протионамида, неяркая, что может быть расценено как проявление туберкулеза. По данным статистики, ГТ, индуцированный приемом противотуберкулезных препаратов, возникает в 10–40% случаев [14]. Важно отметить, что вероятность развития лекарственно-индуцированного ГТ у пациентов с туберкулезом и вирусом иммунодефицита человека (ВИЧ) существенно повышается, поскольку, как уже было сказано выше, антиретровирусные препараты также могут приводить к дисфункции ЩЖ [42]. Также отмечается риск возникновения ГТ у пациентов, получающих для терапии туберкулеза тиоуреидоиминометилпиридиния перхлорат, механизм действия которого связан с наличием в его структуре остатка тиомочевины, способного ингибировать тиопероксидазу и таким образом нарушать процессы синтеза гормонов ЩЖ [41].
Противоэпилептические препараты. Существуют описания клиники ГТ, индуцированного приемом противоэпилептических лекарственных средств [9]. Прием противоэпилептических препаратов (таких, как фенитоин, фенобарбитал, карбамазепин, оскарбазепин, габапентин, вальпроат) может приводить к повышению скорости метаболического клиренса и печеночного метаболизма Т4 в результате потенцирования работы ферментов цитохрома-P450 (CYP3A), катализирующих окислительно-восстановительные реакции. Таким образом, снижается концентрация общего и свободного Т4 в сыворотке крови на 20–40% от исходной, а также концентрация общего и свободного Т3 (снижение менее выражено) [4, 9, 43].
Соли лития. В психиатрической практике достаточно распространен ГТ, вызванный приемом препаратов лития. Поперечные исследования выявляют его наличие у 40–50% пациентов, получавших литиевые препараты в течение 5–10 лет, причем чаще индуцированный литием ГТ встречается у женщин в первые 2 года лечения, тогда как у мужчин для этого может потребоваться порядка 59 месяцев [1, 3]. Карбонат лития является препаратом, широко используемым в психиатрии, в т.ч. для коррекции биполярных расстройств (по статистическим данным, его принимает 1 человек из 200). Литий обладает тропностью к клеткам ЩЖ, содержание лития в ней в 3–4 раза превышает концентрацию в плазме [23]. Он увеличивает содержание йода в ЩЖ, ингибирует связывание йодтирозина и блокирует выброс гормонов ЩЖ, что способствует повышению секреции ТТГ и приводит к реализации зобогенного эффекта препаратов лития, в т.ч. благодаря прямой индукции пролиферации клеток. Распространенность ГТ, вызванного приемом солей лития, по данным разных исследований, варьируется от 6 до 52%, и обычно литий-индуцированный ГТ является субклиническим [23]. Лишь в редких случаях сообщается о тяжелой клинике литий-индуцированного ГТ, вплоть до развития миксидемной комы [25, 43]. Сопутствующие аутоиммунные заболевания увеличивают риск развития ГТ: порядка 50% пациентов с аутоиммунными патологиями, принимающих препараты лития, имеют ГТ [23].
Эстрогены. Препараты эстрогенов в больших дозах способны ингибировать функцию ЩЖ, угнетая транспорт Т4 в ткани путем повышения уровня тироксинсвязывающего глобулина и таким образом снижая биодоступность Т4 [4, 5].
Кроме рассмотренных выше ситуаций возникновения лекарственно-индуцированного ГТ он может также вызываться нарушением всасывания левотироксина из-за приема отдельных препаратов [4, 5]. Левотироксин назначают пациентам с ГТ для восполнения уровня гормонов ЩЖ, в т.ч. в качестве заместительной терапии после резекции ЩЖ, а также в составе комплексной терапии гипертиреоза, аутоиммунного тиреоидита. ГТ может возникнуть при одновременном приеме левотироксина и следующих ЛС [4, 5]: препаратов кальция, препаратов железа, секвестрантов желчных кислот, сукральфата, кофеина, гидроксида алюминия, севеламера.
Для снижения негативного влияния указанных препаратов на всасывание левотироксина таким пациентам рекомендуется принимать левотироксин утром натощак [4, 5].
Йодсодержащие контрастные вещества. Широкое использование йодсодержащих контрастных веществ в диагностике массы патологий различных органов и систем вызывает определенную настороженность, поскольку количество йода в этих препаратах достигает 400 мг/мл. Такая йодная нагрузка может оказывать антитиреоидное действие, т.к. даже минимальное дейодинирование приводит к высвобождению в системный кровоток от 14 до 175 мг йодида [4]. И хотя ингибирующее действие йода купируется спонтанно через несколько дней после исследования с йодсодержащим контрастным веществом, нарушения уровней тиреоидных гормонов и ТТГ могут сохраняться еще несколько недель.
Диагностика и дифференциальная диагностика
Диагностических тестов, позволяющих дифференцировать лекарственно-индуцированный ГТ от ГТ иной этиологии, не существует. ГТ считается лекарственно-индуцированным, если пациент принимает препарат, о котором известно, что он может вызвать снижение функции ЩЖ, либо ГТ купируется отменой данного препарата [17]. Клинические данные необходимо интерпретировать с учетом уже имеющихся нарушений функции ЩЖ или оси «гипоталамус–гипофиз–щитовидная железа» [3].
Дифференциальную диагностику лекарственно-индуцированного ГТ проводят со следующими заболеваниями и состояниями: аутоиммунный тиреоидит Хашимото, врожденный ГТ, генные дефекты процессов синтеза/транспорта/активации тиреоидных гормонов, ятрогенная деструкция ЩЖ (хирургическая/радиационная), идиопатическая атрофия, йододефицит.
Ведение пациентов с лекарственно-индуцированным ГТ
В большинстве случаев при лекарственно-индуцированном ГТ необходима отмена препарата, на фоне применения которого он развился. Однако зачастую препарат, вызвавший развитие лекарственно-обусловленного ГТ, принимают по жизненным показаниям, поэтому его отмена невозможна. В таких случаях назначается заместительная терапия (левотироксин натрия) для нормализации уровня ТТГ. Начальная доза левотироксина составляет 1,6–1,7 мкг/кг/сут и может повышаться каждые 4–6 недель до восстановления эутиреоза у пациента. Более низкие дозы (25 мкг/сут) назначают пожилым пациентам и пациентам с сопутствующей кардиоваскулярной патологией. Для больных амиодарон-индуцированным ГТ доза левотироксина может быть повышена, чтобы ингибировать центральное и периферическое превращение Т4 в Т3 [3].
При наличии заболеваний ЩЖ антиаритмическим препаратом выбора может стать пропафенон. Это, в частности, указано в обновленных алгоритмах ведения в клинической практике пациентов с коморбидной патологией, опубликованных в 2019 г. [44]. В документе обращается внимание на то, что у пациентов с фибрилляцией предсердий (ФП) и сопутствующей патологией ЩЖ в отсутствие выраженных нарушений гемодинамики (фракция выброса левого желудочка >40%) и перенесенного в анамнезе инфаркта миокарда может быть назначен пропафенон, обладающий также свойствами β-адреноблокатора. Кроме того, в алгоритмах [44] подчеркивается высокая эффективность и хорошая переносимость комбинированной антиаритмической терапии, основанной на уменьшенных дозах пропафенона, у пациентов с нарушением тиреоидного статуса (в т.ч. при ГТ), причем допустима даже комбинация данного антиаритмического препарата с β-адреноблокаторами.
Следует отметить, что высокая эффективность и безопасность применения пропафенона (препарат Пропанором) подтверждены российским многоцентровым рандомизированным исследованием ПРОСТОР [45], в котором рассматриваемый препарат сравнивался с амиодараном (препарат Кордарон). По данным анализа, за 12 месяцев в исследование были рандомизированы 137 человек, в статистический анализ вошли 100 из них (средний возраст около 55 лет, приблизительно 55% – мужчины). Основными критериями включения служили наличие пароксизмальной и/или персистирующей формы ФП (2С класс по Levy), сопутствующая артериальная гипертензияония (АГ) 1–3-й степеней и/или стабильная стенокардия I–III функциональных классов, фракция выброса левого желудочка >50%. В группу пропафенона могли также включаться пациенты с заболеваниями ЩЖ, периферических сосудов, сахарным диабетом и хронической обструктивной болезнью легких. В работу не включались лица с перенесенным инфарктом миокарда, острым коронарным синдромом, брадикардией с частотой сердечных сокращений менее 50 ударов в минуту, пороками сердца. Пропафенон назначали в дозе 450 мг/сут, амиодарон – в дозе 100–400 мг/сут. Аутоиммунный тиреоидит имел место у 8,5% пациентов в группе пропафенона. По результатам анализа авторы пришли к выводу, согласно которому антиаритмическая эффективность пропафенона не уступает таковой амиодарона, но по сравнению с последним пропафенон обладает лучшим профилем безопасности для пациентов с артериальной гипертензией, ишемической болезнью сердца с сохраненной систолической функцией левого желудочка, поскольку при его применении не возникало побочных эффектов (в т.ч. со стороны ЩЖ), тогда как в группе амиодарона частота побочных эффектов составила 31,6%.
Пропафенон обладает также превосходством над амиодароном в отношении купирования приступов ФП в условиях оказания скорой медицинской помощи. Здесь заслуживает внимания многоцентровое рандомизированное исследование ПРОМЕТЕЙ-ИНСК [46], целью которого стало сравнение эффективности и безопасности применения пропафенона и амиодарона для острого восстановления синусового ритма у пациентов с пароксизмальной формой ФП на догоспитальном этапе. В работу включались мужчины и женщины в возрасте от 18 лет и старше с пароксизмами ФП любого генеза, верифицированными электрокардиографически, длительностью минимум 1 час, но не более 48 часов без применения пероральных антикоагулянтов или до 7 суток включительно, на фоне приема последних. У всех пациентов была сохраненной систолическая функция левого желудочка (фракция выброса >40%). Основные критерии невключения: острый коронарный синдром, другие нестабильные формы ишемической болезни сердца, перенесенный инфаркт миокарда в анамнезе, брадикардия менее 45 в 1 минуту, а также синдром слабости синусового узла и нарушения АВ-проводимости. Первичными конечными точками служили восстановление синусового ритма на фоне применения пропафенона в инъекционной форме по сравнению с аналогичными формами амиодарона. В исследование последовательно вошли 388 пациентов: 228 (58,7%) мужчин и 160 (41,3%) женщин в возрасте 29–78 лет (средний возраст – 66,29±11,14 года) с пароксизмом ФП длительностью в среднем 195 минут (3,25 часа). Эффективность изучаемых препаратов оценивалась до восстановления синусового ритма в течение 24 часов наблюдения. В 1-й группе (амиодарон) эффективность составила 61,7%, во 2-й (пропафенон) – 77,6% (p=0,012). Среднее время восстановления в 1-й группе – 110 минут, во 2-й – 22 (p=0,0001). Купирование пароксизма ФП до 60 минут составило в 1-й группе 25,83%, во 2-й – 64,5% (p<0,05). Авторы пришли к выводу, что инъекционный пропафенон – эффективный и безопасный антиаритмический препарат, который может служить альтернативой амиодарону при фармакологической кардиоверсии ФП у пациентов без органической патологии сердца. Инъекционный пропафенон может применяться в условиях скорой медицинской помощи для купирования пароксизма ФП, так, его максимальный эффект наступает до 30 минут в отличие от амиодарона, при использовании которого в большинстве случаев не происходит быстрого купирования аритмии при внутривенном введении.
Следует отметить, что высокая клиническая эффективность пропафенона признается и ведущими мировыми экспертами. Так, в Европейских рекомендациях по ведению пациентов с ФП 2016 г. [47] обращается внимание на высокий потенциал данного препарата в медикаментозной кардиоверсии у пациентов с таким типом аритмии, а также на возможность использовать его даже в качестве средства профилактики возникновения пароксизмов ФП.
Профилактика
В качестве профилактики лекарственно-индуцированного ГТ рекомендуется по возможности избегать применения препаратов, обладающих данной нежелательной побочной реакцией. В частности, при необходимости проведения антиаритмической терапии препаратом выбора вместо амиодарона может служить пропафенон, доказавший свою эффективность и безопасность среди прочего в отношении тиреоидного статуса, что отражено в актуальных алгоритмах ведения пациентов с коморбидной патологией [44]. Также необходимо употреблять адекватное количество йода для профилактики йододефицита, своевременно корректировать нарушения функции ЩЖ. Важную роль играет санитарно-просветительская работа с населением, так как знание ранних симптомов лекарственно-индуцированного ГТ позволяет добиваться лучшего эффекта в его терапии.
Перед началом терапии препаратами, которые могут вызывать ГТ, многие клиницисты рекомендуют проводить предварительное исследование функции ЩЖ, а в процессе терапии повторять его каждые 3–12 месяцев для раннего выявления лекарственно-индуцированного ГТ [1, 42].
Заключение
Число случаев лекарственно-индуцированного ГТ продолжит расти, а перечень инициирующих состояние лекарств расширяться. При назначении следует учитывать имеющиеся факторы риска развития лекарственно-индуцированного ГТ, а также необходимость проведения профилактических мероприятий. ГТ, индуцированный приемом лекарственных средств, важно своевременно диагностировать и подобрать оптимальный метод терапии.
Вклад авторов
Остроумова О.Д. – разработка концепции статьи, сбор и редактирование материалов
Качан В.О. – сбор и редактирование материалов.
Кочетков А.И. – сбор и редактирование материалов.
Краснов Г.С. – сбор материалов, координация деятельности авторов.



