Рак шейки матки (РШМ) – одно из наиболее часто встречающихся практикующим онкогинекологам заболеваний [1]. Диагноз устанавливается с использованием комплекса клинических и морфологических методов исследования (согласно рекомендациям FIGO) – осмотра, кольпоскопии, цитологического исследования мазков с шейки матки, гистологического исследования биоптата шейки матки и соскоба цервикального канала.
Злокачественные новообразования шейки матки являются единственным заболеванием в онкологии, при котором стадию по FIGO устанавливают с использованием только клинических критериев [2].
У больных ранними стадиями РШМ в настоящее время удается достигнуть хороших результатов лечения с применением как хирургических вмешательств, так и лучевой терапии. Показатель 5-летней общей выживаемости при этом составляет около 93% [3–5]. При местнораспространенных формах заболевания отдаленные результаты остаются не вполне удовлетворительными, количество рецидивов увеличивается пропорционально стадии, достигая, по данным различных авторов, 54–91% [6–8].
В течение последних нескольких десятилетий проведено множество исследований, показавших улучшение результатов лечения больных местнораспространенным РШМ при использовании неоадъювантной химиотерапии с последующим радикальным хирургическим вмешательством [9–11]. Данный подход требует тщательного динамического мониторинга пациенток с получением объективной документированной информации на всех этапах проводимого лечения. Использование только физикальных методов обследования не всегда достаточно точно отражает истинную распространенность опухолевого процесса. Так, в ряде случаев клиницист сталкивается с трудностями при определении истинных размеров новообразований шейки матки, степени вовлечения в опухолевый процесс параметриев, наличия метастазов в лимфоузлах малого таза [12].
В настоящее время все чаще появляются работы о применении магнитно-резонансной томографии (МРТ) с целью оценки местного распространения РШМ. Интерес к данному виду лучевой диагностики обусловлен рядом преимуществ по сравнению с другими методами: высокой тканевой специфичностью и топографической точностью, неинвазивностью и безопасностью (вследствие отсутствия ионизирующего излучения), возможностью получения одновременно множества срезов исследуемого органа или области в любой плоскости. В результате появляется возможность выявить с достаточной точностью границы разделов нормальных и патологически измененных тканей и, следовательно, получить наглядное изображение опухолевых процессов в любых анатомических областях. По данным разных исследователей, чувствительность и специфичность МРТ при оценке распространения опухоли шейки матки на параметрии составляет от 44 до 92%, общая точность в определении стадии инвазивного РШМ – 77–90% [13–15].
Цель исследования – определить роль МРТ у больных местнораспространенным РШМ при оценке эффективности неоадъювантной химиотерапии.
Материалы и методы
В этой работе нами проанализированы данные обследования 67 больных местнораспространенным РШМ, которые были пролечены на базе ФГБУ «НМИЦАГИП им. В.И. Кулакова» Минздрава России и ФГБУ «РНЦРР» Минздрава России за период с 2012 по 2017 гг.
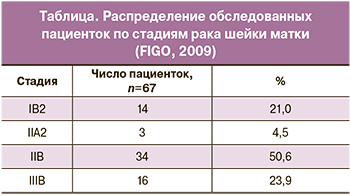 Морфологические варианты новообразований представлены плоскоклеточным раком – ороговевающим (52,0%) и неороговевающим (48,0%). Распределение пациенток по стадиям заболевания представлено в таблице.
Морфологические варианты новообразований представлены плоскоклеточным раком – ороговевающим (52,0%) и неороговевающим (48,0%). Распределение пациенток по стадиям заболевания представлено в таблице.
До начала специального лечения, а также на всех его этапах выполняли обследование пациенток с использованием общеклинических методов диагностики и МРТ. Мультипараметрическое МРТ включало в себя получение Т1-взвешенных изображений (Т1ВИ), Т2ВИ, диффузионно-взвешенных изображений (ДВИ), а также динамическое контрастное усиление. Инфильтрацию параметриев устанавливали по распространению опухолевой ткани за пределы шейки матки на ДВИ и постконтрастных томограммах.
Всем пациенткам проводили один курс неоадъювантной химиотерапии. Использовали следующую схему: первый день – внутривенная инфузия паклитаксела в дозировке 175 мг/м2 и карбоплатина в дозировке ½ AUC 6 на фоне стандартной премедикации и введения антиэметиков. Второй день – внутриартериальное введение карбоплатина в оставшейся дозе ½ AUC 6 в сочетании с эмболизацией маточных артерий.
Манипуляцию проводили под спинально-эпидуральной анестезией в рентген-операционной отделения лучевой диагностики. После пункции правой бедренной артерии по методике Сельдингера катетер устанавливали над бифуркацией брюшной аорты под рентгенографическим контролем. Перед введением цитостатиков и эмболов производили ангиографическое исследование. Выполняли серию тазовых артериограмм, после изучения анатомии сосудов осуществляли катетеризацию последовательно левой, а затем – правой маточной артерии, в которые вводили болюсно карбоплатин в общей дозировке ½ AUC-6, после чего осуществляли эмболизацию указанных сосудов эмболами PVA 100 мкм. Непосредственно после завершения процедуры выполняли контрольную ангиографию.
Оценку эффекта осуществляли на 14-й день после введения цитостатиков. При достаточном уменьшении размеров опухоли проводили радикальные хирургические вмешательства. Резектабельной считали новообразование шейки матки объемом менее 50 см3.
Ответ на введение цитостатиков определяли по изменению объема опухоли, который вычисляли по формуле:
V = A × B × C × 0,52,
где A, B, C – размеры опухоли в трех ортогональных плоскостях, полученные при физикальном обследовании пациентки или МРТ. Поскольку считается, что инфильтраты в параметриях являются частью первичного очага, их учитывали при расчете объема новообразования шейки матки. Динамику показателя на фоне проведения неоадъювантной химиотерапии оценивали в соответствии с критериями RECIST 1.1 [16].
Проводили сравнительный анализ полученных результатов до начала терапии и на всех этапах проводимого лечения.
Статистический анализ. Для сравнительной характеристики полученных величин вычисляли среднее арифметическое (М), а также стандартное отклонение (SD), результат представляли в формате M (SD). С целью оценки взаимосвязи показателей объема шейки матки, полученных с применением клинического обследования и МРТ, использовали корреляционный анализ с вычислением ранговых корреляций Спирмена, пороговой величиной а-ошибки (уровень значимости р) считали 0,05. Статистический анализ проводили с использованием программы Statistica 10.0 StatSoft.
Результаты
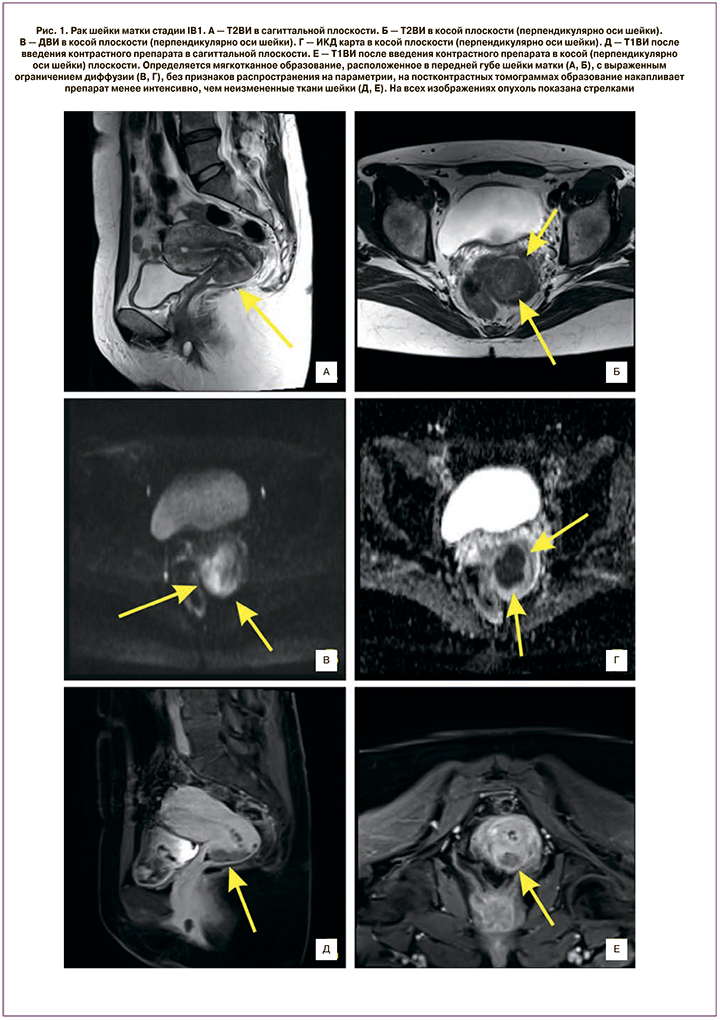
Объем опухоли шейки матки, определенный при физикальном обследовании пациенток до начала терапии, при IB2 и IIA2 стадиях заболевания составлял от 28,1 до 131,0 см3 (46,5 (19,4) см3), при IIB стадии – от 24,2 до 152,9 см3 (61,8 (27,8) см3), IIIB – от 35,1 до 152,9 см3 (70,5 (23,6) см3).
При МРТ-исследовании до начала специального лечения объемы новообразований при IB2 и IIA2 стадиях РШМ составили от 3,0 до 73,3 см3 (36,6 (17,0) см3), при стадии IIB – от 32,2 до 103,1 см3 (64,9 (19,9) см3), при IIIB стадии – от 32,2 до 145,1 см3 (72,3 (23,6) см3) (рис. 1).
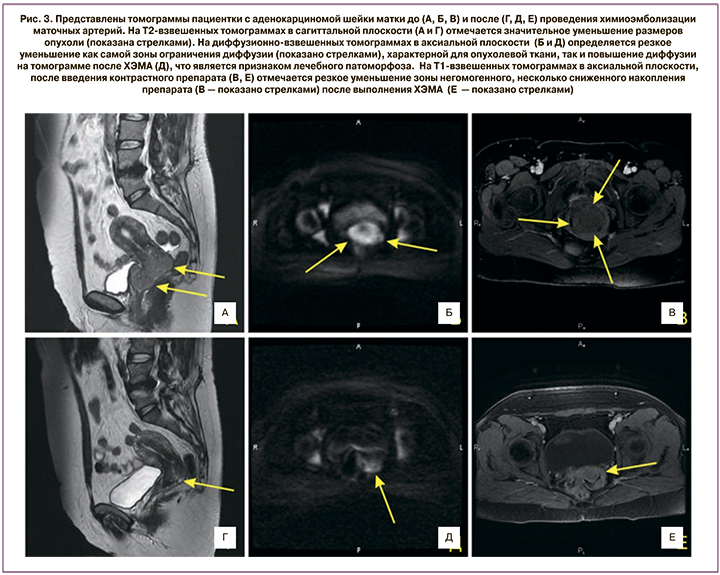
При ангиографии у всех пациенток до начала лечения визуализировали патологическую сеть кровеносных сосудов в области шейки матки, свидетельствующую о наличии в ней злокачественного новообразования. В некоторых случаях патологические сосудистые сети определяли за пределами шейки матки, вероятно, за счет локо-регионарного распространения опухолевого процесса. После введения цитостатиков и эмболизации артерий опухоли отмечалась выраженная редукция кровотока в данной области.
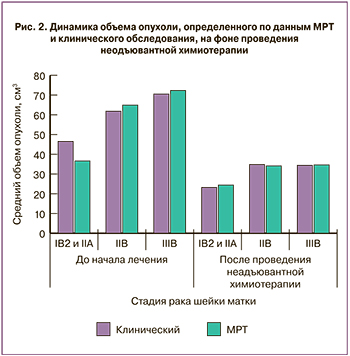 Через 14 дней после проведения химиотерапии физикальное обследование у больных РШМ стадий IB2 и IIA2 показало уменьшение размеров опухоли до 23,2 (16,6) см3 (на 50,1%). При IIB стадии удалось достигнуть объема новообразования 34,8 (18,0) см3 (разница с показателем до начала лечения 43,7%), при IIIВ – 34,4 (12,4) см3 (уменьшение на 51,2%).
Через 14 дней после проведения химиотерапии физикальное обследование у больных РШМ стадий IB2 и IIA2 показало уменьшение размеров опухоли до 23,2 (16,6) см3 (на 50,1%). При IIB стадии удалось достигнуть объема новообразования 34,8 (18,0) см3 (разница с показателем до начала лечения 43,7%), при IIIВ – 34,4 (12,4) см3 (уменьшение на 51,2%).
По данным МРТ, после проведения химиотерапии при IB2 и IIA2 стадиях РШМ объем опухоли уменьшался до 24,4 (19,7) см3 (на 33,3%). При IIB стадии заболевания объем новообразования достигал 34,1 (16,5) см3, уменьшаясь на 47,5%. При IIIB стадии данный показатель оказался 34,6 (11,5) см3 (разница с показателем до начала лечения 52,1%; рис. 2–3).
Выявлена высокая прямая корреляционная зависимость размеров новообразования, определенных при клиническом исследовании и МРТ у больных местнораспространенным РШМ до начала лечения и после проведения неоадъювантной химиотерапии (r=0,735382).
При определении степени эффективности неоадъювантной химиотерапии в соответствии с критериями RECIST 1.1 перед хирургическим вмешательством было выявлено, что при РШМ стадий IB2 и IIA2 полный ответ достигнут у 6 (35,3%) пациенток, частичный – у 9 (52,9%), отсутствие изменений отмечено в 2 (11,8%) случаях. При IIB стадии заболевания полный ответ отмечен у 7 (20,6%) пациенток, частичный – у 23 (67,6%), отсутствие изменений – в 4 (11,7%) случаях, при РШМ стадии IIIB полного ответа мы не наблюдали, частичный ответ и «отсутствие изменений» отмечались в 13 (81,3%) и 3 (18,7%) случаях соответственно. Прогрессирования заболевания на фоне неоадъювантной химиотерапии мы не наблюдали.
Радикальные хирургические вмешательства выполняли у пациенток, объемы новообразований шейки матки у которых после проведения химиотерапии оказывались менее 50 см3. Объем операций во всех наблюдениях – расширенная экстирпация матки III типа (С2) [17, 18]. Всего радикальные хирургические вмешательства после неоадъювантной химиотерапии удалось выполнить 59 пациенткам с местнораспространенным РШМ (88,1%). При IB2 и IIA2 стадиях заболевания были прооперированы все 17 больных, при стадии IIB – 31 (91,2%), при IIIB стадии – 11 (68,8%).
Заключение
Таким образом, основным критерием при определении резектабельности опухоли у больных РШМ является объем новообразования вместе с параметральными инфильтратами (при наличии). Решающее значение при этом имеют результаты клинического обследования пациентки. Применение МРТ в дополнение к традиционным физикальным методам диагностики позволяет получить объективные документированные данные об изменении объема опухоли шейки матки на фоне проведения химиотерапии. Данный способ визуализации играет весьма важную вспомогательную роль для уточнения распространенности опухолевого процесса при местнораспространенном РШМ, хотя и не может позиционироваться как метод ранней диагностики у таких пациенток.
Кроме того, МРТ является современным относительно доступным информативным методом, позволяющим с достаточной точностью и возможностью документальной фиксации определить изменение объема опухоли шейки матки, что может применяться для оценки эффективности неоадъювантной химиотерапии при местнораспространенном РШМ.
Выводы
Основным показателем эффективности неоадъювантной химиотерапии при местнораспространенном РШМ является уменьшение объема опухоли с параметральными инфильтратами.
МРТ является современным информативным методом уточняющей диагностики у больных РШМ, позволяющим не только установить локо-регионарное распространение опухолевого процесса, но и проводить динамический мониторинг объема опухоли в процессе проведения неоадъювантной химиотерапии.



