Введение
Оценка риска летального исхода пациентов с острой тромбоэмболией легочной артерии (ТЭЛА) до сих пор остается сложной задачей. На сегодняшний день среди клинических шкал, учитывающих тяжесть ТЭЛА, наиболее валидирован индекс PESI, позволяющий оценивать риск 30-дневного летального исхода пациентов с ТЭЛА [1]. Позднее разработана и валидирована ее упрощенная версия (индекс sPESI). Основное преимущество индекса PESI заключается в надежной идентификации пациентов с низким риском 30-дневной смертности (классы PESI I и II, sPESI – 0) [1, 2]. При этом для выявления пациентов с высоким риском неблагоприятных событий достоверность индекса PESI остается сомнительной. В связи с этим сохраняется необходимость в выявлении дополнительных маркеров, позволяющих улучшать прогностическую способность существующих шкал стратификации риска [2].
Пациенты с дисфункцией почек (ДП) имеют более высокую частоту венозных тромбоэмболических осложнений по сравнению с лицами с нормальной функцией почек [3]. Кроме того, появляется все больше доказательств влияния ДП на неблагоприятные исходы (смерть) при ТЭЛА [4].
Острое повреждение почек (ОПП) является известным фактором неблагоприятного прогноза в смешанной популяции госпитализированных пациентов с сохраняющейся высокой летальностью [5]. Частота ОПП при ТЭЛА, по данным разных исследований, в основном ретроспективных, достигает 30% [6]. При этом наличие ОПП у пациентов с ТЭЛА нередко недооценивается [7].
ЦЕЛЬ ИССЛЕДОВАНИЯ: изучить частоту и выраженность нарушенной функции почек у больных ТЭЛА и оценить ее влияние на исход заболевания.
Материал и методы
Проведен ретроспективный анализ 109 историй болезни пациентов (мужчин – 45%, женщин – 55%), госпитализированных в один из стационаров Нижнего Новгорода (с 2018 по 2019 г.), которым в период госпитализации диагностировали ТЭЛА. Медиана возраста больных составила 67 (58; 75) лет. В анализируемой выборке 14 (12,8%) пациентов умерли (в среднем на 10-й день госпитализации).
Диагноз ТЭЛА устанавливали в соответствии с действующими рекомендациями [1, 8]. ОПП верифицировали по критериям национальных рекомендаций. При этом ОПП по уровню сывороточного креатинина (сКр) диагностировали следующим образом: 1) с помощью исходного сКр (сКр1), который сравнивали с «базальным», соответствовавшим скорости клубочковой фильтрации (СКФ) 75 мл/мин/1,73 м2; 2) за исходный принимали сКр в момент госпитализации с дальнейшей его оценкой в динамике (n=57, сКр2) через 48 часов [5].
Статистический анализ полученных результатов проводили с использованием специализированного пакета прикладных программ Statistica v. 10.0 (StatSoft. Ins., 2011), MedCalc 12.6.1.0. Результаты представлены в виде медианы (Ме) и квартилей (Р25; Р75), в %. Для сравнения количественных данных использовали U-тест Манна–Уитни и Краскела–Уоллиса. Для сравнения качественных данных использовали χ²-критерий. Оценку силы связи между признаками проводили с помощью корреляции Тау–Кендалла (τ). Для анализа независимых предикторов развития неблагоприятного исхода использовали логистическую регрессию (однофакторный и многофакторный анализы). Степень прогноза выражалась через отношения шансов (ОШ) с 95% доверительным интервалом (ДИ). Использовали ROC-анализ c построением характеристической кривой и указанием площади под кривой (AUC). Различия считали статистически значимыми при р<0,05.
Результаты
Доля больных ТЭЛА с расчетной СКФ (рСКФ) <60 мл/ мин/1,73 м2 при поступлении, которая рассматривается как ДП [9], составила 63,3%. При этом хроническая болезнь почек (ХБП) в анамнезе зарегистрирована только у трети (32,1%) больных, имевших мочекаменную болезнь или хронический пиелонефрит, или кисты и аномалии развития.
Более половины (54,1%) пациентов с ТЭЛА имели рСКФ в диапазоне 30–59 мл/мин/1,73 м2. Почти у каждого десятого (9,2%) пациента рСКФ была <30 мл/мин/1,73 м2, что говорит о выраженном нарушении функции почек.
В анализируемой выборке у 41,3% больных ТЭЛА при поступлении отмечалась протеинурия, у 11% – лейкоцитурия, у 21,1% – гематурия. В появлении последней нельзя исключать влияние догоспитального применения антикоагулянтов. Кроме этого при гематурии дифференциальный диагноз проводился с антикоагулянт-ассоциированным ОПП, тромбозом сосудов почек, злокачественными новообразованиями мочевыводящих путей. У пациентов с ОПП по сравнению с лицами без ОПП чаще выявляли мочевой синдром: протеинурия (49,2 и 29,5%; р=0,041). Лейкоцитурия была только у лиц с ОПП.
У 59,6% больных ТЭЛА ОПП диагностировано по величине сКр, в т.ч. по исходному сКр (n=54) и сКр в динамике (n=11). В течение первых 48 часов госпитализации динамика сКр определялась лишь у половины (52,3%) пациентов с ТЭЛА. У большинства (64,9%) пациентов с известным уровнем сКр в период госпитализации функция почек в динамике улучшилась, что определялось по снижению уровня сКр. У 20 (35,1%) пациентов сохранялся высокий уровень сКр по сравнению с исходными значениями, но он не соответствовал критериям ОПП. Среди них у 16 (80%) пациентов рСКФ была <60 мл/мин/1,73 м2, что очевидно указывает на наличие предшествующей ХБП.
У 10 (9,2%) пациентов как причину развития ОПП нельзя исключать влияние контрастного вещества при проведении компьютерной томографической ангиографии легких.
В анализируемой выборке при поступлении больные ТЭЛА с и без ОПП были сопоставимы по полу, данным анамнеза и индексам оценки клинической вероятности ТЭЛА (Geneva, Wells). При этом пациенты с ОПП были старше 70 (64; 76) и 63,5 (50,5; 70,5); р=0,004, и чаще имели в анамнезе хроническую сердечную недостаточность – ХСН (61,5 и 40,9%; р=0,034). Выявлена корреляция ОПП с возрастом (τ=0,23; р<0,001) и величиной индекса Geneva (τ=0,13; р=0,043).
У пациентов с ОПП в отличие от лиц без ОПП чаще определяли цианоз (64,6 и 34,1%; р=0,002), реже – повышение температуры тела (7,7 и 27,3%; р=0,008); более низкая сатурация – SpO2: 92 (88; 95,5) и 94 (90; 95); р=0,04. Кроме этого пациенты с ОПП имели более высокие значения PESI: 106 (84; 126) и 86,5 (71,5; 106); р=0,002 и sPESI: 1 (0; 2) и 0,5 (0; 1); р=0,027. Выявлена значимая прямая корреляция ОПП с частотой дыхательных движений – ЧДД (τ=0,13; р=0,048), ЧСС (τ=0,15; р=0,015) и обратная – с SpO2 (τ=-0,16; р=0,012). Пациенты с ОПП имели большие значения международного нормализованного отношения – МНО: 1,39 (1,22; 1,63) против 1,27 (1,09; 1,45), р=0,02 и меньшие – протромбинового индекса – ПТИ: 62 (51,4; 75) против 76,7 (60,3; 84,3), р=0,002. Получена положительная корреляция ОПП с креатинфосфокиназой MB – КФК-МВ (τ=0,14; р=0,049), МНО (τ=0,19; р=0,004), отрицательная – с ПТИ (τ=-0,28; <0,001).
По данным эхокардиографии, у пациентов с ОПП выявлена более высокая величина систолического давления в легочной артерии – СДЛА: 53 (42; 58) и 43 (34; 55,7); р=0,04, и поперечного размера левого предсердия: 40 (37; 45) и 38 (34; 42); р=0,02, чем у лиц без ОПП. Установлена положительная корреляция наличия ОПП с такими параметрами, как СДЛА (τ=0,17; р=0,01), поперечный размер правого желудочка (τ=0,15; р=0,02) и левого предсердия (τ=0,2; р=0,003).
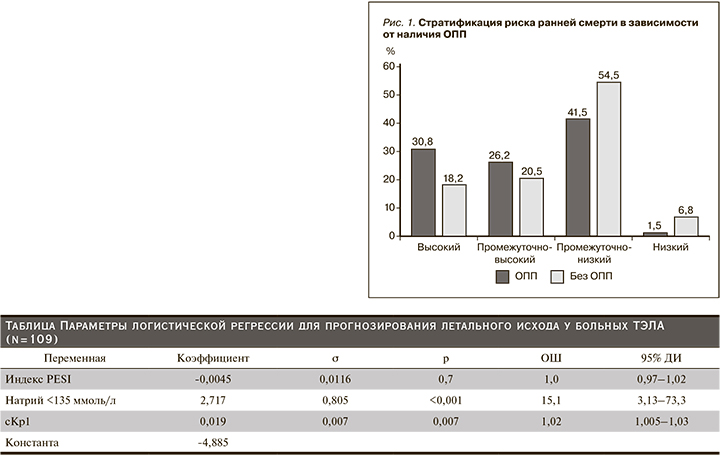
В анализируемой выборке 28 (25,7%) больных ТЭЛА при поступлении имели признаки шока, что говорит о наличии высокого риска ранней смерти. Всем диагностировано преренальное ОПП. При дальнейшей стратификации лишь у 4 пациентов определен низкий риск, остальные 70,6% имели промежуточный риск летального исхода. При наличии ОПП больные ТЭЛА чаще имели высокий и промежуточно-высокий (р=0,061) риск ранней смерти, реже определяли промежуточно-низкий и низкий риски (р=0,01) в отличие от пациентов без ОПП (рис. 1). Выявлена прямая корреляция ОПП с индексом PESI (τ=0,25; р<0,001). В период госпитализации у 40 (36,7%) пациентов течение ТЭЛА осложнилось развитием инфаркт-пневмонии (ОПП n=22) и у 7 (6,4%) – кровотечением (ОПП n=5).
Значимые предикторы развития ОПП в исследуемой выборке: возраст (ОШ=1,05 95% ДИ: 1,012–1,08; р=0,006), МНО (ОШ=3,37 95% ДИ: 0,97–11,76; р=0,012), число баллов по индексу PESI (ОШ=1,024 95% ДИ: 1,01–1,04; р=0,0005).
В анализируемой выборке 14 (12,8%) пациентов умерли. При исходной стратификации у 5 больных определен высокий, у 3 – промежуточно-высокий, у 5 – промежуточно-низкий и у 1 – низкий риск ранней смерти. Таким образом, при поступлении почти половина (42,9%) умерших имели промежуточно-низкий или низкий риски летального исхода, что указывает на несовершенство действующих способов оценки риска и необходимости их модификации. Среди умерших у 11 (78,6%) диагностировано ОПП. У пациентов с ТЭЛА выявлена прямая корреляция ОПП с госпитальной летальностью (τ=0,14, р=0,022). У умерших величина рСКФ была ниже: 36 (24; 42) мл/мин/1,73 м2, чем у выживших: 50 (39; 68) мл/мин/1,73 м2, р=0,006. При рСКФ≤36 мл/мин/1,73 м2 с чувствительностью 64,3% и специфичностью 83,2% прогнозировали летальный исход у больных ТЭЛА: AUC=0,73 (95% ДИ: 0,63–0,81; р=0,012), диагностическая эффективность составила 73,3%. В то же время в нашей выборке индексы PESI (AUC=0,59 95% ДИ: 0,5–0,69; р=0,28) и sPESI (AUC=0,58 95% ДИ: 0,49–0,68; р=0,24) в отдельности показали низкую прогностическую эффективность.
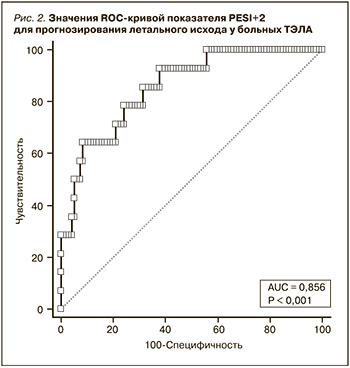
Выполнен многофакторный регрессионный анализ, по результатам которого в дополнение к индексу PESI выявлены 2 значимые переменные: уровень натрия в крови менее 135 ммоль/л и сКр1 (см. таблицу). Диагностическая значимость данной модели превышала установленный уровень (AUC 0,70), что позволило считать ее достаточно устойчивой (AUC=0,856 95% ДИ: 0,776–0,916; р<0,0001). Построено уравнение логистической регрессии для прогнозирования летального исхода у больных ТЭЛА: Y=-4,885+(-0,0045×индекс PESI)+(2,717×величина натрия в крови <135 ммоль/л)+(0,019×величина сКр1).
Полученному интегральному показателю «Y» присвоено имя – «PESI+2».
По результатам ROC-анализа (рис. 2) установлено, что при значении показателя PESI+2>-1,5192 увеличивается риск летального исхода у больных ТЭЛА, а величина ≤-1,5192 связана с большей вероятностью благоприятного течения заболевания. Прогностическая чувствительность показателя PESI+2 составила 64,3% (95% ДИ: 35,1–87,2), специфичность – 91,6% (95% ДИ: 84,1–96,3); диагностическая эффективность – 89%; отношение правдоподобия для положительного результата теста – 7,63, для отрицательного – 0,39.
Обсуждение
При острой ТЭЛА может нарушаться функция многих органов, включая почки. В то же время ДП связана со значительно более высоким риском развития венозных тромбоэмболических осложнений [3, 10], в т.ч. и в долгосрочном периоде [11].
Частота ДП (рСКФ<60 мл/мин/1,73 м2) при ТЭЛА колеблется в пределах 12–72% [12]. В отечественном регистре СИРЕНА ДП выявлена у 53% пациентов с ТЭЛА [9]. Ее чаще диагностировали у умерших [9]. При этом значение рСКФ≤50 мл/ мин/1,73 м2 надежно прогнозировало госпитальную летальность [9]. В нашей выборке ДП выявлена у 63,3% и величина рСКФ, которая позволяла прогнозировать летальность в стационаре, ≤36 мл/мин/1,73 м2. Нарушение функции почек у пациентов с ТЭЛА может быть связано как с предшествовавшей или недиагностированной ранее ХБП, так и с ОПП, в т.ч. на фоне ХБП. С учетом ретроспективного характера значительного числа исследований и в связи с отсутствием у большинства пациентов результатов сКр до поступления возникают сложности дифференциации ХБП от ОПП, поэтому в ряде работ предлагается ориентироваться на имеющуюся ДП при рСКФ<60 мл/мин/1,73 м2 [9].
По данным литературы, частота ОПП у пациентов с ТЭЛА варьируется от 5 до 30% [6, 7], при этом большинство исследований носило ретроспективный характер.
У пациентов с ТЭЛА присутствует большинство факторов риска и ассоциированных с ОПП состояний [5]. Среди механизмов, ведущих к развитию ОПП, отмечается повышение почечного венозного давления, снижение сердечного выброса и гемодинамическая нестабильность [5, 6].
Компьютерная томографическая ангиография является одним из основных методов диагностики ТЭЛА. При этом в отношении влияния контрастного вещества на риск развития ОПП однозначного мнения нет. В отдельных исследованиях пациенты с ТЭЛА имели высокий риск контраст-индуцированного ОПП (23,7%) [13], в других работах частота его была ниже (4,5%) и введение контрастного вещества не было связано с повышенным риском ОПП [14]. В нашей выборке контраст-индуцированное ОПП, вероятно, имели 9,2% пациентов с ТЭЛА.
Ранее была показана способность ДП улучшать прогностические возможности существующих индексов оценки риска летального исхода при ТЭЛА [15]. В одной из последних работ (n=1943) включение ДП (рСКФ по формуле MDRD) дополнительно к принятому Европейским кардиологическим обществом прогностическому алгоритму позволило реклассифицировать пациентов промежуточного и высокого риска [15]. При поступлении у пациентов с ТЭЛА нарушение функции почек ассоциировалось как с ранней смертностью от всех причин, так и с летальным исходом от ТЭЛА [16]. Это было продемонстрировано результатами крупного мета-анализа (13 исследований, n=35 662), в котором ранняя смертность от всех причин у пациентов с ХБП составляла 15% (против 5% без ХБП), с рСКФ<30 мл/мин/1,73 м2 – 30% (против 10%), с ОПП – 32% (против 13%) [17]. Кроме этого наличие ОПП ассоциировалось с повышенным риском крупных кровотечений у пациентов с ТЭЛА независимо от риска ранней смерти [17, 18].
В индексе PESI отсутствуют признаки, характеризующие функцию почек, который применяется для стратификации риска ранней смерти у больных ТЭЛА [1]. В регистре СИРЕНА ДП была независимым предиктором госпитальной летальности наряду с повышенным уровнем тропонина и наличием дисфункции правого желудочка [9]. При этом в нашем исследовании получена прогностическая модель «PESI+2», состоящая из 3 показателей (число баллов по индексу PESI, уровень натрия в крови менее 135 ммоль/л и сКр1), позволяющая оценивать вероятность госпитальной летальности у больных ТЭЛА. Полученная модель имеет хорошие прогностические показатели, однако ее эффективность (работоспособность) необходимо дополнительно оценивать на независимой выборке пациентов с ТЭЛА.
Основным ограничением работы является ее ретроспективный характер, что не позволило в полной мере получить информацию о догоспитальном уровне сКр и его динамике в стационаре. Вероятно, является недооцененной частота ХБП в анамнезе, а также не представляется возможным оценить приверженность приему, длительность и дозировки, ранее назначаемых антикоагулянтных препаратов.
Заключение
По данным проведенного ретроспективного анализа, ОПП было диагностировано более чем у половины (59,6%) госпитализированных больных ТЭЛА. Пациенты с ОПП были старше, чаще имели в анамнезе ХСН, а при объективном осмотре чаще имели цианоз и более низкую SpO2. Наличие ОПП у пациентов с ТЭЛА ассоциировалось с тяжестью дыхательной недостаточности, показателями коагуляционного профиля (МНО, ПТИ) и параметрами дисфункции правого желудочка (СДЛА, поперечный размер правого желудочка).
Получена прогностическая модель, состоящая из 3 показателей (число баллов по индексу PESI, уровень натрия в крови менее 135 ммоль/л и сКр), позволяющая оценивать вероятность раннего летального исхода у больных ТЭЛА. Показатели функции почек наряду с уровнем натрия в крови позволяют значительно улучшать возможности существующих прогностических индексов (PESI).
Таким образом, функция почек у больных ТЭЛА должна учитываться врачом при оценке риска неблагоприятных исходов. Раннее выявление ОПП у пациентов с ТЭЛА позволит своевременно вносить коррективы в тактику ведения с целью улучшения исходов заболевания.



