Проблема злокачественных заболеваний остается приоритетной для современного общества. Практически каждая семья так или иначе сталкивается с этой проблемой. Структура смертности от злокачественных новообразований (ЗНО) в различных возрастных группах имеет принципиальные различия. Причины смерти от злокачественных образований женщин репродуктивного возраста (до 39 лет) – рак шейки матки (РШМ) и рак яичника (РЯ). Рак молочной железы (РМЖ) – наиболее частая причина смерти женщин в возрасте 40–70 лет, особенно в 65 лет. Потери женщин репродуктивного возраста от 20 до 44 лет в 2018 г. составили 17,3% (7325 женщин), в 2016 г. – 16,3%, и это является важной социально-экономической проблемой [1–3].
Внимание к онкологическим заболеваниям обусловлено устойчивой тенденцией роста заболеваемости во всем мире, которая, по прогнозам, продолжит нарастать. Разница между высоким приростом заболеваемости и относительно стабильными показателями смертности обусловливает увеличение контингента пациентов с ЗНО. Так, в структуре онкологической заболеваемости репродуктивных органов женщин удельный вес этих заболеваний составил 39,2%. В возрастной группе 30–59 лет наибольший удельный вес имеют ЗНО молочной железы (16,1%), при этом опухоли половых органов составляют 18,2% всех ЗНО женщин.
В 2018 г. было выявлено 50 100 первично-множественных опухолей, что составляет 8,1% всех впервые выявленных ЗНО (в 2015 г.– 6,7%; 2016 г. – 7,5%). Известно, что первично-множественные поражения ЗНО являются одним из ключевых критериев проявления наследственных опухолевых синдромов [1, 4, 5].
Достижения современной жизни, прогресс в области здравоохранения отобразились на поведении, здоровье и долголетии людей. У женщин это выражается в раннем наступлении менархе, позднем наступлении менопаузы, отсроченных первых родах и малых их количествах. Также малоподвижный образ жизни и стресс – это те условия, при которых организм испытывает длительное воздействие эстрогенных гормонов, метаболиты которых вызывают повреждения ДНК. Частая смена половых партнеров приводит к неоднократным вирусным инвазиям и инфекционным заболеваниям, на фоне которых развиваются воспалительные заболевания. Все вышесказанное провоцирует реализацию онкологической предрасположенности в более раннем возрасте [6–8]. В развитых странах мира инвестируются значительные средства в раннюю диагностику и лечение больных ЗНО [9].Экономические траты на пациентов с ЗНО женских репродуктивных органов состоят из следующих составляющих: прямые затраты на профилактику, медицинское обследование и лечение, реабилитацию и социальное обеспечение больных. Косвенные потери оцениваются недовыработанным национальным доходом из-за нетрудоспособности или безвременной смерти больной. По мнению экспертов, стратегию борьбы против ЗНО необходимо направить на улучшение скрининговых программ, которые позволят определить степень риска и провести профилактические мероприятия до развития заболевания или выявить злокачественные опухоли на ранних стадиях. Такая позиция в перспективе сможет улучшить выживаемость онкологических больных и приведет к снижению смертности от рака [10–12].
Особый вопрос, касающийся ранней диагностики и лечения злокачественных опухолей репродуктивных органов у женщин репродуктивного возраста, обусловливается возможностью манифестации и/или сочетанием злокачественной патологии с периодом беременности или лактацией. Особенно это касается РМЖ, показатели которого являются лидером заболеваемости и смертности женщин во всем мире. Физиологические изменения репродуктивных органов во время беременности и в ранние сроки после родов меняют картину ряда клинических признаков и способствуют поздней диагностике злокачественных заболеваний. Каждая последующая беременность женщин – носителей патологической мутации сопряжена с возрастанием риска развития РМЖ, независимо от временного промежутка между родами [13].
Благодаря исследованиям в области клинической и молекулярной генетики, полученные знания выявили факты, позволяющие составить четкое представление об этиологии и патогенезе многих ЗНО. В реализации этих знаний помогает самая молодая дисциплина онкологии – клиническая онкогенетика, миссия которой – внедрение достижений молекулярной и клинической генетики для профилактики и ранней диагностики онкологических заболеваний у населения. Основным событием канцерогенеза является нарушение стабильности генома [14]. Важность генетической стабильности подтверждается еще на этапе эмбриогенеза, когда на ранних стадиях происходит гибель эмбриона, а также существованием ряда синдромов, которые проявляются снижением жизнеспособности организма, связанной с изменением на хромосомном и молекулярном уровне организации генома.
Для обеспечения генетической стабильности в ходе эволюции сформировалась сложная система взаимодействия генов, функция которых – регуляция клеточного цикла и скорости клеточного деления, репарации ДНК. Это супрессоры опухолевого роста, про-, анти- и апоптотические факторы, факторы антиоксидантной защиты [15–17]. При дисбалансе работы отрегулированного «оркестра» клетка начинает сохранять и накапливать различные генетические изменения: хромосомные перестройки, амплификации, точечные мутации, вирусные инвазии. Подобное происходит и при старении организма, только на протяжении более длительного времени. Это приводит к развитию как наследственных, так и спорадических злокачественных опухолей [18].
Роль патологической мутации в развитии рака молочной железы, рака яичников, рака эндометрия и колоректального рака
Накопленные знания определили клинико-генеалогические критерии наследственных опухолевых синдромов: возраст до 50 лет ко времени клинического проявления опухоли, трижды негативный РМЖ, первично-множественное поражение органов; РЯ (фаллопиевых труб), метастатическое поражение брюшины, отягощенный семейный анамнез, злокачественные образования у родственников I–II степени родства (мужчин и женщин), рак грудной железы у мужчины, выявленная патологическая мутация у родных – BRCA1, BRCA2, и/или CHEK2, RAD51, NBN, TP53, NBS1, PALB2, и др.
Благодаря новым технологиям геномного анализа, современные специалисты получили большие знания о механизмах развития наследственных онкологических заболеваний. В настоящее время описано более 35 наследственных опухолевых синдромов. Выявлены и клонированы более 200 мутаций, ответственных за развитие онкологического заболевания; многие наследственные синдромы характеризуются хромосомным дефектом в генах репарации ДНК [19–21]. За счет этого повышается частота разрывов ДНК, структурные хромосомные аберрации в соматических клетках и предрасположенность к ЗНО. Поскольку темпы геномных исследований ускорились, накопились данные, подтверждающие роль дополнительных генов, обладающих невысоким, но все же существенным риском в возникновении наследственных злокачественных заболеваний [19–21]. Определенную роль в степени риска играет наличие родных с онкологическим диагнозом, увеличивая риск от степени родства и от количества родных со ЗНО, особенно одинаковой анатомической локализации (табл. 1).

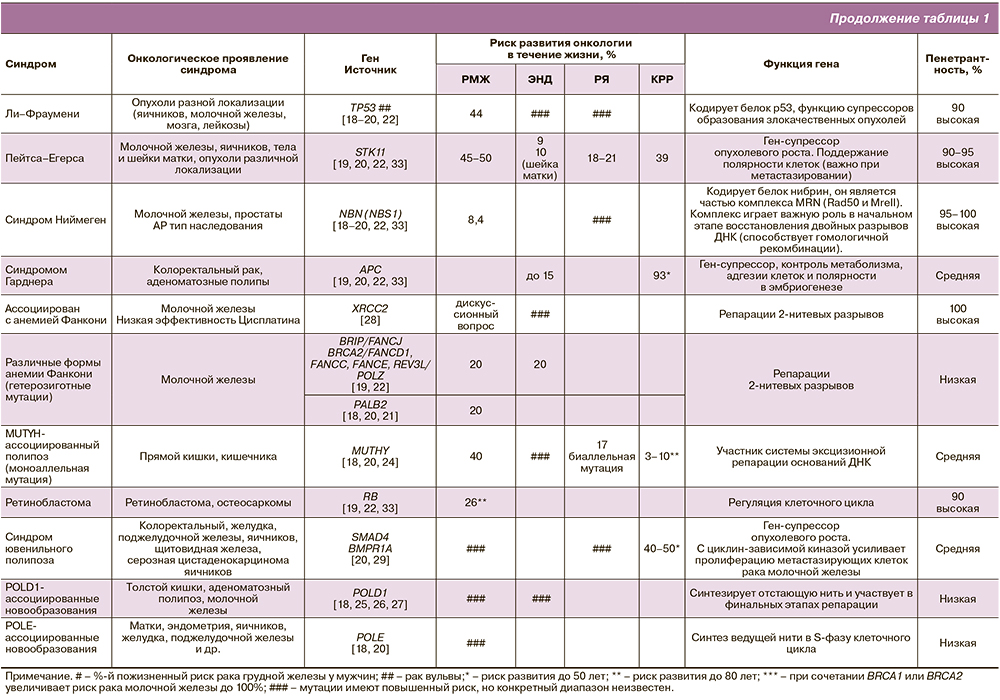
Нужно отметить, что мутации высокопенетрантных генов увеличивают риск развития ЗНО в 5–20 раз, среднепенетрантных – в 1,5–5 раз, а низкопенетрантных – в 0,7–1,5 раза. При наличии семейного онкологического анамнеза или сочетании нескольких мутаций риски увеличиваются.
Наследственный рак молочной железы и рак яичников
Доля наследственного РМЖ составляет 5–10% случаев, характеризуется известными генами и в основном аутосомно-доминантным типом наследования, т.е. 50% детей будут носителями патологической мутации. Наследственный РМЖ ассоциирован с высоким риском РЯ, поэтому в медицинской литературе применяют термин «синдром РМЖ/РЯ». При первичной локализации опухоли в молочной железе в 63,3% случаев отмечается двустороннее поражение яичников. Вклад наследственного РМЖ/РЯ в общую структуру ЗНО яичников – до 15%.
Данные исследования Kuchenbaecker B. и соавт. [29] демонстрируют, что носительство мутаций в генах BRCA1 или BRCA2 сопряжено с общим кумулятивным риском развития РМЖ до 80 лет: для носителей BRCA1 – 72%, ВRCA2 – 69%. По результатам исследования, у носителей мутации BRCA1 возрастной пик проявления заболевания РМЖ приходится на 35–39 лет, а у носителей мутаций BRCA2 описывают 2 пика: 43 и 54 года. К 50-летнему возрасту более 50% носителей мутаций генов BRCA1/2 уже имеют РМЖ. Кумулятивный риск возникновения РЯ для носителей мутации до 80 лет для BRCA1 – 44%, для BRCA2 – 17%. Риск контралатерального РМЖ через 20 лет после диагноза для носителей BRCA1– 40%, для BRCA2 – 26%. При отягощенном анамнезе риск РМЖ у женщин первой и второй линии родства до 70 лет с мутацией BRCA1 составляет 73 и 53%, а с BRCA2 – 65 и 39% соответственно. После редуцирующей билатеральной сальпингоовариэктомии риск снижается до 70% для BRCA1, для носителей BRCA2 – до 75% .
Роль скрининга наследственных мутаций в клинической практике
Наследственно обусловленные синдромы характеризуются высоким риском первично-множественного сочетания злокачественных образований, синхронным, метахронным или контралатеральным поражением, а также ранним началом клинического проявления заболевания. Поэтому для этой группы населения рекомендуется проведение диагностического мониторинга в более молодом возрасте. Во избежание снижения качества жизни и тревожности рекомендуется информировать пациента о том, на какие симптомы необходимо обращать внимание, о существующих возможностях, чтобы отсрочить начало заболевания, и как повлияет ранняя диагностика на прогноз и течение болезни. Также в целях профилактики метаболического синдрома нужно рекомендовать здоровый образ жизни, физические упражнения, контроль за уровнем сахара и артериального давления.
Выявление патологических мутаций в генах, ассоциированных с онкологическими наследственными синдромами, является основой генетических рекомендаций. Эти знания помогают носителям мутации увеличить шанс выживания за счет определения прогноза течения заболевания и принять самые адекватные и персонализированные профилактические и лечебные меры. Такие возможности нужно учитывать для проведения онкологического скрининга. Скрининг – метод активного выявления лиц с заболеванием и/или с повышенным фактором риска развития заболевания. Желательно, чтобы выявление болезни было настолько ранним, что проводимое лечение могло бы изменить его прогноз и дальнейшее клиническое течение. В силу высокой онкологической предрасположенности носителям патологической мутации рекомендован достаточно интенсивный и разнообразный скрининг [23, 30–33]. Благодаря этому решаются вопросы надлежащего и оптимального плана ранней онкологической диагностики, контрацепции, планирования беременности, профилактических и лечебных операций. Такой скрининг основан на применении комплекса специальных диагностических исследований и должен включать генетическое тестирование. По данным скрининга изучают распространенность заболевания, факторы риска его развития и относительность их значения. Оценка отдельных факторов риска и их сочетание характеризует степень риска появления новых случаев заболевания.
Стратегии снижения риска
Ранняя диагностика ЗНО, особенно яичников, является нерешенной проблемой во всем мире. Актуальны вопросы о рекомендуемом возрасте и выборе методов исследования, особенно для молодых пациентов, которые являются носителями мутаций в генах предрасположенности.
Рекомендации носителям мутаций в генах, ассоциированных со ЗНО, отображены в табл. 2.
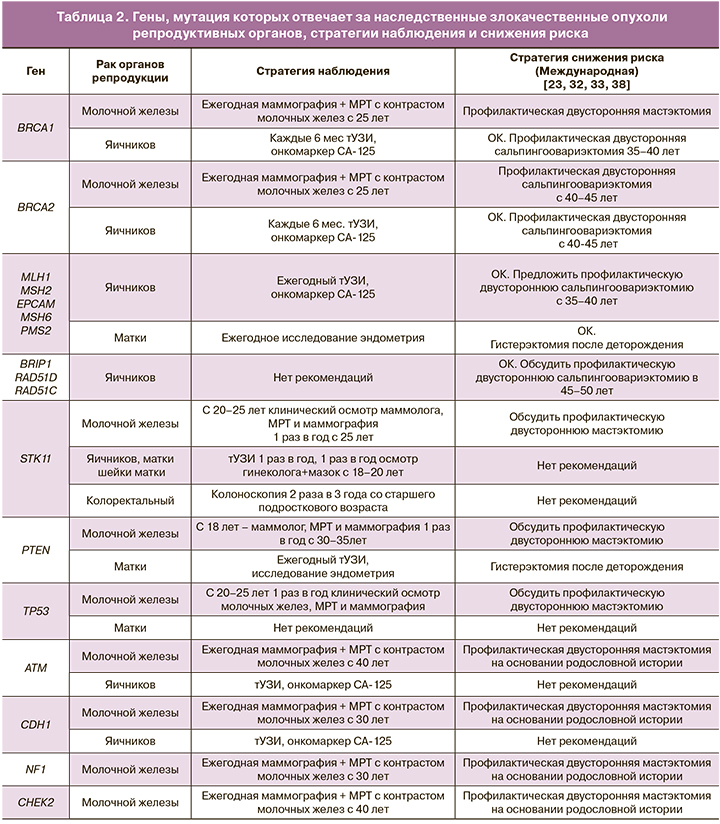
Исследование населения – точная идентификация женщин с повышенным риском развития РМЖ и РЯ – имеет особое значение для динамического наблюдения. Пациенткам, у которых высокий риск ЗНО выявлен на основании их семейного и/или мутационного анализа, рекомендуется начинать обследование молочных желез, области малого таза с 25 лет.
Скрининг РМЖ – данные маммографического скрининга в относительно молодом возрасте – пока не внушают оптимизма. Это объясняется высокой плотностью ткани молочной железы. Для улучшения результатов ранней диагностики одной из рекомендаций является изменение графика проведения маммографии на 1 раз в 6 месяцев или в год. Сочетание маммографии с ультразвуковым исследованием (УЗИ) молочной железы может быть недостаточным, в качестве дополнительного диагностического инструмента рекомендуют томосинтез и/или ежегодную магнитно-резонансную томографию (МРТ). Нужно учитывать, что скрининг маммографическим методом после 40 лет пропускает 25% случаев РМЖ, так как исследованием не охвачены носители мутаций генов BRCA1/2, у которых может возникнуть заболевание до 40 лет. Сравнение методов маммографии и МРТ при скрининге показало, что МРТ молочной железы является наиболее чувствительным тестом для выявления рака, независимо от группы риска [32]. Таким образом, МРТ помогает лучше выявить злокачественное образование молочной железы, но, учитывая возможность ложноположительных вариантов, может являться дополнением к УЗИ и/или маммографии.
Рекомендации – результаты клинических исследований отражены в рекомендациях международных и национальных профессиональных сообществах, таких как ACOG, SGO, ASCO, NCCN, во многом поддерживаются Российскими онкологическими обществами (RUSSCO, Ассоциация онкологов России, Российское общество клинической онкологии) и основываются на современных данных научной литературы и уровнях доказательности [30, 32–34]. Постоянно обновляющиеся данные расширили список мутаций, наличие которых является показанием для проведения риск-снижающей операции. В рекомендациях определен оптимальный возрастной порог проведения профилактических операций до возникновения заболевания [29, 30, 32–34]. В Российской Федерации профилактическая мастэктомия как метод профилактики рака рекомендован Ассоциацией онкологов и маммологов России в 2015 г. Особенностью рекомендаций является выполнение контралатеральной мастэктомии – профилактики второго рака РМЖ, которая снижает вероятность его развития на 90–100% [35].
Положительный результат теста на патологические мутации: понимание роли скрининга РМЖ, РЯ, рака эндометрия – скрининг РМЖ с помощью маммографии, МРТ с контрастом и УЗИ молочных желез на сегодняшний день остаются наиболее эффективными методами выявления ранних случаев онкологического заболевания.
Скрининг РЯ – скрининг ЗНО яичников, к сожалению, имеет историю относительно плохих результатов в отношении раннего выявления или профилактики заболевания. Относительно короткий интервал от ранней до поздней стадии заболевания, бессимптомное течение делают динамическое наблюдение особенно затруднительным. Как показывают исследования, УЗИ органов малого таза и измерение уровня сывороточного онкомаркера СА-125 неэффективны для скрининга РЯ среди населения и имеют большое количество ложноположительных результатов. Но все-таки скрининг целесообразен в группах высокого риска пациенткам 30–35 лет, которые еще не реализовали репродуктивную функцию или принимают решение о проведении риск-снижающей операции. Хорошо зарекомендовала себя интерпретация анализа онкомаркера CA-125 по алгоритму оценки риска РЯ ROCA (Risk of Ovarian Cancer Algorithm), основанному на динамике изменения уровней CA-125 во времени, а не на традиционном использовании его фиксированных референсных значений [31, 33].
Пациентам с мутациями, ассоциированными с синдромом Линча, которые имеют повышенный риск развития колоректального рака и рака эндометрия, рекомендуется с 20–25-летнего возраста проведение колоноскопии 1–2 раза в год, трансабдоминального и трансвагинального УЗИ с допплерометрией кровотока и/или исследование биоптата эндометрия 1 раз в год. Возраст исследования и проведение профилактических мер могут быть скорректированы на основании возраста возникновения первого онкологического заболевания в семье, нозологии и причины манифестации заболевания [23, 30].
Профилактические операции – в настоящее время мировая медицинская практика свидетельствует о том, что профилактические операции без онкологического заболевания снижают риск его развития до 95%. Кроме того, оперативное вмешательство осуществляется лапароскопическим доступом, предпочтительно не только в эстетических целях, но и во избежание большого раневого поля. Также важным вопросом является возрастной диапазон проведения профилактических операций [23, 30, 36].
В России применение профилактических операций является затруднительным; нормативная база, регламентирующая данную деятельность, практически отсутствует. Существует возможность проведения профилактической мастэктомии в качестве профилактики развития контралатерального РМЖ у носителей мутации с односторонним РМЖ.
По данным исследования за 4,7 года наблюдения 5689 женщин с мутациями генов BRCA1/2 без онкологического диагноза рассчитан ежегодный риск развития РЯ или фаллопиевой трубы. Выявлено 195 случаев злокачественной патологии: 169 (86%) – РЯ, 22 (11%) – рака фаллопиевой трубы и 4 (2%) случая включали РЯ и фаллопиевых труб. С мутацией BRCA1 диагностировано 176 (90%) случаев и 19 (10%) случаев злокачественной патологии – у женщин с мутацией BRCA2. Средний возраст женщин при постановке диагноза с мутацией BRCA1 составил 51,3 года (в диапазоне 30–84 года); особое внимание обращает на себя то, что 12 случаев диагностировано до 40 лет. Возрастной риск значительно увеличивается с 40–45 лет (годовой риск 1,17%) и достигает пика в возрасте 55–60 лет (годовой риск 2,25%). У женщин с мутацией BRCA2 диагностировано 19 случаев злокачественного заболевания; возраст женщин при постановке диагноза более поздний – 61,4 года (в диапазоне 44–80 лет). В возрасте до 40 лет не выявлено ни одного случая заболевания. Важно, что оценка риска возникновения рака у носителей мутации увеличивается с числом родных первой и второй степени родства, у которых есть ЗНО. За период наблюдения профилактическую овариэктомию перенесли 2146 (38%) женщин. Во время профилактической операции было диагностировано 45 (2,1%) случаев злокачественных образований. РЯ был у 25 (56%), фаллопиевых труб – у 20 (36%), РЯ и фаллопиевых труб – у 4 (9%) женщин. Среди носителей мутации BRCA1 у 41 женщины скрытое злокачественное заболевание диагностировано в возрасте от 35 до 40 лет. У четырех женщин с мутацией BRCA2 скрытый рак диагностирован до 48,5 года, один случай – до 45 лет. Таким образом, определен рекомендуемый возраст проведения профилактических операций: до 40 лет (в идеале до 35 лет) для носителей мутации BRCA1 и до 45 лет – для носителей мутации BRCA2 [37].
Возможность преимплантационной генетической диагностики для профилактики наследственных опухолевых синдромов
При современном развитии методов высокотехнологической медицинской помощи нельзя оставить без внимания возможность банкирования половых клеток молодых пациентов с онкологическим диагнозом перед радикальной операцией и/или прохождением химиотерапии (ХТ), с последующим обращением к специалистам вспомогательных репродуктивных технологий (ВРТ). Также нужно учитывать, что носители мутации могут проходить лечение по поводу бесплодия, невынашивания беременности и/или реализовывать свою репродуктивную функцию после 35 лет [38].
Носителям мутации в целях снижения риска передачи заболевания следующим поколениям и диагностики частых хромосомных патологий предлагают провести преимплантационную генетическую диагностику (ПГД) наследственной хромосомной патологии. В наше время ПГД предлагается во многих странах для выявления клинически значимых наследованных онкологических синдромов, таких как семейный аденоматозный полипоз кишечника, нейрофиброматоз, ретинобластома и т.п. [39–42]. Информация о ЗНО в родословной не всегда известна, или заболевание не проявилось в связи с молодым возрастом предков или их скоропостижной кончиной в результате несчастного случая, поэтому скрининг для выявления мутации в генах предрасположенности к заболеванию до реализации репродуктивной функции очевидно полезен. Нужно учитывать, что в нашей стране ПГД не входит в программу государственного финансирования и носит рекомендательный характер.
Подход, направленный на выявление патологических мутаций до проявления заболевания, увеличивает шанс на благополучный исход беременности, а также снижает риск передачи мутации потомкам. Это особенно актуально для носительниц мутации, ассоциированной с высоким риском наследственного опухолевого синдрома, так как вероятность прерывания и инвазивных манипуляций во время беременности максимально снижена.
Знания о генетике рака продолжают накапливаться по мере появления новой информации о ранее идентифицированных генах, а также о новых генах, ассоциированных с ЗНО репродуктивных органов. Понимание генетической предрасположенности к определенным видам рака быстро меняется от отдельных генов и синдромов к тестированию ряда генов. Поэтому рекомендации по скринингу и снижению риска ЗНО должны постоянно переоцениваться [30, 43, 44]. Кроме этого, знание генетического статуса имеет значение в жизни пациента и его семьи как для профилактики, так и для оказания медицинской помощи. К примеру, для индивидуального подбора оральной контрацепции или заместительной гормонотерапии нужно учитывать наличие рисков ЗНО, связанных с мутациями. Определенные оральные контрацептивы снижают риск РЯ и эндометрия в общей популяции, но ответ на вопрос, как препараты могут влиять на вероятность РМЖ, особенно у пациенток с наследственным риском, остается противоречивым [23, 36].
Также опухолевые клетки с мутацией демонстрируют высокую чувствительность к определенным химиотерапевтическим агентам. Поэтому наличие мутации является показанием для назначения определенной схемы лечения и комбинации химиотерапевтических препаратов [29, 30, 21].
Заключение
Независимо от того, где проходит наблюдение пациентов с высоким риском, координация скрининга и проведение мер по снижению риска должны проводиться коллегиально группой врачей, имеющих опыт консультирования таких пациентов относительно их рисков. Динамическое наблюдение за здоровьем должно осуществляться под руководством многопрофильной бригады квалифицированных специалистов, что особенно важно при предрасположенности к множественным ЗНО различной локализации. Актуально внедрение в скрининг высокотехнологичных методов ранней, в том числе доклинической, диагностики, так как изменения в клетке начинаются задолго до инвазивной стадии. Современные данные свидетельствуют о том, что меры скрининга и профилактики, адаптированные к группе высокого риска, снижают смертность от ЗНО. Также необходима разработка и внедрение профилактических подходов и индивидуальных лечебных мероприятий с учетом генетических факторов риска.



