Введение
По данным Международной диабетической федерации за 2017 г., распространенность сахарного диабета второго типа (СД2) продолжает расти в геометрической прогрессии, затрагивая все более молодые категории населения. Россия входит в топ 10 стран по количеству пациентов с СД2, что определяет высокий интерес к улучшению качества медицинской помощи, минимизации отдаленных осложнений, снижению инвалидизации и смертности [1]. Одной из наиболее важных и по-прежнему ключевых задач остается необходимость достижения ранней и целевой компенсации СД2 (HbA1c <7%), которой, по данным Государственного регистра больных СД, достигает около половины пациентов (52,1%) [2].
Согласно обновленным в 2017 г. алгоритмам медицинской помощи пациентам СД2, предпочтение в терапии должно быть отдано препаратам с минимальным риском гипогликемий и не способствующим увеличению массы тела. Более того, с целью персонализации терапии на любом этапе лечения при выборе препарата также рекомендовано учитывать доминирующую клиническую проблему. Так, аналоги глюкагоноподобного пептида-1 (аГПП-1) рассматриваются в качестве одного из приоритетных противодиабетических классов препаратов при лечении пациентов с СД2 и ожирением благодаря инновационному и физиологичному глюкозозависимому механизму действия, обусловливающему высокую эффективность в гликемическом контроле, в сочетании с низким риском гипогликемических реакций с дополнительным эффектом на снижение массы тела [6].
Следует подчеркнуть, что первым в мире в классе аГПП-1 был разработан препарат эксенатид (Баета®), с 2006 г. зарегистрированный и представленный в России. До последнего времени инъекционная форма, необходимость многократного введения аГПП-1 и потребность в титрации дозы налагали определенные ограничения на применение данного класса. Однако разработка пролонгированных форм аГПП-1, позволяющих однократное введение в неделю, открыла новые возможности для более широкого применения данного класса препаратов в терапии СД2.
Новая уникальная система доставки эксенатида
В марте 2017 г. на территории РФ был зарегистрирован новый аГПП-1 для применения 1 раз в неделю – препарат Баета® Лонг, являющийся пролонгированной формой уже хорошо известного в России и мире эксенатида. Согласно инструкции по применению, препарат показан для лечения СД2 в качестве дополнительной терапии к метформину, производным СМ, тиазолидиндиону, комбинации метформина с производными СМ или тиазолидиндионом в случае отсутствия адекватного гликемического контроля. Интересно, что препарат не требует титрации: рекомендованную дозу 2 мг необходимо вводить подкожно в область живота, бедра или плеча 1 раз в неделю, без связи с приемом пищи [3]. Надо отметить, что регистрация препарата в России состоялась существенно позже, чем в мире, что дает возможность проанализировать опыт развитых стран и использовать его для широкой клинической практики. Так, в Европе пролонгированная форма эксенатида применяется уже с 2011 г., в США – с 2012 г. и заняла свое место в алгоритмах управления СД2 [7].
Для создания пролонгированной формы эксенатида была применена технология с использованием микросфер Medisorb®. Микросферы имеют диаметр ~0,06 мм и состоят из биодеградируемого полимера D,L-молочной и гликолевой кислот, который подвергается полной биодеградации с образованием углекислого газа и воды. Данный полимер с 1980-х гг. применяется в качестве шовного материала, в составе пластин для остеосинтеза; также уже имеется опыт применения полимера для создания пролонгированных форм инъекционных лекарственных препаратов в психиатрии и онкологии. Непосредственно после введения препарата в подкожно-жировую клетчатку происходит немедленное высвобождение эксенатида с поверхности микросфер (~1%). Далее в процессе биодеградации полимера благодаря включению эксенатида в матрикс микросфер обеспечивается постепенное высвобождение препарата в плазму крови [8]. Концентрация эксенатида в плазме снижается ниже предела обнаружения примерно через 10 недель после прекращения терапии [3].
Биодеградируемые микросферы позволяют обеспечивать непрерывную системную экспозицию эксенатида при его приеме всего 1 раз в неделю без модификации активного белка. Постепенное повышение концентрации эксенатида в плазме крови обеспечивает благоприятный профиль переносимости со стороны желудочно-кишечного тракта по сравнению с аГПП-1 короткого действия [9]. Минимально эффективная концентрация эксенатида составляет 50 пг/мл и достигается на 2-й неделе терапии препаратом, что клинически проявляется снижением уровня глюкозы плазмы натощак (ГПН). Через 4–6 недель применения препарата отмечается значительное снижение уровня HbA1c, через 6–7 недель достигается равновесная концентрация эксенатида в плазме крови, что обеспечивает стабильный эффект [10].
Клинические исследования пролонгированной формы эксенатида
Для изучения возможности назначения эксенатида ПД на разных этапах лечения была разработана программа клинических исследований DURATION (Diabetes Therapy Utilization: Researching Changes in A1c, Weight, and Other Factors Through Intervention With Exenatide ONce Weekly), в которую вошли пациенты с СД2 с широким спектром характеристик и потребностей. Все исследования клинической программы DURATION являлись международными многоцентровыми рандомизированными исследованиями с активным контролем, имели схожий дизайн и включали пациентов в возрасте >16 лет с исходным уровнем HbA1c в диапазоне 7,1–11,0%, стабильной массой тела и индексом массы тела (ИМТ) <45 кг/м2. Основная фаза исследований длилась 24–30 недель (ряд исследований имели период продленного наблюдения от 1 до 7 лет).
В качестве первичной конечной точки оценивалось изменение уровня HbA1c от исходных значений. Препаратами сравнения являлись как пероральные сахароснижающие препараты (ситаглиптин, пиоглитазон), так и инъекционные: аГПП-1 (лираглутид, эксенатид короткого действия) и базальный инсулин [4].
Согласно объединенному post hoc анализу данных исследований DURATION-1–6, включившему 1379 пациентов, получивших хотя бы 1 дозу эксенатида ПД (популяция «назначенного лечения»), средний возраст пациентов составил 55 лет, 55% пациентов принадлежали к мужскому полу, средний ИМТ составил 32,5±5,4 кг/м2, исходный уровень HbA1c – 8,4±1,1, длительность СД2 – 7±6 лет. Снижение уровня HbA1c от исходных значений в исследованиях DURATION-1–6 в среднем составило -1,4% (95% ДИ – -1,5, -1,4%), ГПН – -36 мг/дл (95% ДИ – -38,4, -33,8 мг/дл). При этом у 29% пациентов снижение HbA1c составило более 2,0% через 24–30 недель терапии. Снижение HbA1c и ГПН было отмечено независимо от исходных значений HbA1c, однако, чем выше был исходный уровень HbA1c, тем большим было снижение вышеуказанных параметров. 59% популяции «назначенного лечения» достигли уровня HbA1c <7%, 39% пациентов <6,5% за указанный период [4].
Терапия эксенатидом ПД дополнительно сопровождалась коррекцией сердечно-сосудистых факторов риска, включая снижение массы тела (-2,5 кг [95%ДИ – -2,8, -2,3 кг]) и систолического артериального давления (-2,8 мм рт.ст. [95% ДИ – -3,5, -2,1 мм рт.ст.]). Эксенатид ПД не оказывал неблагоприятного воздействия на липидный профиль [3, 4]. В целом отмечена хорошая переносимость эксенатида ПД, эпизодов тяжелой гипогликемии зарегистрировано не было. Среди наиболее характерных нежелательных явлений (НЯ) отмечены НЯ со стороны желудочно-кишечного тракта (тошнота– 16%, диарея – 11%, рвота – 6%, запоры – 6%) и местные реакции (узелки в месте инъекции – 7%, кожный зуд – 5%). Вышеперечисленные НЯ, как правило, были транзиторными, легкой или умеренной степени выраженности, ассоциировались с началом терапии и редко (<1%) приводили к отмене препарата, частота развития данных НЯ снижалась с течением времени [4].
Особое внимание хотелось бы обратить на исследование DURATION-3, посвященное оценке эффективности и безопасности эксенатида ПД по сравнению с базальным инсулином. В исследование были включены 456 пациентов с СД2 в возрасте ≥18 лет с неадекватным гликемическим контролем на монотерапии метформином в максимально переносимых дозах (70% рандомизированных пациентов) или комбинации метформина и производных СМ (30% пациентов). Пациенты были рандомизированы в группу эксенатида ПД (2 мг 1 раз в неделю) или инсулина гларгин (в стартовой дозе 10 ЕД с титрацией до целевых значений гликемии натощак 4,0–5,5 ммоль/л) и наблюдались на протяжении 3 лет. Несмотря на титрацию дозы базального инсулина как через 26 недель наблюдения, так и по завершении периода продленного наблюдения до 3 лет, в группе пациентов, получавших эксенатид ПД, снижение HbA1c было статистически значимо более выраженным, чем в группе инсулина гларгин (через 26 недель: -1,5% [СО 0,05] против -1,3% [СО – 0,06]; разница между группами составила -0,16% [95% ДИ – -0,29, -0,03], p<0,05; через 3 года: -1,01% [СО – 0,07] против -0,81% [СО – 0,07] разница между группами -0,20% [95% ДИ – -0,39, -0,02], p=0,03). При этом частота развития гипогликемий в группе эксенатида ПД была в 3 раза ниже, чем в группе инсулина гларгин (0,3 эпизода на пациента в год против 0,9 эпизода на пациента в год). Стоит отметить, что риск развития гипогликемий был выше при сопутствующем приеме производных СМ в обеих группах [11, 12].
Масса тела через 3 года терапии снизилась в группе эксенатида ПД (-2,49 кг [СО – 0,28]) и увеличилась в группе инсулина гларгин (+2,01 кг [СО – 0,28]) по сравнению с исходными значениями, разница между группами была статистически значимой и составила 4,51 кг (95% ДИ – -5,23, -3,79; p<0,001). Также в группе эксенатида ПД было отмечено статистически значимое уменьшение окружности талии и бедер по сравнению с группой пациентов, получавших базальный инсулин, и улучшение функции β-клеток поджелудочной железы. Таким образом, эксенатид ПД представляется новой эффективной опцией для интенсификации сахароснижающей терапии для пациентов, которым ранее рассматривалась неизбежная инициация инсулинотерапии [12].
Другим исследованием программы DURATION, вызывающим дополнительный интерес, является международное многоцентровое открытое исследование DURATION-1, посвященное оценке долгосрочной эффективности и переносимости эксенатида ПД на протяжении 7 лет. Исследование уникально по длительности контролируемого наблюдения как в классе аГПП-1, так и среди сахароснижающих препаратов в целом. Согласно дизайну, исследование DURATION-1 состояло из двух частей. На протяжении первых 30 недель одна группа пациентов получала эксенатид ПД (n=148), в то время как вторая – эксенатид короткого действия (n=147). Далее все пациенты, завершившие 30-недельный период наблюдения, были переведены на эксенатид ПД и наблюдались до 7 лет (n=258). Средний возраст пациентов, включенных в исследование, составил 55 лет, 42% из них женщины, средний ИМТ=34 кг/м2, исходный уровень HbA1c – 8,4% [9].
Снижение уровня HbA1c и ГПН через 30 недель терапии по сравнению с исходными значениями были статистически значимыми в обеих группах, однако в группе эксенатида для применения 1 раз в неделю более выраженными по сравнению с эксенатидом для применения 2 раза в день (HbA1c: -1,9% [СО – 0,08] против -1,5% [CO – 0,08], p=0,0023 для разницы между группами; ГПН: -2,3 [CO – 0,2] ммоль/л против -1,4 [СО – 0,2] ммоль/л, p<0,0001 для разницы между группами), что, вероятнее всего, связано с большим влиянием эксенатида ПД на уровень глюкагона на фоне постоянной концентрации эксенатида в плазме крови при применении пролонгированной формы. Снижение массы тела по сравнению с исходными значениями было статистически значимым и сопоставимым между группами (-3,7 [СО – 0,5] кг против -3,6 [СО – 0,5] кг, p=0,89), хотя стоит отметить, что влияние эксенатида короткого действия на массу тела в настоящем исследовании было более выраженным, чем в опубликованных ранее рандомизированных исследованиях. Влияние на уровень постпрандиальной гликемии и скорость опорожнения желудка также были более выраженными в группе эксенатида короткого действия [9].
Интересен факт: из всех пациентов, завершивших 7-летний период наблюдения (n=122), 53% не потребовалось интенсификации сахароснижающей терапии на фоне приема эксенатида ПД. В течение пяти лет терапии эксенатидом ПД 88% пациентов не был назначен базальный инсулин. Снижение уровня HbA1c от исходных значений через 7 лет терапии составило -1,53% (p<0,05), массы тела -3,87 кг (p<0,05). При этом среди пациентов, не потребовавших интенсификации сахароснижающей терапии за 7 лет наблюдения, среднее снижение HbA1c составило -1,77% (p<0,05), массы тела -6,46 кг (p<0,05). Доля пациентов, достигших целевых значений HbA1c <7,0% и ≤6,5% за весь период наблюдения, отражена на рис. 1.
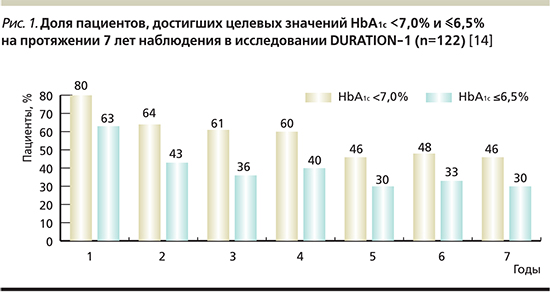
Таким образом, эксенатид ПД продемонстрировал стойкий положительный эффект на протяжении 7 лет в отношении гликемического контроля и массы тела. Профиль безопасности препарата соответствовал ранее известным данным [13, 14].
Исследование по оценке сердечно-сосудистой безопасности эксенатида ПД – EXSCEL
Известно, что риск смерти от сердечно-сосудистых причин у пациентов с СД2 в 2–4 раза выше, чем в среднем в популяции [15]. После печально известной истории с росиглитазоном к новым сахароснижающим препаратам со стороны регуляторных органов предъявляются дополнительные требования: помимо эффективного контроля гликемии необходимо также продемонстрировать отсутствие увеличения рисков развития неблагоприятных сердечно-сосудистых исходов [16, 17]. На сегодняшний день эксенатид ПД является единственным зарегистрированным на территории РФ аГПП-1 для применения 1 раз в неделю с доказанным профилем сердечно-сосудистой безопасности. Оценка влияния терапии эксенатидом ПД на сердечно-сосудистые исходы была проведена в международном многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании III/IV фазы EXSCEL (Exenatide Study of Cardiovascular Event Lowering). Первичной конечной точкой исследования была комбинация событий: нефатальный инсульт, нефатальный инфаркт миокарда, смерть вследствие сердечно-сосудистых причин [18].
В исследование были включены 14 752 пациента из 35 стран, включая Россию. 73,1% пациентов имели подтвержденное заболевание атеросклеротического генеза в анамнезе (перенесенный инфаркт миокарда или ишемический инсульт; стеноз артерии более 50% подтвержденный визуализирующими методами диагностики, или хирургическая реваскуляризация любой локализации в анамнезе; подтвержденный симптомный атеросклероз артерий нижних конечностей, ампутация в анамнезе). 16,2% пациентов имели сердечную недостаточность в анамнезе. Исследование продолжалось 7,5 лет с медианой наблюдения 3,2 года (максимальная длительность наблюдения составила 6,8 года).
В качестве сопутствующей сахароснижающей терапии пациенты могли получать до трех пероральных сахароснижающих препаратов (ПССП) или инсулин как в монотерапии, так и комбинации с 1–2 ПССП. Допускалась коррекция назначенной терапии до достижения целевых значений гликемии в обеих группах. Средний возраст пациентов, включенных в исследование, составил 63 года, 38% относились к женскому полу, средний ИМТ – 32 кг/м2, средняя продолжительность СД2 составила 12 лет на момент рандомизации, исходный уровень HbA1c – 8,0% [18].
От других исследований по оценке сердечно-сосудистой безопасности сахароснижающих препаратов EXSCEL отличает прагматический дизайн, который позволяет данному исследованию занимать «промежуточное» положение между рандомизированными контролируемыми исследованиями и исследованиями реальной клинической практики.
К основным чертам, благодаря которым дизайн исследования считается прагматическим, можно отнести следующие: широкие критерии включения (включены пациенты с различным уровнем сердечно-сосудистого риска, разрешено включение пожилых пациентов); отсутствие вводного периода для оценки комплаентности пациентов к назначенному лечению; минимальное вмешательство в принятые стандарты лечения (частота визитов пациента регламентировалась локальными стандартами оказания медицинских услуг и осуществлялась 1 раз в 6 месяцев, лабораторные данные предоставлялись локальными лабораториями; был разрешен прием любых сахароснижающих препаратов, кроме аГПП-1, включая ингибиторы натрий-глюкозного-котранспортера-2 и ингибиторы дипептидилпептидазы-4). Вышеуказанные отличия от «стандартных» контролируемых клинических исследований приближают дизайн исследования EXSCEL к условиям, в которых препарат применяется в реальной практике, при этом наличие рандомизации, ослепления и группы плацебо-контроля минимизирует вероятность систематических ошибок и соответствует существующим стандартам проведения клинических исследований [18].
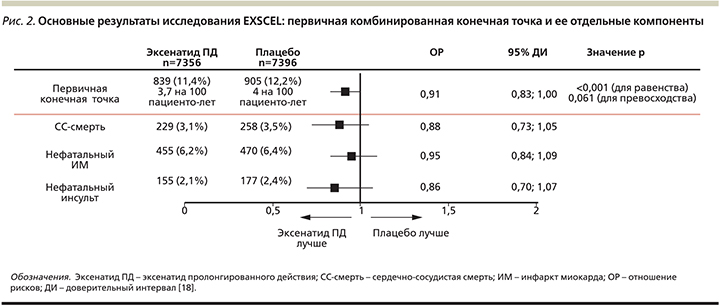
В данном исследовании была доказана сердечно-сосудистая безопасность эксенатида ПД, вероятность развития крупных сердечно-сосудистых событий, включая нефатальный инфаркт миокарда, нефатальный инсульт, смерть вследствие сердечно-сосудистых причин на фоне терапии эксенатидом ПД была сопоставимой с плацебо. В группе эксенатида первичная комбинированная конечная точка была зарегистрирована у 839 из 7356 пациентов (11,4%, или 3,7 события на 100 пациенто-лет), в группе плацебо у 905 из 7396 (12,2%, или 4,0 события на 100 пациенто-лет), отношение рисков составило 0,91 (р=0,06 для гипотезы превосходства), основные результаты представлены на рис. 2. Дополнительно в исследовании было продемонстрировано, что вероятность госпитализации вследствие сердечной недостаточности, острого коронарного синдрома, развития острого панкреатита, рака поджелудочной железы, рака щитовидной железы, ампутаций, ретинопатии также были сопоставимыми с плацебо. Интенсификация сахароснижающей терапии (ОР – 0,67; 95% ДИ – 0,63, 0,71; р<0,001) и инициация терапии базальным инсулином (ОР – 0,61; 95% ДИ – 0,54, 0,68; р<0,001) были отмечены статистически значимо реже в группе пациентов, получавших эксенатид ПД, по сравнению с плацебо [18].
Заключение
Эксенатид ПД (Баета® Лонг) показал себя как эффективный сахароснижающий препарат с длительным стойким влиянием на гликемический контроль и массу тела, что в совокупности с низким риском гипогликемий, применением всего 1 раз в неделю и хорошо изученным профилем безопасности делает его удобной современной опцией для терапии пациентов с СД2, некомпенсированных на фоне приема ПССП, позволяя отсрочить назначение базального инсулина.



