Введение
Пролголимаб – первый оригинальный PD-1-ингибитор изотипа IgG1 с модифицированным Fc-фрагментом.
В структуре препарата произведена замена двух аминокислот: лейцина на аланин (Leu234Ala/Leu235Ala). Благодаря LALA-мутации пролголимаб не связывается с FcyR-рецепторами макрофагов, что позволяет защищать популяцию активированных Т-лимфоцитов от возможного антителозависимого фагоцитоза макрофагами и тем самым максимизировать противоопухолевый эффект. Уникальный эпитоп связывания пролголимаба обеспечивает высокую насыщенность PD-1-рецепторов в минимальной концентрации [1].
В апреле 2020 г. пролголимаб впервые одобрен и зарегистрирован в РФ в качестве 1-й линии лекарственной терапии метастатической и местнораспространенной меланомы кожи (МК). Одобрение пролголимаба было основано на положительных результатах 2-й фазы открытого рандомизированного исследования MIRACULUM.
MIRACULUM (NCT03269565) – международное многоцентровое открытое рандомизированное исследование эффективности, фармакокинетических свойств, безопасности и иммуногенности препарата пролголимаб в монотерапии пациентов с нерезектабельной или метастатической меланомой. Исследование показало, что полный или частичный ответ наблюдался от 48% пациентов с МК, которые получали пролголимаб в качестве 1-й линии терапии, причем у большинства пациентов ответ на лекарственную терапию сохранялся длительное время. Двухлетняя общая выживаемость составила 57,1%, двухлетняя выживаемость без прогрессирования – 33,3%. Также отмечено, что новый препарат обладает благоприятным профилем безопасности с низкой частотой (12,7%) отмены терапии из-за нежелательных явлений [2].
В большинстве случаев ранняя диагностика онкологических заболеваний увеличивает безрецидивную и общую выживаемость. При местнораспространенных формах МК существует возможность улучшить показатели резектабельности, снизить частоту послеоперационных осложнений и улучшить отдаленные результаты лечения за счет использования предоперационной терапии.
За последние несколько лет значительно вырос научно-практический интерес к неоадъювантной иммунотерапии. Первоначальные результаты клинических исследований неоадъювантной иммунотерапии МК III стадии показали впечатляющие результаты по частоте объективного и патоморфологического ответов. Одно из таких исследований – OpACIN Trial (I фаза): применение комбинированной иммунотерапии в отношении пациентов с местнораспространенными формами МК. Его целью стало определение оптимальной дозировки комбинированной иммунотерапии. Однако высокая частота объективных ответов и низкая частота послеоперационных осложнений показали значительную перспективу данного научно-практического направления, несмотря на малую выборку пациентов [3].
OpACIN-neo (II фаза) – многоцентровое исследование, в котором исследовались пациенты той же когорты, но с уже установленным режимом терапии. После двух введений комбинированной иммунотерапии пациентам выполнялась лимфодиссекция таргетного лимфатического узла с последующей оценкой патоморфологического ответа. Его частота составила 70–80%, причем ни у одного из пациентов с достигнутым ответом рецидива заболевания не возникло [3, 4].
В подобном исследовании II фазы PRADO также проводилась комбинированная неоадъюватная иммунотерапия с последующим оперативным вмешательством. Назначение последующей адьювантной терапии основывалось на патоморфологическом ответе в удаленном лимфоузле. Пациенты с полным патоморфологическим ответом или близким к полному (≤10% жизнеспособных опухолевых клеток) не подвергались дальнейшему хирургическому вмешательству (тотальной лимфодиссекции) и оставались под динамическим наблюдением.
Пациентам с частичным патоморфологическим ответом (от 10 до 50% опухолевых клеток оставались жизнеспособны) выполнялась тотальная лимфодиссекция с последующим назначением адъювантной терапии в зависимости от статуса BRAF-мутации: либо ниволумабом, либо комбинацией BRAF/MEK ингибиторов (дабрафениб+траметиниб).
Во всей популяции исследования патоморфологический ответ на комбинированную иммунотерапию наблюдался у 70 пациентов, включая 60 пациентов с полным или близким к полному патоморфологическому ответу и 10 пациентов с частичным патоморфологическим ответом. При использовании неоадъювантной иммунотерапии удалось избежать выполнения тотальной лимфодиссекции 59 из 99 пациентам. Частота послеоперационных осложнений у пациентов, которым выполнялось только удаление таргетного лимфатического узла после неоадьювантной иммунотерапии, была на 40% ниже по сравнению с группой пациентов с выполненной тотальной лимфаденэктомией [5].
Первоначальные данные исследований II фазы многообещающи, однако необходимо проведение большего числа рандомизированных клинических исследований, способных продемонстрировать преимущество в общей выживаемости, прежде чем использовать неоадъювантный режим терапии в рутинной клинической практике.
В НМИЦ онкологии им. Н.Н. Петрова с сентября 2020 г. проводится проспективное контролируемое моноцентровое открытое нерандомизированное клиническое исследование по изучению эффективности применения отечественного PD-1-ингибитора пролголимаба пациентами с МК III стадии в неоадьювантном режиме. Исследование одобрено Локальным этическим комитетом при ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава РФ. Пациенты с местнораспространенными формами МК III стадии до начала оперативного лечения рассматриваются в качестве кандидатов для участия в данном исследовании.
Критерии включения:
1. Возраст ≥18 лет на время подписания формы информированного согласия.
2. Подписанная форма информированного согласия.
3. Морфологически верифицированный диагноз «меланома кожи».
4. Стадия опухолевого процесса – III (TNM 8-я пересмотренная редакция).
5. Отсутствие в анамнезе ранее проведенной иммунотерапии (анти PD-1-терапии).
6. Оценка по шкале Восточной объединенной онкологической группы (ECOG) 0 или 1.
7. Ожидаемая продолжительность жизни более 3 месяцев.
8. Соответствующая гематологическая функция и функция печени, определяемые с использованием результатов лабораторных исследований, полученных в течение 14 дней от начала включения в исследование.
В качестве неоадъювантой иммунотерапии используется препарат пролголимаб в дозе 1 мг/кг внутривенно капельно с частотой 1 раз в 2 недели. Всего планируется четыре введения препарата. Далее выполняется оперативное вмешательство (при возможности) с последующей оценкой патоморфологического ответа в опухолевом материале. Дальнейшая лечебная тактика – по выбору врача исследователя.
В рамках исследования проводится поиск предиктивных и прогностических иммуноонкологических факторов: оценка уровня циркулирующих опухолевых ДНК до начала терапии и по ее завершении, определение мутационной опухолевой нагрузки, другие иммунологические обследования.Первоначальные результаты исследования планируется опубликовать после анализа данных 20 пациентов, в т.ч. анализа биомаркеров и безрецидивной выживаемости.
В настоящее время в исследование включены 6 пациентов. Данные о пациентах представлены на рис. 1.
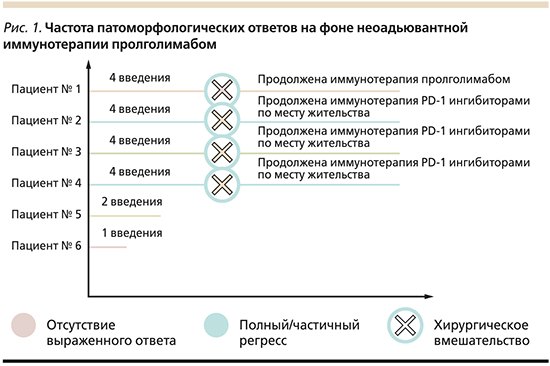
Четырем пациентам проведено четыре введения препарата пролголимаб с последующим циторедуктивным оперативным вмешательством. С учетом выраженного патоморфологического ответа на терапию иммунотерапия одному из четрых пациентов продолжена в прежнем режиме, трое других пациентов направлены в онкологические диспансеры по месту жительства для проведения иммунотерапии стандартными PD-1-ингибиторами. Двум больным начата предоперационная иммунотерапия пролголимабом. По завершении также планируется проведение циторедуктивного оперативного вмешательства. Отмечается удовлетворительная переносимость всеми пациентами без выраженных иммуноопосредованных нежелательных явлений.
Клинический случай
В качестве примера представляется клинический случай пациента 56 лет с клиническим диагнозом «меланома кожи правой голени с метастазами в правом паховом лимфатическом узле и транзитным метастазом в мягких тканях правой голени (р)Т4bN2сM0 (BRAF отр.)».
В июле 2020 г. выполнено иссечение опухоли кожи правой голени с биопсией сигнальных лимфатических узлов правой паховой области. По данным гистологического исследования определена изъязвленная поверхностно-распространяющаяся узловая эпителиоидноклеточная МК со слабой лимфоидной инфильтрацией, небольшим количеством пигмента, высокой митотической активностью (8 митозов на 1 мм2 опухоли). Уровень инвазии по Кларку – V, толщина по Бреслоу – 1,7 см. Края резекции вне опухоли. Метастаз в бедренном лимфоузле – 1,4 см в наибольшем измерении без выхода за пределы капсулы. Наличия мутации в гене BRAF не выявлено.
В августе 2020 г. отмечено появление опухолевого образования на коже правой голени, выявлено поражение паховых лимфатических узлов. Под ультразвуковой навигацией выполнена биопсия образования. По данным гистологического исследования: метастаз эпителиоидноклеточной пигментной меланомы с высокой митотической активностью.
В октябре 2020 г. после подписания информированного согласия начата иммунотерапия пролголимабом в неоадьювантном режиме. Осложнений лечения не отмечено. При контрольном обследовании после четырех введений препарата в декабре 2020 г. выявлены очаги в крестце и левой подвздошной кости. Ретроспективный анализ данных магнитно-резонансной томографии (МРТ) подтвердил наличие очагов в костях ранее – в сентябре 2020 г., однако природа их оставалась сомнительной. Эффект иммунотерапии расценен как стабилизация опухолевого процесса. С учетом наличия очагов в костях и невозможности радикального выполнения оперативного вмешательства принято решение о продолжении лечения. Иммунотерапия продолжена в прежнем режиме.
После семи введений пролголимаба выполнена биопсия образования кожи голени с целью оценки патоморфологического ответа. По данным гистологического исследования: выявлено менее 5% живых опухолевых клеток; узел с некрозами и инфильтратом, состоящим из гистиоцитов, меланофагов и пенистых макрофагов (рис. 2). Инфильтрат – 1,3 см в наибольшем измерении, распространяется за пределы капсулы лимфатического узла. Субтотальное замещение предсуществующего метастаза эпителиоидноклеточной меланомы участками некроза, фиброза и скоплениями гистиоцитов показано на рис. 3.
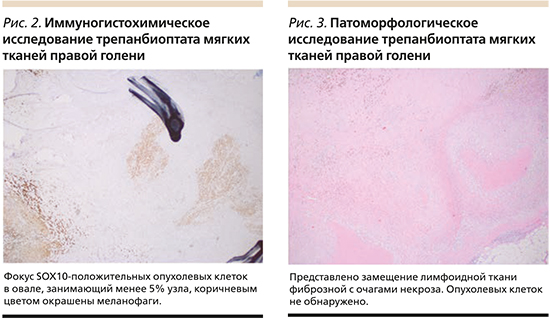
По результатам объективного обследования, включая МРТ органов малого таза, достигнут частичный регресс опухолевого процесса. Иммунотерапия пролголимабом продолжена.
Обсуждение
Наш опыт применения пролголимаба в терапии метастатических форм МК основан на позитивных результатах клинического исследования II фазы MIRACULUM.
В настоящее время в НМИЦ онкологии им. Н.Н. Петрова проводится терапия метастатических форм МК в рамках пострегистрационного исследования. Данные о пациентах представлены на рис. 4.
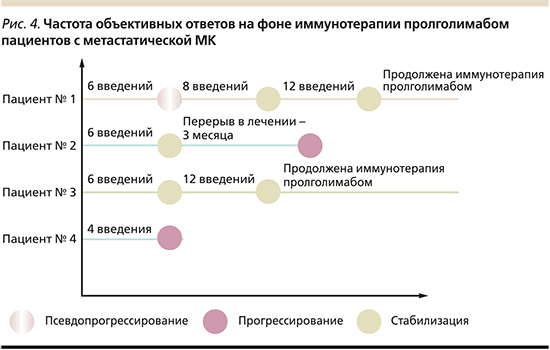
Проанализированы результаты лечения четырех пациентов с метастатическими формами МК. Стабилизации процесса удалось достичь троим пациентов, у одного из них зафиксирован один случай псевдопрогрессирования. После достижения стабилизации иммунотерапия пролголимабом одному пациенту была прервана на 3 месяца в связи лечением новой коронавирусной инфекции. К сожалению, в последующем у пациента при обследовании выявлено прогрессирование опухолевого процесса. У одного из четырех пациентов объективного ответа по данным радиологического обследования достигнуто не было и дальнейшего лечения не проводилось в связи с прогрессированием заболевания. В настоящее время иммунотерапию пролголимабом по поводу метастатической МК продолжают получать два пациента. Длительность терапии составляет более 6 месяцев при удовлетворительной переносимости и отсутствии серьезных нежелательных явлений.
Согласно результатам проведенных клинических исследований, эффективность неоадьювантной иммунотерапии значительно превосходит таковую терапии метастатических форм МК. Это может быть связано с более высокой ролью контрольной точки PD-1 у пациентов с локальными формами заболевания, поскольку на более поздних этапах развития опухолевого процесса все большее число различных факторов онкогенеза значительно влияет на резистентность опухоли к терапии. Кроме того, по данным многих исследователей, неоадьювантная иммунотерапия повышает число опухоль специфичных CD8 T-клеток как в периферической крови, так и в других органах, причем они определяются по прошествии 170 дней от завершения терапии. При проведении адьювантной терапии таких результатов получено не было, что может свидетельствовать о позитивном влиянии наличия большого пула опухолевых клеток на выработку иммунного ответа при проведении иммунотерапии [6].
Немаловажным фактом является низкий уровень Т-клеток после лечения пациентов с ранним прогрессированием, как и низкий уровень PD-L1-экспрессии, что также может свидетельствовать о большей роли контрольных точек в неоадьювантном лечении [7].
Результаты, полученные в исследованиях PRADO и OPAcinNeo, также свидетельствуют о том, что наибольшую пользу от проведения иммунотерапии получают пациенты с высоким уровнем PD-L1-экспрессии и высокой мутационной нагрузкой. Данные биомаркеры могут обладать высокой предиктивной значимостью в перспективе, однако они требуют дальнейшего изучения.
Заключение
Опыт применения пролголимаба в реальной клинической практике незначительно отличается от результатов регистрационного клинического исследования. Пролголимаб показал хорошие результаты в лечении больных МК, управляемый профиль токсичности и ее низкую частоту.
Роль неоадьювантной иммунотерапии в мире неуклонно возрастает. Она улучшает отдаленные результаты лечения, позитивно влияет на общую выживаемость больных МК, что подтверждено результатами рандомизированных клинических исследований.
Несмотря на малую группу пациентов, включенных в исследование, уже сейчас можно сказать о позитивном опыте применения пролголимаба в неоадъювантной терапии больных местнораспространенной МК. В будущем нами будет представлен анализ большей группы больных с оценкой влияния данной терапии на общую и безрецидивную выживаемость, а также анализ предиктивных и прогностических биомаркеров.



