Введение
По современным представлениям, инфекционный мононуклеоз (ИМ) является полиэтиологическим заболеванием. Синдромокомплекс включает лихорадку, тонзиллит, лимфаденопатию, гепатоспленомегалию, характерные изменения в гемограмме в виде появления атипичных мононуклеаров.
В XX в. ИМ рассматривался как заболевание, ассоциированное с вирусом Эпштейна–Барр (ВЭБ), однако уже долгое время его исключительная роль в этиологии данного заболевания пересмотрена. В настоящее время доказано, что наряду с ВЭБ этио-логически значимыми возбудителями мононуклеоза являются другие вирусы семейства Herpesviridae, причем ИМ может быть обусловлен одним из вирусов или их сочетаниями в различных фазах инфекционного процесса [1–3].
Вирус герпеса человека 6-го типа (ВГЧ-6) подсемейства β-герпесвирусов рода Roseolovirus считается общим названием для двух разных таксономических единиц: ВГЧ-6А и ВГЧ-6В [2, 4]. Об открытии нового вируса было сообщено в 1986 г. в журнале Science. ВГЧ-6 обладает пантропностью и может поражать головной мозг, миндалины, слюнные железы, почки, печень, лимфатические узлы, моноциты/макрофаги и клетки эндотелия [2].
Активная инфекция может вызывать внезапную экзантему, судороги с фебрильной провокацией, гистиоцитарный некротический лимфаденит, энцефалит и другие заболевания центральной нервной системы. ИМ также является одним из клинических проявлений данной инфекции, развивающихся чаще у подростков и взрослых.
В ранних описаниях ИМ, ассоциированный с ВГЧ-6, является неотличимым от заболевания, вызванного ВЭБ [4], однако в работах указывается на более редкое наличие ангины, увеличение печени и селезенки. Лихорадка менее продолжительная, интоксикация и лимфаденопатия выражены умеренно, сыпь отмечается у трети больных. Из лабораторных особенностей: умеренный лейкоцитоз, лимфомоноцитоз, возможна тромбоцитопения на 2-й неделе болезни, уровни трансаминаз повышаются незначительно. Атипичные мононуклеары появляются на 1–2-й неделе от начала заболевания, их уровень невысокий или они могут отсутствовать [4–6].
Экзантему на фоне ВГЧ-6-инфекции связывают с развитием неспецифического васкулита, который может проявляться в виде пятнистой, пятнисто-папулезной или геморрагической сыпи [7]. Морфологической основой сыпи, обнаруживаемой при биопсийном исследовании, является вакуолярная дегенерация базального слоя эпидермиса с редкими лимфоидными клетками и выраженная инфильтрация лимфоидных клеток, окружающих капилляры в дерме [8, 9].
ВГЧ-6 тропен к кардиомиоцитам, к эндотелию сосудов, что сопровождается хронической воспалительной реакцией в стенке сосуда, и в результате может проявляться тромботической микроангиопатией, артериитами крупных и мелких сосудов, молниеносным миокардитом [10, 11]. Репликация, полный цикл которой проходит приблизительно за 3 дня, значительно влияет на клетки хозяина, как на их морфологию, так и на функцию за счет апоптоза или некроза, возникающего в результате вирус-продуктивного процесса, а также за счет регулирования и изменения функций пораженных клеток [2]. В литературе есть упоминания о связи между выраженностью репликативной активности вируса и степенью поражений органов-мишеней, однако данные не систематизированы [10].
Далее приведен клинический случай ИМ, демонстрирующий особенность синдрома экзантемы на фоне высокой репликативной активности ВГЧ-6.
Клинический случай
Мальчик 10 лет поступил с жалобами на жидкий стул, сыпь на 6-й день болезни с диагнозом «аллергическая реакция, крапивница». Из анамнеза известно, что ребенок от 1-й беременности, самостоятельных родов, проводившихся под эпидуральной анестезией. Родился с весом 3500 г, длиной тела 53 см. Профилактические прививки против гепатита В и туберкулеза в роддоме проведены. Раннее развитие по возрасту. Грудное вскармливание до 6 месяцев. Перенесенные заболевания: острая респираторная вирусная инфекция, средний отит, ангина, бронхит, корь в 5 лет, ветряная оспа в 9 лет. Вакцинация, со слов матери, по Национальному календарю РФ. Аллергоанамнез отягощен: сыпь на лекарственные препараты (фенспирид сироп, бутамират капли, протаргол, диметинден таблетки для рассасывания). Наблюдается у офтальмолога по поводу миопии слабой степени.
Из анамнеза болезни известно, что у ребенка заболевание развилось остро, когда появились катаральные явления; осмотрен ЛОР-врачом, диагностирован экссудативный отит, по поводу которого он получал амоксициллин+клавулановая кислота (Аугментин) перорально в течение 6 дней. Во время всего периода лечения отмечался стойкий субфебрилитет. На 6-й день антибактериальной терапии появилась пятнистая сыпь в области лица с распространением по телу в течение следующего дня с отсутствием эффекта от однократного внутримышечного введения преднизолона.
При поступлении в стационар состояние ребенка средней степени тяжести, вялый, температура тела – 36,6°С. Отмечается одутловатость лица. На коже лица, туловища, конечностей распространенная умеренно отечная пятнистая сыпь неправильной формы, сливающаяся местами в обширные очаги, с экссудативным компонентом (лицо, туловище, верхние конечности), в области нижних конечностей необильные высыпания (рис. 1).
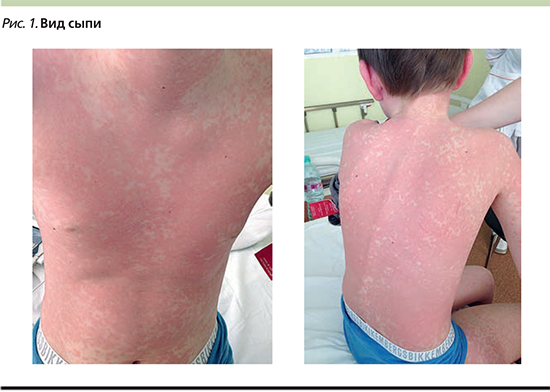
Умеренная гиперемия зева, гипертрофия миндалин I степени, налетов нет. Генерализованная лимфаденопатия.
В легких дыхание везикулярное, проводится во все отделы. Хрипов нет. Частота дыхания – 21 в минуту. Тоны сердца громкие, ритмичные, частота сердечных сокращений (ЧСС) – 88 в минуту. Живот мягкий, доступен пальпации во всех отделах, безболезненный. Печень и селезенка не увеличены. Стул жидкий однократно, с примесью зелени. Диурез сохранен.
Основные лабораторные данные представлены в таблице.
Полимеразная цепная реакция (ПЦР) крови: DNA-HHV 6–89 тыс. копий геном-эквивалент (коп)/105 клеток, DNA-CMV – отрицательно, DNA-EBV – отрицательно.
Иммуноферментный анализ крови: иммуноглобулин-М (IgM)-CMV, IgG-CMV, IgM-VCA-EBV, IgG-EA-EBV, IgG-EBNA1-EBV, IgG-HHV-6 – отрицательно.
Электрокардиография: синусовая брадиаритмия (ЧСС – 50–70 в минуту). Вертикальное положение электрической оси сердца.
По данным ультразвукового исследования (УЗИ) органов брюшной полости: перегиб желчного пузыря, диффузные изменения поджелудочной железы.
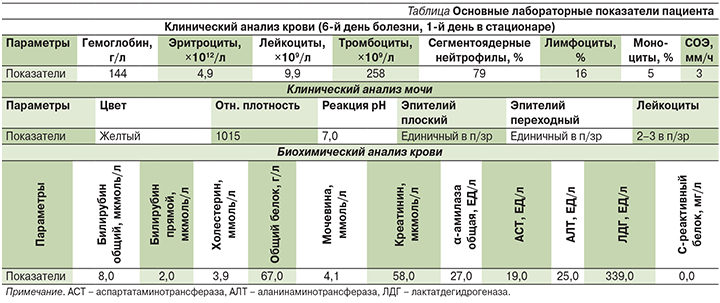
Анализ крови при помощи клеточного биочипа позволил определить процент и морфологию лейкоцитов, несущих на поверхности разные CD-антигены. Метод клеточного биочипа применяется для оценки иммунного статуса с 2013 г. [12, 13]. Число клеток, связавшихся с анти-CDx в процентах от числа клеток, связавшихся с анти-CD45RA (CD45RA+): 77% CD2+, 40% CD3+, 45% CD4+, 83% CD5+, 39% CD7+, 22% CD8+, 2% CD14+, 31% CD19+, 28% CD20+, 24% CD22+, 9% CD64+, 40% HLA-DR+, иммунорегуляторный индекс (CD4+/CD8+) – 2, атипичные мононуклеары СD45RA+ составили 10%, cреди клеток CD8+ было найдено 8% атипичных мононуклеаров (что составляет 2% от CD45RA+) и cреди клеток CD19+ 9% атипичных мононуклеаров (3% от CD45RA+) (рис. 2А, Б). Cреди В-лимфоцитов встречались активированные плазматизированные лимфоциты (7%) (рис. 2В).
Заключение: соотношение иммунокомпетентных клеток не отличается от нормы, повышение числа HLA-DR+клеток адекватно текущей вирусной инфекции, активирован Т-цитоксический клеточный и гуморальный иммунитет, косвенные признаки активной выработки антител.
В отделении проводили следующую терапию: инфузионная терапия солевыми растворами с пентоксифиллином № 6, преднизолон 2 мг/кг/сут в/в в составе инфузии № 4 с постепенным снижением дозировки, клемастин в/в струйно по 1,0 мл 2 раза в сутки № 6, Энтеросгель по 15 мл 3 раза в сутки перорально, Бифиформ по 1 капсуле 3 раза в сутки.
Таким образом, у ребенка верифицирована ВГЧ-6-инфекция высокого уровня репликативной активности, вирусная нагрузка составляла в крови 89 тыс. (коп)/105 клеток. Особенность кожных проявлений, возникших на 6-е сутки от начала терапии, вероятнее всего, обусловила сочетание нескольких факторов, а именно указанной вирусной нагрузки (значимо высокой по сравнению с наиболее часто регистрируемой у детей с сыпью на фоне ИМ, по собственным наблюдениям, число копий ДНК ВГЧ-6 составляет ≤500 (коп)/105 клеток), особенностью реактивности ребенка, в анамнезе у которого лекарственная аллергия на различные группы препаратов, лекарственной терапии, включавшей в дебюте заболевания антибиотик аминопенициллинового ряда. Истинно аллергический генез сыпи, по-видимому, не следует брать во внимание в связи с отсутствием положительной динамики после введения глюкокортикоидов. Исследование концентрации общих IgE у ребенка не проводилось.
Окончательный диагноз был сформулирован следующим образом: «Инфекционный мононуклеоз, вызванный ВГЧ-6, типичный, среднетяжелой формы. Токсидермия. Острый инфекционный энтероколит. Перегиб желчного пузыря. Панкреатопатия».
Динамика заболевания в отделении положительная: лихорадка купировалась в 1-е сутки пребывания в стационаре, на 4-е сутки от начала терапии сыпь со значительным уменьшением, к моменту выписки отмечаются угасающие элементы сыпи, стул нормализовался.
При выписке рекомендован прием ацикловира по 200 мг 5 раз в сутки, курс – 7 дней; Бифиформ 1 капсула 3 раза в сутки, курс – 10 дней; Лактофильтрум 1 таблетка 3 раза в сутки, курс – 5 дней.
Обсуждение
 В представленном клиническом случае ИМ ассоциирован с первичной острой ВГЧ-6-инфекцией, что подтверждается изменениями в клеточном иммунитете на фоне отсутствия специфических IgG к данному вирусу, диагностическим уровнем ДНК-емии ВГЧ-6 при ПЦР-исследовании. Примененный комплекс лабораторных диагностических методов, а именно ПЦР и твердофазного иммуноферментного анализа сыворотки крови, позволил верифицировать этиологический диагноз в оптимальные сроки. Развитие ИМ у ребенка школьного возраста из полиморфного клинического разнообразия данной герпесвирусной инфекции соответствует литературным данным [14]. Вместе с тем наш собственный опыт свидетельствует о том, что доля школьников и подростков составляет 9% в возрастной структуре ИМ, ассоциированного с моноинфекцией ВГЧ-6, которая в свою очередь является наиболее редкой среди всех этиологических причин ИМ – не более 9% случаев заболевания у детей.
В представленном клиническом случае ИМ ассоциирован с первичной острой ВГЧ-6-инфекцией, что подтверждается изменениями в клеточном иммунитете на фоне отсутствия специфических IgG к данному вирусу, диагностическим уровнем ДНК-емии ВГЧ-6 при ПЦР-исследовании. Примененный комплекс лабораторных диагностических методов, а именно ПЦР и твердофазного иммуноферментного анализа сыворотки крови, позволил верифицировать этиологический диагноз в оптимальные сроки. Развитие ИМ у ребенка школьного возраста из полиморфного клинического разнообразия данной герпесвирусной инфекции соответствует литературным данным [14]. Вместе с тем наш собственный опыт свидетельствует о том, что доля школьников и подростков составляет 9% в возрастной структуре ИМ, ассоциированного с моноинфекцией ВГЧ-6, которая в свою очередь является наиболее редкой среди всех этиологических причин ИМ – не более 9% случаев заболевания у детей.
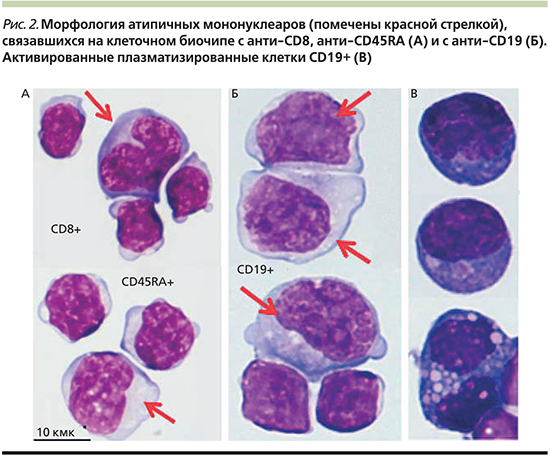
Развитие токсидермического синдрома не является патогномоничным клиническим проявлением ВГЧ-инфекции. Тем не менее его развитие часто ассоциировано с инфекционными заболеваниями вирусной этиологии. Среди причин следует рассматривать вирусиндуцированный иммунный ответ, при котором может отмечаться повреждающее воздействие иммунных факторов на стенку сосуда. Кроме этого эндотелиотропность ВГЧ-6 приводит к манифестации экзантемы – roseola infantum, exanthema subitum (рис. 3).
Как видно на рис. 3, экзантема при этих клинических формах не носит отечного сливного характера. Это позволило нам трактовать особенность кожного синдрома как результат взаимовлияющих неблагоприятных факторов, на прогностическую значимость которых в отношении развития токсидермии следует обращать внимание при ведении пациентов: уровень вирусной нагрузки, аллергический анамнез, прием аминопенициллинов. Существует предположение, будто в присутствии ряда препаратов (в т.ч. аминопенициллинов) возникает перекрестная реакция противовирусных Т-клеток с лекарственными средствами. Активированные цитотоксические CD8+-лимфоциты, направленные против антигенов вируса, в результате приводят к повреждению тканей [15]. Методом клеточного биочипа для оценки иммунного ответа у ребенка установлена типичность иммунных реакций в ответ на ВГЧ-6 при развитии ИМ с умеренной активацией Т-цитотоксических клеток и их доминирующая концентрация среди атипичных мононуклеаров периферической крови. Таким образом, можно предположить, что в представленном клиническом случае уровень вирусной нагрузки и влияние факторов риска развития токсидермии, но не иммунологические нарушения коррелируют со степенью выраженности и характером кожных проявлений, что требует дальнейшего изучения.



