Введение
Актуальность изучения проблемы хронической сердечной недостаточности (ХСН) у больных сахарным диабетом 2 типа (СД2) обусловлена широкой распространенностью этих заболеваний, общностью ряда механизмов патогенеза, а также высоким риском развития ХСН у пациентов с СД2. Число больных ХСН как в Российской Федерации, так и во всем мире ежегодно увеличивается. В России диагноз ХСН поставлен 7% населения (7,9 млн человек), при этом ХСН II–IV функциональных классов (ФК) по NYHA отмечается у 4,5% населения (5,1 млн человек), а наиболее тяжелые формы ХСН (III–IV ФК) – у 2,1% (2,4 млн). Несмотря на достигнутые успехи в ранней диагностике и лечении, ХСН в настоящее время остается заболеванием с довольно неблагоприятным прогнозом. Однолетняя смертность больных с выраженной ХСН достигает 12% даже в условиях их лечения в специализированном стационаре [1].
Еще более остро проблема ХСН стоит у пациентов с СД2. Согласно данным национального исследования NATION, распространенность СД2 в РФ составила 5,4%, что примерно соответствует 6 млн человек [2]. Многочисленные проспективные исследования подтвердили, что СД является независимым фактором риска развития ХСН. Так, по результатам одной из самых ранних работ, посвященных этой проблеме, Фрамингемского исследования, наличие СД повышает риск развития ХСН в 2 раза у мужчин и в 5 раз у женщин, причем этот риск удваивается в течение каждого десятилетия после 45 лет. Кроме того, сочетание СД2 и ХСН значительно ухудшает прогноз в отношении исходов этих заболеваний. По результатам исследования DIABHYCAR, смертность больных СД2 при наличии ХСН в 12 раз выше, чем у пациентов с СД2 без ХСН. Увеличение риска сердечно-сосудистых заболеваний (ССЗ) при СД2 связано с сочетанием общепопуляционных (артериальная гипертензия [АГ], дислипидемия, гиперкоагуляция, курение, злоупотребление алкоголем, ожирение, менопауза, гиподинамия) и специфических факторов риска, присущих диабету (гипергликемия, гиперинсулинемия, инсулинорезистентность [ИР]). Сочетание этих двух групп факторов риска у больных СД2 делает их более уязвимыми и создает предпосылки для развития патологических изменений со стороны системы кровообращения, что в свою очередь ухудшает прогноз по течению СД2, прогрессированию осложнений и смертности. С другой стороны, ХСН служит независимым предиктором развития СД2. ИР выявляется у 2/3 пациентов с ХСН, даже в отсутствие клинически явного СД. По результатам исследования ЭПОХА-ХСН установлено, что в РФ среди больных ХСН 11,9% имеют СД2 (у пациентов с ХСН III–IV ФК – 15,8%), в то время как в общей популяции распространенность СД2 составляет 2,9%.
Отличительной чертой эпидемиологии ХСН в РФ является то обстоятельство, что данному заболеванию гораздо больше подвержены лица женского пола, что объясняется значительными различиями в средней продолжительности жизни у мужчин и женщин. Так, в возрастных группах до 60 лет распространенность ХСН преобладает среди мужчин (более ранний дебют АГ и ишемической болезни сердца [ИБС]).
В 55-летнем возрасте риск развития ХСН в течение оставшейся жизни близок к выравниванию: 33% – у мужчин и 28% – у женщин. В дальнейшем за счет большей продолжительности жизни доля женщин, страдающих ХСН, в 2,6 раза превосходит таковую среди мужчин (72 и 28% соответственно) [3].
В структуре причин развития ХСН в РФ СД занимает почетное 4-е место после АГ, ИБС и хронической обструктивной болезнью легких (рис. 1)

Патогенез ХСН при СД2
По данным крупного исследования UKPDS, частота встречаемости ХСН у больных СД2 пропорциональна уровню гликированного гемоглобина (НbА1с) и риски ее развития увеличиваются на 8–12% на каждый 1% увеличения НbА1с [4]. Основные факторы риска совпадают с общепопуляционными: хроническая ишемия и инфаркт миокарда, АГ, клапанные пороки сердца, а также диабетическая кардиомиопатия (ДКМП). К дополнительным факторам риска относятся клинические признаки атеросклероза, уровень альбуминурии, декомпенсация СД, диабетическая нефропатия (ДН), избыточная масса тела (увеличение индекса массы тела на 1 кг/м2 увеличивает риск ХСН у мужчин на 5%, у женщин – на 7%).
В большинстве случаев ХСН у больных СД2 развивается вследствие АГ, ИБС, ДКМП и автономной кардиальной нейропатии (АКНП). ИР при СД2 способствует развитию АГ, активации симпатической нервной системы, вазоспазму, увеличению синтеза эндотелина-1, уменьшению выработки оксида азота, увеличению активности протеинкиназы С в сосудистом эндотелии. АГ ведет к гипертрофии миокарда, эндотелиальной дисфункции, активации ренин-ангиотензиновой системы, симпатикотонии, развитию и прогрессированию ДКМП и диастолической дисфункции. АГ обусловливает более ранний коронарный атеросклероз и ИБС. Морфологической основой развития ИБС у больных СД служит макроангиопатия, имеющая свои отличительные особенности: множественное диффузное поражение коронарных артерий, сниженный вазодилятационный резерв, пониженная фибринолитическая активность, повышенная агрегационная способность тромбоцитов.
К особенностям клинической картины ИБС при СД2 относится безболевая ишемия миокарда (31–42% случаев) в результате АКНП и ранней десимпатизации миокарда, микрососудистых повреждений (утолщение, фиброз сосудистой стенки, эндотелиальная дисфункция). Перенесенный инфаркт миокарда – частая причина развития систолической ХСН на фоне СД [5].
Структурно-функциональные изменения миокарда у пациентов с СД2 в отсутствие явной кардиальной патологии могут быть прямым следствием комплексных нарушений, ассоциированных с диабетом. В таких случаях правомочно говорить о наличии ДКМП, представленной двумя клиническими фенотипами: рестриктивным (фракция выброса левого желудочка сохранена) и дилатационным (низкая фракция выброса). Развитие ДКМП связывают с низким потреблением глюкозы кардиомиоцитами на фоне нарушения работы внутриклеточных транспортеров глюкозы GLUT-4. Вследствие этого повышается уровень свободных жирных кислот, усиливается их окисление, что требует большего количества кислорода по сравнению с глюкозооксидазным путем получения энергии и ведет к развитию относительной ишемии кардиомиоцитов (или усилению уже имеющейся), развитию внутриклеточного лактацидоза и контрактуре кардиомиоцитов на фоне задержки в них кальция. Повышенный уровень свободных жирных кислот способствует накоплению в кардиомиоцитах липидов, нарушает внутриклеточный кальциевый гомеостаз и в итоге снижает сократительную функцию кардиомиоцитов. Следствием всего этого считются угнетение систолической и диастолической функций левого желудочка, усиление оксидативного стресса в митохондриях, развитие дополнительных липотоксических эффектов, включая воспалительные изменения в миокарде [6].
Важную роль в развитии и прогрессировании ХСН у пациентов с абдоминальным ожирением играют медиаторы, продуцируемые висцеральными адипоцитами. Адипокины участвуют в регуляции углеводного и жирового обменов, иммунных и воспалительных процессах. Ангиотензин II и фактор некроза опухоли α усиливают синтез лептина, который через активацию факторов тканевого фиброгенеза увеличивает скорость фиброза в сердечной мышце, повышает активность симпатоадреналовой системы. Гиперлептинемия ассоциирована с коронарным атеросклерозом. Высокий уровень лептина и резистина усугубляет формирование диастолической сердечной недостаточности у больных СД2. Низкий уровень адипонектина связывают с патогенезом АГ, прогрессированием атеросклероза, высоким риском тромбообразования.
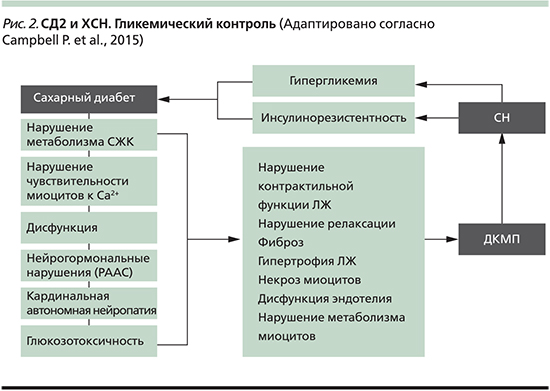
Существенный вклад в развитие и прогрессирование ХСН вносит АКНП, при которой в первую очередь страдает функция парасимпатической нервной системы. Основные клинические проявления АКНП: постоянная тахикардия, плохо поддающаяся терапии β-адреноблокаторами, ортостатическая гипотония, фиксированный сердечный ритм. Распространенность данного осложнения среди пациентов с длительным диабетическим анамнезом может достигать 60%. Аномальный симпатический тонус сопровождается увеличением сердечного выброса, повышением общего периферического сосудистого сопротивления, уменьшением эластичности сосудов, снижением резервов перфузии миокарда. Совокупность этих факторов ведет к увеличению рисков фатальных аритмий, внезапной смерти, инфаркта миокарда и ХСН [5, 6]. Основные звенья патогенеза ХСН при СД представлены на рис. 2.
В Алгоритмах специализированной медицинской помощи больным СД особое внимание уделяется индивидуализированному выбору целей сахароснижающей терапии (табл. 1, 2).
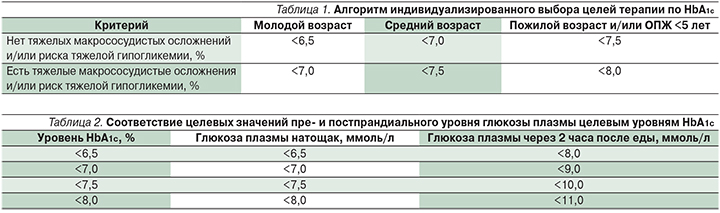
Индивидуальные целевые значения гликемии, НbА1с определяются с учетом возраста пациента, ожидаемой продолжительности жизни (ОПЖ), наличия тяжелых сопутствующих состояний, риска гипогликемий. Основные критерии риска гипогликемий: склонность к гипогликемиям в анамнезе, большая продолжительность СД, пожилой возраст, хроническая болезнь почек 3-й стадии и выше, деменция, инсулинотерапия (особенно интенсифицированные или базисно-болюсные режимы). Оценка эффективности проводимого лечения должна осуществляться 1 раз в 3 месяца, интенсификация терапии должна начинаться не позднее чем через 6 месяцев. Ключевой лозунг в стратегии гликемического контроля – Лечение до цели, а не до неудачи.
Бигуаниды
Метформин – препарат первого ряда для лечения СД2 и самый часто используемый пероральный сахароснижающий препарат (ПССП) во всем мире. Исследование UKPDS еще в 1998 г. показало безопасность и эффективность метформина в отношении сердечно-сосудистых рисков у больных СД2: риск развития сердечной недостаточности снизился на 32%, а риск макрососудистых осложнений (частота развития инфаркта миокарда) – на 39%. Эффективность и безопасность метформина для пациентов с СД2 и ССЗ подтверждены и в дальнейшем в виде уменьшения ФК ХСН, снижения числа случаев декомпенсации течения ХСН, улучшения качества жизни больных, отсутствия случаев развития лактацидоза [7]. Все это послужило основанием рекомендаций Американской диабетической ассоциации (ADA) и Европейского общества кардиологов (ESC) по использованию метформина в качестве препарата выбора для больных ХСН и СД2. Отечественные рекомендации предполагают использование метформина больнымм СД2 и ХСН I–II ФК с сохраненной функцией почек, однако не предусматривают его применение при ХСН III–IV ФК, а также в случаях ухудшения течения ХСН, требующих госпитализации больного [8, 9].
Тиазолидиндионы (глитазоны)
Механизм действия препаратов этой группы в первую очередь связан с увеличением чувствительности рецепторов мышечной и жировой ткани к инсулину, и до недавнего времени они активно использовались в качестве патогенетической терапии СД2 [9]. Однако с 2010 г. в европейских странах не рекомендуется применение препаратов росиглитазона в терапии СД2. Действуя путем блокирования АТФ-зависимых К-каналов, тиазолидиндионы могут приводить к изменениям электрофизиологии кардиомиоцитов и повышению риска фибриляции желудочков в период ишемии. Кроме того, препараты данной группы могут вызывать гипертрофию миокарда за счет увеличения синтеза биологически активных веществ: натрийуретического пептида, коллагена, фибронектина. Тиазолидиндионы способны приводить к задержке жидкости в организме, следовательно – к развитию отеков и увеличению массы тела, что негативно сказывается на течении ХСН. Данные негативные последствия приема росиглитазона были четко продемонстрированы в трех крупных исследованиях: DREAM, ADOPT и RECORD. Правда, позднее препараты пиоглитазона были полностью реабилитированы в исследованиях PROactive и CHICAGO в отношении негативного влияния на ССЗ [10]. Несмотря на это, в настоящее время считается общепризнанным, что тиазолидиндионы ввиду увеличения риска ХСН не должны применяться пациентами данной категории.
Препараты сульфонилмочевины
Механизм действия препаратов сульфонилмочевины (ПСМ) связан с блокированием АТФ-чувствительных К-каналов в митохондриях и сарколемме, что может сопровождаться развитием тахиаритмии, усилением активности оксидативного стресса, нарушением функциональных способностей митохондрий, развитием реперфузионных повреждений миокарда. Однако исследование UKPDS не подтвердило развития сердечной недостаточности на фоне приема ПСМ [11]. Безопасность ПСМ оценивалась и в системном мета-анализе SAFEGUARD, где было показано, что риск ХСН на фоне их приема на 20% выше, чем при применении метформина. Кроме того, приему ПСМ сопутствует риск гипогликемии, прибавки массы тела, быстрого развития ИР, что ухудшает прогноз в отношении сердечно-сосудистой безопасности [11, 12]. Несомненно, более безопасными препаратами этой группы являются ее более современные представители, такие как глимепирид и гликлазид МВ. Таким образом, несмотря на то что ПСМ в целом рассматривается как нейтральный в отношении ХСН, их использование пациентами с СД2 в сочетании с ХСН требует крайней осторожности.
Агонисты рецепторов глюкагоноподобного пептида-1
Агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1) наряду с ингибиторами дипептидилпептидазы-4 (ДПП-4) условно объединяют под названием «препараты инкретинового ряда», или «инкретины». аГПП-1 продуцируется энтероэндокринными клетками, представленными в дистальных отделах тонкого кишечника.
Механизм действия агонистов ГПП-1 связан с их воздействием на рецепторы ГПП-1 β-клеток поджелудочной железы и физиологической глюкозозависимой секрецией инсулина на фоне приема пищи, а также угнетением секреции основного антагониста инсулина глюкагона. Экспериментально установлено, что ГПП-1 регулирует экспрессию генов проинсулина и его биосинтез в поджелудочной железе оказывает протективный эффект на β-клетки, подавляя их апоптоз, а также способствуя их пролиферации и дифференцировке. Среди клинических эффектов ГПП-1 весьма значимы подавление секреции желудочного сока, угнетение моторики желудка и тонкого кишечника, что приводит к замедлению всасывания питательных веществ и дополнительному снижению постпрандиальной гликемии. ГПП-1 также ускоряет наступление чувства насыщения (действие на центры гипоталамуса), уменьшает аппетит и снижает массу тела. Однако нативный ГПП-1 достаточно быстро разрушается ферментом ДПП-4, тогда как препараты группы аГПП-1 устойчивы к биодеградации, характеризуются достаточно продолжительным действием, при этом обладая всеми панкреатическими и внепанкреатическими эффектами ГПП-1 [13].
Все аГПП-1 эффективны в плане снижения гликемии у пациентов с СД2 и безопасны в отношении риска гипогликемии. Кроме того, препараты этой группы оказывают выраженный кардиопротективный эффект в виде улучшения функции левого желудочка (увеличение фракции выброса), улучшения функциональных показателей (тест 6-минутной ходьбы, качество жизни, снижение массы тела). По результатам завершенного в 2016 г. крупного рандомизированного исследования LEADER у пациентов с СД2 и высоким сердечно-сосудистым риском лечение агонистом ГПП-1 лираглутидом приводило к статистически значимому снижению риска крупных нежелательных сердечно-сосудистых событий (МАСЕ), включая смерть от ССЗ на 22%, нефатальных инфаркта миокарда и инсульта на 13%, смерть от всех причин на 15% по сравнению с группой плацебо. Также на фоне приема лираглутида отмечено статистически значимое снижение на 13% риска госпитализаций по поводу ХСН [13]. Близкие результаты получены в исследовании SUSTAIN-6, где частота МАСЕ на фоне активного лечения агонистом ГПП-1 семаглутидом достоверно снижалась на 26%. При применении лираглутида отмечена достоверная положительная динамика в виде снижения массы тела (на 4,7%), уровней холестерина и триглицеридов (на 10%), липопротеидов низкой плотности (ЛПНП; на 19%) при повышении уровня липопротеидов высокой плотности (ЛПВП; на 18%) по сравнению с плацебо. Кроме того, прием лираглутида и эксенатида способствовал достоверному снижению у больных СД2 систолического артериального давления на 3,8–6,7 мм рт.ст. [14]. Эффективное снижение артериального давления на фоне приема аГПП-1 связывают с их сосудорасширяющим и натрийуретическим действиями.
В целом результаты проведенных клинических исследований позволяют говорить о сердечно-сосудистой безопасности и сердечно-сосудистой эффективности препаратов группы агонистов ГПП-1 для пациентов СД2 с высоким сердечно-сосудистым риском.
Оценка влияния терапии аналогом ГПП-1 эксенатидом (Баета Лонг) на сердечно-сосудистые исходы проведена в самом крупном международном многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании III–IV фаз EXSCEL (Exenatide Study of Cardiovascular Event Lowering), в которое были включены 14 752 пациента из 35 стран, включая Россию. ССЗ в анамнезе страдали 73,1% пациентов. Первичная комбинированная конечная точка исследования включала нефатальный инсульт, нефатальный инфаркт, смерть вследствие сердечно-сосудистых причин. В исследовании были доказаны сердечно-сосудистая безопасность эксенатида: вероятность развития указанных крупных сердечно-сосудистых событий при применении которого была сопоставимой с таковой плацебо. В группе эксенатида первичная комбинированная конечная точка была зарегистрирована у 839 из 7356 пациентов (11,4%, или 3,7 события на 100 пациенто-лет), в группе плацебо – у 905 из 7396 (12,2%, или 4,0 события на 100 пациенто-лет), отношение рисков (ОР) составило 0,91 (р = 0,06 для гипотезы превосходства). Дополнительно в исследовании было продемонстрировано, что риски госпитализации вследствие сердечной недостаточности, острого коронарного синдрома, развития острого панкреатита, рака поджелудочной железы, рака щитовидной железы, ампутаций, ретинопатии в группе эксенатида также были сопоставимыми с плацебо. Интенсификация сахароснижающей терапии (ОР=0,67; 95% доверительный интервал [ДИ] – 0,63-0,71; р<0,001) и инициация терапии базальным инсулином (ОР=0,61; 95% ДИ – 0,54–0,68; р<0,001) требовались в группе пациентов, получавших эксенатид продолжительного действия, достоверно реже по сравнению с плацебо.
Однако первые обобщенные выводы о кардиоваскулярной безопасности всей группы агонистов ГПП-1, по-видимому, можно будет сделать только после завершения и обработки данных еще одного крупного рандомизированного исследования REWIND, в котором применялся дулаглутид 1 раз в неделю (дулаглутид/плацебо; число пациентов – 9900), результаты которого пока недоступны. По данным других исследований дулаглутида, сердечно-сосудистые риски при его применении оказались аналогичными таковым в группах сравнения (активное лечение или плацебо). Не было выявлено существенных различий между группами дулаглутида и сравнения в отношении сердечно-сосудистой смертности, вероятности нефатального инсульта или госпитализации по поводу нестабильной стенокардии. Относительный риск возникновения нефатального инфаркта миокарда был в группе дулаглутида значительно ниже, чем в группе сравнения (ОР=0,35; р=0,014).
В целом на сегодняшний день препараты группы агонистов ГПП-1 оцениваются как безопасные, преимущественно с нейтральным влиянием на сердечно-сосудистую систему, что позволяет говорить о целесообразности их приема пациентами с СД2 и ХСН [15, 16]. Однако необходимо подчеркнуть, что лираглутид, согласно российским и зарубежным алгоритмам, остается единственным препаратом обсуждаемого класса, приоритетно рекомендованным для лечения СД у пациентов с атеросклеротическими заболеваниями.
Ингибиторы дипептидилпептидазы-4 (иДПП-4)
Механизм действия иДПП-4 или глиптинов связывают с селективным и обратимым угнетением функциональной способности ДПП-4 – фермента, отвечающего за расщепление ГПП-1, что позволяет восстановить нарушенный инкретиновый ответ в виде физиологической глюкозозависимой секреции инсулина в ответ на пищевые стимулы. Плацебо-контролируемое исследование TECOS (более 14 тыс. пациентов) по сердечно-сосудистой безопасности ситаглиптина у пациентов с СД2 и ССЗ выявило его нейтральное влияние на достижение основных кардиоваскулярных конечных точек (общая и сердечно-сосудистая смертность, нефатальные инфаркт миокарда и инсульт) у пациентов группы высокого кардиоваскулярного риска. Кроме того, в группе больных, получавших ситаглиптин, отмечена сопоставимая с группой плацебо частота госпитализаций по поводу сердечной недостаточности [15]. Сходные результаты были получены и в проспективном плацебо-контролируемом исследовании сердечно-сосудистой безопасности саксаглиптина SAVOR-TIMI (более 16 тыс. больных СД2 с анамнестическими данными о кардиоваскулярном событии или с высоким риском его развития). По результатам исследования группа саксаглиптина не имела отличий как по первичной комбинированной конечной точке МАСЕ (сердечно-сосудистая смерть, нефатальный инфаркт, нефатальный инсуль), так и по вторичной конечной точке МАСЕ+ (дополнительные госпитализации по поводу нестабильной стенокардии, коронарной ревасуляризации), однако было отмечено достоверное повышение частоты госпитализаций по поводу ХСН на 27% по сравнению с контрольной группой, правда, без повышения смертности [16]. Исследование VIVID (254 пациента с СД2 и ХСН I–III ФК по NYHA, плацебо-контролируемое) по безопасности ингибитора ДПП-4 вилдаглиптина показало отсутствие достоверных различий с контрольной группой по частоте госпитализаций по поводу ХСН, что говорит о нейтральном влиянии препарата на прогрессирование ХСН (8,6 против 3,2% в группе плацебо). Отсутствовали достоверные различия и по частоте госпитализаций по поводу ХСН, однако сердечно-сосудистая смертность была выше в группе вилдаглиптина (5,5 против 3,2%).
В связи с этим в рекомендации стран ЕС внесена информация о недостаточной безопасности применения саксаглиптина и вилдаглиптина у пациентов с сердечной недостаточностью.
Таким образом, препараты группы иДПП-4 следует рассматривать как лекарственные средства с нейтральным действием в отношении основных кардиоваскулярных конечных точек (должна соблюдаться осторожность в отношении саксаглиптина), т.е. достаточно безопасные в отношении больных СД2 высокого кардиоваскулярного риска. При этом препаратами выбора с доказанным отсутствием негативного влияния на течение ХСН у пациентов с СД2 в данной группе пока остаются ситаглиптин и вилдаглиптин.
До настоящего времени изучается вопрос о механизмах негативного влияния саксаглиптина и, возможно, алоглиптина на функцию миокарда (исследования SAVOR-TIMI, EXAMINЕ). В 2018 г. закончилось исследование CARMELINA по сердечно-сосудистой безопасности линаглиптина у больных СД2 (8300 пациентов, плацебо-контролируемое), по данным которого показана безопасность препарата в отношении сердечно-сосудистых рисков, общей смертности и риска госпитализации по поводу сердечной недостаточности по сравнению с плацебо [16].
Ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2)
Препараты этой группы представляют собой относительно новый класс ПССП с достаточно высокой эффективностью. Основной механизм их действия связан с ингибированием НГЛТ-2, что увеличивает транспорт глюкозы по направлению к дистальной части нефрона, уменьшает почечную гиперфильтрацию, снижает порог почечной реабсорбции для глюкозы, в результате чего с мочой выводится от 80 до 100 г глюкозы в сутки. Главная особенность препаратов этой группы – инсулиннезависимый механизм действия. иНГЛТ-2 достаточно безопасны в отношении риска гипогликемий, если они не используются в сочетании с ПСМ или инсулином. Препараты этой группы снижают уровень ЛПНП, повышают уровень ЛПВП, умеренно снижают массу тела, артериальное давление без увеличения частоты сердечных сокращений. Исследование по изучению влияния ингибитора НГЛТ-2 эмпаглифлозина на сердечно-сосудистые исходы у пациентов с СД2 и высоким риском сердечно-сосудистых событий – EMPA-REG-OUTCOME (7020 больных, средний период наблюдения – 3,1 года) – показало снижение риска развития первичной комбинированной конечной точки (смертность от ССЗ, нефатальный инфаркт миокарда или инсульт) на 38%, госпитализаций в связи с сердечной недостаточностью на 35%, смерти от всех причин на 32%. [17]. На сегодня эмпаглифлозин считается самым безопасным препаратом данной группы, что стало основанием для включения его в рекомендации ESC 2016 г. по диагностике и лечению острой сердечной недостаточности и ХСН, согласно которым эмпаглифлозин должен рассматриваться в отношении пациентов с СД2 как препарат для профилактики или замедления развития ХСН, а также как средство, способствующее увеличению продолжительности жизни (класс рекомендаций IIа, уровень доказательности В). Кроме того, согласно рекомендациям Европейской ассоциации по изучению диабета (EASD) 2016 г. по профилактике ССЗ в клинической практике у пациентов с СД2 и патологией сердечно-сосудистой системы, следует как можно раньше начинать использовать препараты группы иНГЛТ-2 для снижения сердечно-сосудистой и общей смертности (класс рекомендаций IIа, уровень доказательности В) [17, 18].
В отношении дапаглифлозина по результатам исследований CVD-REAL в условиях реальной клинической практики также получены весьма впечатляющие результаты. Так, в обсервационном исследовании, выполненном на основании данных Шведского национального регистра системы здравоохранения, изучалась возможная взаимосвязь терапии препаратами групп иНГЛТ-2 и иДПП-4 с изменениями риска общей смертности, развития СЗЗ или тяжелой гипогликемии по сравнению с инсулинотерапией. В исследование были включены все пациенты с СД2 из Швеции в 2013–2014 гг., которые впервые начали принимать иДПП-4 или иНГЛТ-2 (дапаглифлозин). Результаты применения указанных групп препаратов сравнивались с таковыми лечения пациентов, которым была начата инсулинотерапия. Группа больных, получавших ПССП, включала 21 758 человек, группа на инсулинотерапии – 37 603; медиана наблюдения составляла 1,51 и 1,53 года соответственно. Терапия иДПП-4 или иНГЛТ-2 ассоциировалась со снижением риска общей смертности на 44% (ОР=0,56; 95% ДИ – 0,49–0,64), развития ССЗ на 15% (ОР=0,85; 95% ДИ – 0,73–0,99) и тяжелой гипогликемии на 74% (ОР=0,26; 95% ДИ – 0,12–0,57) по сравнению с инсулинотерапией. При раздельном анализе воздействия двух групп ПССП дапаглифлозин ассоциировался со снижением риска общей смертности на 56% (ОР=0,44; 95% ДИ – 0,28–0,70) и развития ССЗ на 49% (ОР=0,51; 95% ДИ – 0,30–0,86), в то время как терапия иДПП-4 снижала лишь риск общей смертности (на 41%; ОР=0,59; 95% ДИ – 0,51–0,67), практически не влияя на ССЗ (ОР=0,87; 95% ДИ – 0,75–1,01; рис. 3) [19].

Аналогичные результаты по снижению риска сердечной недостаточности и общей смертности получены и по результатам исследований CVD-REAL c участием более 300 тыс. больных СД2 с ССЗ или без них, лечившихся в условиях рутинной клинической практики 6 стран (США, Норвегия, Дания, Швеция, Германия, Великобритания). Пациенты были разделены с учетом индекса соответствия на две лечебные группы в соотношении 1:1. В обеих группах больные впервые начинали сахароснижающую терапию. Одна из групп получала иНГЛТ-2, другая – препараты различных классов ПССП. При этом в группе иНГЛТ-2 канаглифлозин получали 53% пациентов, дапаглифлозин – 42% и эмпаглифлозин – 5%. Средняя продолжительность наблюдения составила в группах 253 и 233 дня соответственно. По результатам исследований за весь период наблюдения в группе иНГЛТ-2 по сравнению с группой других ПССП отмечено достоверное снижение риска госпитализаций по поводу ХСН на 39% (ОР=0,61; 95% ДИ – 0,51–0,73), общей смертности на 51% (ОР=0,49; 95% ДИ – 0,41–0,57) и комбинации этих показателей на 46% (ОР=0,54; 95% ДИ – 0,48–0,60), что согласуется с результатами рандомизированного клинического исследования эмпаглифлозина. Кроме того, тот факт, что у 87% пациентов, получавших иНГЛТ-2, не было ССЗ, указывает на возможные благоприятные кардиоваскулярные эффекты этих препаратов в широкой популяции больных СД2. И наконец, снижение частоты госпитализаций и общей смертности на фоне терапии иНГЛТ-2, вероятно, является эффектом этого класса препаратов, т.к. в ходе исследования не выявлено значимой гетерогенности показателей в разных странах, несмотря на географические различия в применении отдельных препаратов группы иНГЛТ-2 (в США примерно 76% пациентов применяли канаглифлозин, в Европе примерно 92% – дапаглифлозин) [20].
В сентябре 2018 г. были анонсированы успешные результаты исследования III фазы DECLARE-TIMI 58 по кардиоваскулярным исходам применения препарата дапаглифлозин. DECLARE-TIMI 58 – рандомизированное двойное слепое плацебо-контролируемое мультицентровое исследование продолжительностью 5 лет с участием более 17 тыс. пациентов с СД2 из 33 стран, включая больных с множественными факторами риска кардиоваскулярной патологии или уже диагностированными ССЗ. Результаты исследования подтвердили безопасность дапаглифлозина в отношении сердечно-сосудистых исходов у пациентов высокого кардиоваскулярного риска, продемонстрировав достоверное снижение риска госпитализаций по поводу ХСН, сердечно-сосудистой и общей смертности [21]. Детальное представление данных исследования планируется 10 ноября 2018 г. на научной сессии Американской ассоциации кардиологов в Чикаго (США).
Результаты исследований CANVAS и CANVAS-R по изучению эффективности и безопасности канаглифлозина убедительно продемонстрировали снижение риска достижения первичной конечной точки по ССЗ на 14% и количества госпитализаций по поводу ХСН на 33%. Отмечено значимое снижение альбуминурии, что дает основание говорить о нефропротекции и возможном замедлении прогрессирования хронической болезни почек [22, 18].
Однако при использовании ингибиторов НГЛТ-2 должны учитываться их потенциальные побочные эффекты: инфекции мочевыделительной системы, гиповолемия, «эугликемический» диабетический кетоацидоз, развитие остеопороза. Особенно осторожно следует назначать препараты данной группы лицам старше 80 лет, пациентам, находящимся на терапии мочегонными препаратами, больным хроническими урогенитальными инфекциями.
Заключение
С учетом механизмов действия всех групп ПССП их возможных побочных эффектов, результатов отечественных и международных многоцентровых исследований по эффективности и безопасности этих препаратов, а также российских клинических рекомендаций по особенностям пероральной сахароснижающей терапии больных СД2 с ХСН можно сформулировать следующие позициях по гликемическому контролю данного контингента пациентов:
- ХСН любого ФК служит противопоказанием к применению тиазолидиндионов.
- Метформин противопоказан пациентам с ХСН III–IV ФК или ХСН, требующей госпитализации. Он может быть использован больными СД2 с ХСН I–II ФК и сохраненной функцией почек (скорость клубочковой фильтрации >45 мл/мин).
- иДПП-4 и аГПП-1 можно считать препаратами с нейтральным кардиоваскулярным действием. Лидирующую позицию в отношении сердечно-сосудистой безопасности и эффективности из всей группы агонистов ГПП-1 на данном этапе занимает лираглутид.
- Из группы иДПП-4 следует соблюдать особую осторожность в отношении саксаглиптина, прежде всего пациентам с тяжелыми стадиями сердечной недостаточности.
- иНГЛТ-2 представляют собой группу ПССП, доказавших свою безопасность и преимущества по снижению общей сердечно-сосудистой смертности и частоты госпитализаций по поводу ХСН. Указанные преимущества позволяют рассматривать данную группу препаратов как приоритетную для больных СД2 с высоким кардиоваскулярным риском.
Подводя промежуточный итог полученных данных, следует подчеркнуть, что стремительно растущая популяция больных СД2 и ХСН приобретает статус эпидемии XXI в. Профилактика, диагностика и лечение этих заболеваний требуют от системы здравоохранения серьезных экономических затрат, возводя эту проблему в статус социально значимой. Для улучшения результатов лечения, направленного на снижение риска развития ХСН у больных СД2, повышения качества жизни этих пациентов необходимо достижение традиционной первичной цели – контроля гликемии. И только максимально сбалансированная индивидуализированная тактика обеспечения гликемического контроля пациентам с СД2 в сочетании с ХСН дает основание раcсчитывать на долгосрочный успех в терапии этой непростой группы больных.



