Введение
В настоящее время отмечен прогрессивный рост распространенности ожирения, в т.ч. и морбидной его формы, среди населения, а также ассоциированного с ним сахарного диабета 2 типа (СД2) [1]. В настоящее время более чем у 50% пациентов с СД2 индекс массы тела (ИМТ) превышает 30 кг/м2 [2].
В лечении СД2 и ожирения ключевыми вопросами остаются изменение образа жизни, соблюдение принципов здорового и рационального питания в комплексе с медикаментозной терапией. Тем не менее в реальной клинической практике в большинстве случаев приходится работать с пациентами с СД2 и морбидным ожирением, которые не могут достичь компенсации углеводного обмена и снизить массу тела, несмотря на наличие широкого спектра сахароснижающих средств, а также препаратов для снижения массы тела. Одна из основных причин – это невозможность соблюдения пациентами рекомендаций по питанию, а также изменения устоявшихся стереотипов пищевого поведения.
Подход к лечению пациентов с СД2 и морбидным ожирением должен быть индивидуальным: выбирать лекарства и устанавливать индивидуальные целевые значения гликемии необходимо с учетом коморбидных состояний, возраста, пожеланий пациента, доступных ресурсов и обеспеченности медикаментами. Здесь следует отметить, что целевой уровень гликированного гемоглобина в этой группе пациентов, принимая во внимание наличие у них множественных и взаимосвязанных факторов риска, не так однозначен. Зачастую пациентам с СД2 назначаются в силу их большей доступности и распространенности сахароснижающие препараты (ССП), при длительном приеме способствующие увеличению массы тела. Это в свою очередь может привести к прогрессированию инсулинорезистентности и потребовать интенсификации лечения, назначения инсулинотерапии, что обусловливает увеличение массы тела пациента [3, 4]. Необходимо учитывать особенности влияния ССП на риски прогрессирования ожирения, чтобы была возможность прервать этот порочный круг (рис. 1). Однако в литературе отсутствуют данные об особенностях лечения пациентов с СД2 и морбидным ожирением. Кроме того, в крупных рандомизированных клинических исследований (РКИ), оценивающих эффективность различных ССП, группа пациентов с морбидным ожирением либо исключалась из работы, либо не рассматривалась отдельно.
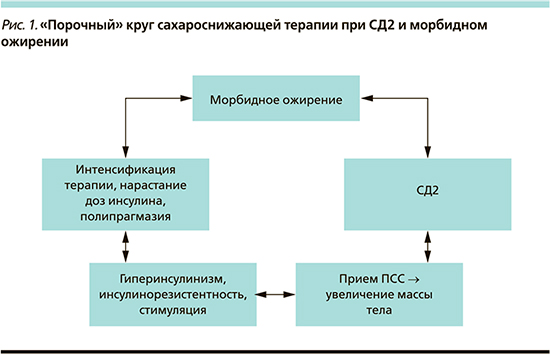
Таким образом, результаты РКИ и клинические рекомендации применимы лишь при лечении «типичного» пациента со средним ИМТ, стандартным режимом питания и физической нагрузки, что делает невозможным экстраполировать их на когорту с СД2 и морбидным ожирением. Пациент указанной группы имеет свои особенности течения заболевания, свой «портрет», налагающий отпечаток в т.ч. и на эффективность проводимой сахароснижающей терапии. Анализ «портрета» позволит разработать индивидуальный подход к терапии данной группы пациентов. Однако РКИ, в которых целенаправленно бы обсуждали этих пациентов, нет.
Эффективность различных методов лечения морбидного ожирения при СД2
К сожалению, вопросы лечения ожирения и сахароснижающую терапию применительно к обсуждаемой категории пациентов приходится рассматривать по отдельности, т.е. принципы лечения морбидного ожирения носят общий характер и не учитывают возможного влияния СД2.
Три основных варианта лечения морбидного ожирения: поведенческая терапия, фармакотерапия и хирургические вмешательства.
Поведенческая терапия
Поскольку ожирение является результатом нарушения пищевого поведения, психотерапия и подобные вмешательства считаются ключевыми элементами лечения. В случае морбидного ожирения речь уже идет о тяжелой, потенциально необратимой форме нарушения пищевого поведения, которая часто сочетается с отсутствием пищевого режима как такового. Современные программы модификации образа жизни включают три основных компонента: диетологические рекомендации, рекомендации по физическим нагрузкам и когнитивно-поведенческой терапии для устранения препятствий на пути снижения массы тела.
Снижение калорийности питания на 500–1000 ккал в сутки от расчетного приводит в лучшем случае к снижению массы тела приблизительно на 0,5–1 кг в неделю. Такая динамика сохраняется в течение 3–6 месяцев, а затем на фоне некоторой стабилизации показателя обычно наблюдается «рикошет», т.е. дальнейший необратимый набор веса [5]. Что же касается пациентов с морбидным ожирением, снижение массы тела на 2–5% для них не имеет клинического значения.
Поведенческая терапия не приводит к должному результату, т.к. для большинства пациентов, страдающих морбидным ожирением, особенно в сочетании с СД2, изменение питания на длительный период времени представляет невыполнимую задачу ввиду непреодолимых расстройств приема пищи, таких как изменение стиля питания (увеличение объема пищи, пищевая аддикция, абсолютное доминирование значимости пищи, приемы пищи без чувства голода, невозможность прервать прием пищи), нарушение субъективного образа собственного тела, многократные неудачные попытки соблюдения различных диет [6]. К физиологическим причинам низкой эффективности поведенческой терапии можно отнести нарушения центральной регуляции контроля аппетита; кроме того, необходимо учитывать и психосоматические факторы (особенности личности пациента, отношения в семье).
Психопатологические особенности и нарушения пищевого поведения, характеризующиеся сниженной насыщаемостью и зависимостью от еды, не позволяют пациентам вести качественный контроль потребляемой пищи и соблюдать принципы рационального питания. Для ряда пациентов с морбидным ожирением расширение режима физической активности невозможно в связи с патологией опорно-двигательного аппарата и/или сердечной и дыхательной недостаточностью, что также снижает эффективность данного вида лечения.
Многие лица с морбидным ожирением и СД2 полагают, что их поведение (физическая активность, приемы пищи) не играет роли в развитии ожирения, а нарастающая масса тела вызвана не зависящими от них причинами, такими как наследственность, нарушение обмена веществ, наличие диабета, инсулинотерапия, и постоянно находятся в поиске «волшебной пилюли», чтобы похудеть без особых усилий.
Таким образом, результативность поведенческой терапии больных морбидным ожирением остается низкой [7]. Специальных РКИ по лечению расстройств пищевого поведения у лиц с морбидным ожирением и СД2, которые могли бы дать больше сведений об эффективности разных способов лечения, не проводилось. Кроме того, полноценную поведенческую терапию технически сложно осуществить, поскольку она требует длительной работы целой команды специалистов, включающей и квалифицированного психотерапевта.
Медикаментозные методы лечения
На сегодняшний день консервативные методы лечения морбидного ожирения, как немедикаментозные, так и медикаментозные, в большинстве случаев неэффективны или результат их непродолжителен. Это связано в большей степени с невозможностью поддержания динамики снижения массы тела, в особенности из-за сформированных в течение длительного периода стереотипов питания, т.н. пищевых привычек. Даже если в течение первых трех месяцев наблюдаются хорошие результаты, менее чем у 10% пациентов сохраняется тенденция к стабильному снижению массы тела. Большинство же возвращается к своим паттернам питания, что зачастую приводит к еще более выраженной прибавке массы тела.
Кроме того, эти методы редко когда приводят к значимому для пациентов с морбидным ожирением снижению массы тела. В среднем оно составляет около 10 кг за 12 месяцев, что расценивается как успешный исход для пациентов с избыточной массой тела или начальной стадией ожирения, но никак не для пациентов с морбидным ожирением [8].
В настоящее время на территории Российской Федерации зарегистрированы следующие препараты для лечения ожирения: орлистат, сибутрамин, лираглутид.
Следует отметить, что специальных рандомизированных исследований по медикаментозной терапии, которые включали бы только пациентов с морбидным ожирением, крайне мало, а те, что были проведены, непродолжительны и оценивают лишь суррогатные критерии эффективности, не говоря уж о пациентах с морбидным ожирением и сахарным диабетом.
Представляет интерес открытое несравнительное исследование XXL, в котором приняли участие 15 549 пациентов, страдавших ожирением в среднем 13,7 года, 16% из них были с СД2. Длительность терапии орлистатом варьировалась от 6 до 9 месяцев. Среднее снижение массы тела составило 10,7%, при этом у 87% больных оно превысило 5%, у 50% – 10%. Снижение массы тела сопровождалось снижением гликемии натощак, уменьшением уровня общего холестерина, триглицеридов, повышением содержания холестерина ЛПВП [9].
Что касается сибутрамина, препарат нельзя назначать пациентам с неконтролируемой артериальной гипертонией, ИБС, декомпенсированной сердечной недостаточностью, нарушением ритма сердца, цереброваскулярными заболеваниями (инсультом, транзиторными нарушениями мозгового кровообращения), при тяжелых поражениях печени и почек, которые часто встречаются при морбидном ожирении и СД2. В исследовании G. Curfman et al. [10] масса тела более выраженно снижалась у пациентов с высоким ИМТ, однако при СД2 этот процесс шел медленнее, хотя даже незначительное снижение массы тела приводило к улучшению показателей углеводного обмена.
В самом крупном исследовании, посвященном консервативному лечению морбидного ожирения, LOSS (Louisiana Obese Subjects Study) (390 пациентов с ИМТ 40–60 кг/м2), группе исследования (диета – 900 ккал в сутки, групповая когнитивно-поведенческая психотерапия, рациональное питание+сибутрамин, орлистат или диэтилпропион) снизить массу тела более чем на 5% от исходной удалось 31% пациентов, более 20% — лишь 9%. Только половина пациентов завершила программу до конца и средний процент снижения массы тела составил 9,7 (около 12,7 кг). Это было статистически значимым по сравнению с контрольной группой, где динамика отсутствовала, но ничтожно мало для пациента с морбидным ожирением. Конечные точки, такие как смерть вследствие сердечно-сосудистых причин, нефатальный инфаркт миокарда и нефатальный инсульт, в данном исследовании не изучались [11].
Одним из самых перспективных препаратов лечения морбидного ожирения при СД2 является аналог глюкагоноподобного пептида-1 (ГПП-1) лируглутид. В исследовании SCALE длительностью 56 недель проводилась оценка эффективности лираглутида в снижении массы тела у больных СД2. К моменту завершения исследования выявлено значимое снижение массы тела (6,1%) на фоне терапии лираглутидом в дозе 3 мг (n=412). Доля больных, достигших уровня HbA1c ниже 7% на фоне лечения лираглутидом составила 69,2% по сравнению с 27,2% – на плацебо [12]. Причем эффективность препарата не была ассоциирована с выраженностью гастроинтестинальных эффектов и, вероятно, была обусловлена влиянием лируглутида на ЦНС. К сожалению, консервативные методы лечения морбидного ожирения в подавляющем числе случаев малоэффективны (снижение составляет около 10–15%) и даже в случае успеха стабильное снижение массы тела кратковременно и редко превышает 2 года [13]. Кроме того, довольно часто наблюдается значительный набор массы тела после окончания курса терапии.
Хирургические методы лечения
Неудовлетворительные результаты лечения морбидного ожирения консервативными методами способствовали развитию бариатрической хирургии, цель которой добиться не просто похудения пациента, но и благоприятных метаболических эффектов (нормализация гликемии, липидного обмена). За последние несколько лет число бариатрических процедур, проведенных в мире, значительно возросло, однако эти методы далеко не столь популярны в Российской Федерации. Так, из пациентов, которым была рекомендована консультация бариатрического хирурга с целью определения возможности проведения оперативного лечения морбидного ожирения, лишь 5% дошли до хирурга [14].
Современные бариатрические вмешательства можно разделить на два вида. К первому относятся операции, направленные на значительное снижение объема поступающей в организм пищи (бандажирование, баллонирование желудка и вертикальная гастропластика). Целью операций второго вида является управляемая мальабсорбция (наиболее популярными среди них можно считать билиопанкреатическое шунтирование/«выключение» двенадцатиперстной кишки).
Установка внутрижелудочного баллона и бандажирование желудка оказались неэффективными, что, как и в случае консервативного лечения, обусловлено возвращением пациента к привычному питанию [15]; более того, некоторые пациенты рассматривают проведение таких вмешательств как возможность расширения режима питания и употребления высококалорийных продуктов, что в свою очередь приводит к постепенной прибавке массы тела. Между тем подобные бариатрические вмешательства являются самыми безопасными (послеоперационная смертность не превышает 0,5%) и могут использоваться как этап подготовки к большим шунтирующим операциям. Несмотря на описанные случаи длительного и стойкого снижения массы тела после шунтирующих операций, платой за более высокую эффективность остается увеличение смертности. Шунтирующие операции ассоциированы с более высоким операционным риском, а также вероятностью необходимости проведения повторных реконструктивных операций из-за осложнений (демпинг-синдром, диарея, мальабсорбция, формирование язв и т.д.) [16]. Таким образом, бариатрическая хирургия может быть безопасным и эффективным методом для тщательно отобранных пациентов, рефрактерных к консервативному лечению.
Так, для пациентов с ИМТ более 40 кг/м2 бариатрические операции эффективнее консервативых методов. При ИМТ 35–39,9 кг/м2 преимущества бариатрической хирургии в отношении снижения массы тела не столь убедительны, в особенности при сравнении процента снижения массы тела и увеличения риска желудочно-кишечных побочных эффектов, инфицирований и даже летальных исходов [17].
В настоящее время бариатрическая хирургия при сочетании морбидного ожирения и СД2 рассматривается как способ улучшения компенсации показателей углеводного обмена, но не излечения СД2 [18]. Показательным в этом отношении является ретроспективное когортное исследование, направленное на сравнение длительности ремиссии сахарного диабета, частоты рецидивов и причины смертности среди пациентов с ожирением и СД2 (n=1395) после бариатрических вмешательств по сравнению с группой пациентов нехирургического лечения (n=62 322).
В большинстве случаев выполнялось шунтирование желудка с гастроеюноанастомозом по Ру, в 4,4% – бандажирование желудка и в 13,2 % – другие процедуры. За 2 года среди пациентов, перенесших бариатрическое вмешательство, частота компенсации СД2 была значительно выше (73,7%), чем у пациентов группы сравнения (6,9%) [19].
Несмотря на то что эффективность бариатрических вмешательств была доказана в многочисленных исследованиях, в т.ч. в рандомизированных многоцентровых и долговременных, нередко пациенты оказываются совершенно неудовлетворенными как темпами снижения массы тела, так и его достигнутым абсолютным значением. Безусловно, в таких случаях, учитывая риск послеоперационных осложнений, целесообразность выполнения операций оказывается под сомнением.
В Шведском когортном проспективном исследовании SOS с самым продолжительным периодом наблюдения (до 20 лет), в котором приняли участие 4047 пациентов с ожирением, сравнивались хирургические и консервативные подходы к лечению. В данное исследование были включены пациенты с ИМТ более 35 кг/м2 и факторами риска или наличием ассоциированных коморбидных состояний, включая СД2. Бариатрические операции (94% – рестриктивного типа) были выполнены 2010 пациентам, 2037 контрольных больных вели консервативно. По его результатам было продемонстрировано преимущество оперативного лечения перед консервативными методами, при оценке через 10 лет у пациентов группы хирургического вмешательства отмечалось стойкое снижение массы тела.
Из 156 больных СД2 в SOS многие находились в состоянии компенсации углеводного обмена, а число пациентов, нуждавшихся в сахароснижающей терапии, через 2 года снизилось вдвое. К минусам данного исследования можно отнести отсутствие рандомизации, неоднородность групп исследования (по возрасту, группа контроля не получала систематизированной консервативной терапии). Также нельзя не отметить тот факт, что в первые 90 дней после операции смертность превышала таковую в группе консервативного лечения в 2,5 раза [20].
В целом современные исследования по-прежнему противоречивы, но результаты показывают, что предоперационные когнитивные функции, личностные особенности, психическое здоровье, комплекс психологических переменных и переедание могут предсказать послеоперационную потерю массы тела, поскольку эти факторы влияют на послеоперационное пищевое поведение [21].
Неэффективность как консервативных, так и хирургических методов лечения в основном обусловлена отсутствием изменения характера питания пациента и лечения расстройств пищевого поведения.
Основные причины декомпенсации углеводного обмена у пациентов с СД2 и морбидным ожирением
Сочетание СД2 и морбидного ожирения подразумевает наличие сформировавшихся в течение длительного периода времени привычек пищевого поведения, отсутствие системы питания, неконтролируемое неограниченное количество приемов пищи, затрудняющее выделение пре- и постпрандиальных компонентов питания, а также прием ССП, способствующих нарастанию массы тела, что в итоге делает неэффективной стандартно структурированную сахароснижающую терапию (рис. 2).
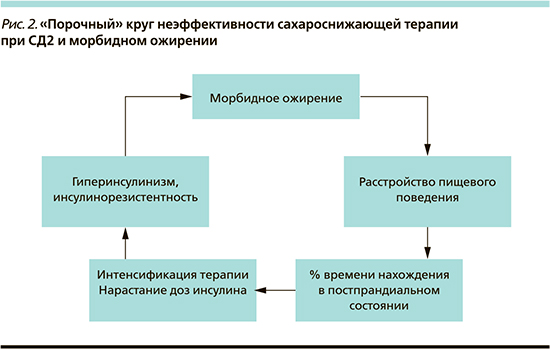
Прибавка массы тела на фоне сахароснижающей терапии может быть обусловлена снижением глюкозурии, частыми гипогликемическими состояниями, сопровождающимися чрезмерным употреблением углеводов для купирования данного состояния, а также прямым влиянием на липогенез.
Среди ССП, способствующих нарастанию массы тела, применяемых на территории РФ, можно выделить производные сульфонилмочевины (ПСМ) и инсулин.
Одной из наиболее часто используемых комбинаций ССТ для пациентов со стажем СД2 более 5 лет (у которых уже прогрессирует дисфункция β-клеток), является сочетание метформин+ПСМ+базальный инсулин, что обусловлено их высокой гипогликемической активностью, а также низкой стоимостью лечения. Таким образом, предполагается контроль гликемии натощак (базальный инсулин, метформин) и влияние на постпрандиальную гликемию (ППГ). Однако для пациентов с морбидным ожирением данная схема может оказаться нерациональной за счет сложностей выделения поспрандиального компонента из-за особенностей пищевого поведения, а также возможной дополнительной прибавки массы тела, что может стать катастрофичным для данной группы пациентов. Нарастание массы тела на фоне ПСМ и инсулина может быть обусловлено увеличением частоты гипогликемий, причем гипогликемические состояния на фоне приема ПСМ могут иметь затяжной характер, тогда как страх перед возможным снижением уровня сахара способствует учащению приемов пищи.
Что касается инсулинотерапии, то было показано, что повышение массы тела было менее выражено на фоне терапии только базальным инсулином по сравнению с применением смесей инсулина и введением только лишь прандиального инсулина [22]. Использование базис-болюсной инсулинотерапии может быть ассоциировано с большей прибавкой массы тела за счет более частых приемов пищи пациентами с морбидным ожирением, что требует введения супрафизиологичных доз инсулина, а это в свою очередь неизбежно приводит к прибавке массы тела и дальнейшему увеличению доз инсулина.
В последние годы стали доступны альтернативные ССП, либо способствующие снижению, либо не вызывающие повышения массы тела, тем не менее доля больных СД2, получающих инсулинотерапию, неуклонно растет.
Одним из вариантов интенсификации сахароснижающей терапии является комбинация инсулина длительного действия с препаратом класса агонистов рецептора глюкогоноподобного пептида-1 (АР ГПП-1). Такое сочетание позволяет эффективно контролировать как тощаковую, так и постпрандиальную гликемию без повышения риска развития гипогликемии и прибавки массы тела, что подтверждается результатами нескольких мета-анализов [23–31]. Дополнительным бонусом АР ГПП-1 является их влияние на снижение скорости опорожнения пищи из желудка, а также центральные механизмы регуляции аппетита, что приводит к вынужденному изменению привычек питания пациентов с морбидным ожирением. Однако описаны случаи, когда пациенты с СД2 и морбидным ожирением, получавщие терапию АР ГПП-1, употребляли пищу в отсутствие аппетита, более того – при наличии тошноты, что приводило к усилению гастроинтестинальных побочных эффектов вплоть до развития рвоты и, естественно, к снижению сахароснижающей активности [32].
Все сказанное выше указывает на сохранение проблемы расстройства пищевого поведения среди пациентов рассматриваемой группы и до тех пор, пока эта проблема не будет решена, не представляется возможным достичь эффективного контроля как углеводного обмена, так и массы тела.
Морбидное ожирение, СД2 и смертность
На протяжении нескольких десятков лет результаты значительного числа эпидемиологических исследований свидетельствовали о том, что сочетание морбидного ожирения и СД2 приводит к снижению качества жизни, средней продолжительности жизни, увеличению риска смертности – в основном за счет роста частоты сердечно-сосудистых заболеваний (ССЗ), а также синдрома обструктивного апноэ сна (СОАС), риска развития некоторых видов онкологических заболеваний. Кроме того, подобные утверждения никогда не подвергались сомнению, ведь высокий риск развития тяжелых заболеваний и сердечных осложнений у больных с ожирением и СД2 не раз находили подтверждение [33].
По этой причине всем пациентам с СД2 и ожирением рекомендуется похудение [34]. Такая рекомендация основывается на результатах непродолжительных исследований, которые свидетельствовали о некоторых преимуществах снижения массы тела, проявляющихся в снижении уровня глюкозы в крови, уменьшении выраженности факторов риска развития осложнений ССЗ, улучшении качества жизни, а также в уменьшении проявлений ряда других заболеваний, ассоциированных с ожирением. Однако до сих пор точно не установлено: приводит ли снижение массы тела к снижению риска развития осложнений ССЗ и смертности пациентов с СД2 и ожирением? Проспективные исследования, посвященные оценке влияния ожирения на показатели смертности, продемонстрировали неоднозначные результаты. Так, было показано, что на заболеваемость и смертность в большей степени влияют возраст, пол, этническое происхождение и социальный статус, нежели масса тела пациента [35, 36].
В ходе недавно проведенного многоцентрового открытого рандомизированного исследования Action for Health in Diabetes (Look AHEAD) проводилась оценка влияния интенсивного вмешательства по изменению образа жизни на риск развития осложнений ССЗ у больных СД2. В исследование были включены 5145 больных, из них 2570 и 2575 в группу вмешательства и группу контроля соответственно. Средний ИМТ составил 36 кг/м2. Несмотря на достижение различий по массе тела между группами через год наблюдения, которое достигло 7,9%, а также уменьшение в группе вмешательства по сравнению с группой контроля показателей окружности талии, систолического АД и уровня гликированного гемоглобина, вмешательство не влияло на риск развития осложнений ССЗ; причем такой нейтральный эффект отмечался во всех анализируемых подгруппах больных с определенными характеристиками [37]. Действительно, исследование было прекращено досрочно, когда медиана продолжительности наблюдения составляла 9,6 года после получения результатов промежуточного анализа, которые свидетельствовали об очень небольшой вероятности получения статистически значимых различий между группами в случае продолжения исследования. Хотя некоторые авторы утверждают, что для клинической реализации этого снижения необходим период, превышающей 10 лет [38]. Если предположение верно, то исследование Look AHEAD было явно слишком непродолжительным для выявления такого эффекта.
Наибольшей доказательной базой отличается упомянутое выше Шведское исследование SOS (Swedish Obese Subjects), начатое в 1987 г. [39].
В выгодную сторону его характеризует большое число участников (4047 человек), длительный период наблюдения, наличие соответствующей группы контроля и высокий процент удержания участников (99% в течение первых 10 лет). По его результатам ввиду значительного преобладания рестриктивных операций среднее снижение массы тела было относительно скромным (около 20%), тем не менее было показано снижение относительного риска смерти на 29%, нефатального инфаркта и инсульта на 44% и сердечно-сосудистой смертности на 17% (по состоянию на 2012 г.). Следует, однако, отметить, что это исследование не было рандомизированным, а результаты, полученные за счет хирургической операции, не могут быть экстраполированы на другие вмешательства, направленные на снижение массы тела.
Проведенное там же когортное популяционное исследование с использованием существующего в Швеции тотального популяционного регистра сравнивало исходы более 13 тыс. бариатрических операций, выполненных с 1980 по 2006 г., с таковыми в общей популяции [40]. Результаты были неоднозначными: общая летальность после бариатрических вмешательств осталась высокой, добиться снижения риска развития инфаркта миокарда и СД бариатрические операции выполнялись пациентам как с СД, так и без него удалось лишь подгруппе пациентов, подвергнутых шунтирующим операциям. Следует, однако, иметь в виду, что речь идет о сравнении прооперированных не с отказавшимися от оперативного лечения больными морбидным ожирением, а с общей популяцией, т.е. мы имеем дело с доказательством возможности эффективной первичной профилактики ИБС и СД2 в довольно специфической группе пациентов.
Что же касается сочетания СД2 и морбидного ожирения, интерес представляют результаты исследования STENO-2, в котором был использован агрессивный многофакторный подход к лечению СД2 (поведенческая терапия+интенсифицированная медикаментозная терапия). Первичными конечными точками после 8 лет исследования считались ССЗ и смертность, вторичными – микрососудистые осложнения. Главный итог STENO-2: интенсивное многофакторное управление СД2 замедляет прогрессирование смертельных и сердечно-сосудистых нарушений. Так, среди пациентов, получающих традиционную терапию, было зафиксировано 85 сердечно-сосудистых событий у 35 человек (44% от группы), у пациентов на интенсифицированной схеме – 33 события у 19 человек (24%) [27]. Однако до сих пор остается дискутабельным вопрос: насколько быстро и агрессивно мы должны действовать, сталкиваясь с декомпенсированным пациентом в клинической практике, особенно при наличии у него морбидного ожирения.
Также хотелось бы остановиться на результатах крупного рандомизированного двойного слепого плацебо-контролируемого исследования SCOUT, в котором приняли участие 10 744 пациента с избыточной массой тела, ожирением и наличием серьезных ССЗ в анамнезе [28].
Целью исследования стала оценка влияния изменения массы тела на фоне длительного лечения сибутрамином на риски развития ССЗ и смертность. Согласно предварительным результатам, опубликованным в 2010 г., применение сибутрамина по сравнению с плацебо ассоциировано с незначительным повышением риска развития серьезных нефатальных сердечно-сосудистых событий, таких как инфаркт миокарда и инсульт. FDA потребовало не назначать сибутрамин пациентам, которые исходно имеют какие-либо ССЗ. Окончательные результаты SCOUT продемонстрировали, что длительный прием сибутрамина несколько повышал вероятность развития нефатального инфаркта и инсульта [29]. Интересно, что была отдельно выделена группа пациентов с СД2 без сопутствовавших ССЗ, в которой таких рисков по сравнению с плацебо не отмечалось.
Вопрос заключается в том, что именно повышает смертность: скорость снижения массы тела или же все колебания данного показателя (быстрое снижение и быстрый набор).
Таким образом, до последнего времени остается нерешенным принципиальный вопрос: приведет ли хирургическое лечение ожирения, кардинальное изменение образа жизни или применение медикаментов, разработанных для снижения веса, к снижению частоты развития осложнений ССЗ и смертности больных СД2 с ожирением в долгосрочной перспективе, и насколько агрессивны мы должны быть в этой «гонке» за снижением массы тела?
Заключение
Число пациентов с сочетанием СД2 и морбидного ожирения неуклонно растет. Этиология морбидного ожирения и СД2 носит комплексный характер и включает сочетание психосоциальных, генетических, эндокринных и метаболических факторов, что обусловливает низкую эффективность как хирургических, так и медикаментозных и немедикаментозных методов лечения. Все это способствует появлению новых групп препаратов, сочетающих различные свойства и механизмы действия, с помощью которых появилась бы возможность благоприятно влиять как на уровень гликемии, так и на массу тела и сердечно-сосудистые риски у рассматриваемой когорты пациентов.
Принимая во внимание процент неудачи практически всех современных методов снижения массы тела, а также отсутствие работ по оценки эффективности сахароснижающей терапии при сочетании морбидного ожирения и СД2, требуются рандомизированные исследования с целью оценки эффективности существующих и выработки новых оптимальных методов лечения.
Вклад авторов
М.В. Амосова, О.Ю. Гурова – сбор, анализ литературы, написание текста статьи.
В.В. Фадеев – редактирование текста статьи.
Все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.



