Введение
Кортикотропин-независимый синдром Кушинга (СК) развивается вследствие длительного воздействия избытка глюкортикостероидных гормонов (ГКС) и составляет 10−20% всех случаев эндогенного гиперкортицизма [1]. Диагностика первичного гиперкортицизма классическими методами представляет собой многоэтапный процесс и не позволяет быстро определить форму заболевания ввиду отсутствия специфических биохимических маркеров. С помощью хроматографических методов диагностики была установлена связь между особенностями стероидогенеза и функциональной активностью образований коры надпочечников (ОКН) [2]. В проведенных ранее работах с применением методов хроматографии были определены дифференциально-диагностические признаки, характерные для СК: снижение экскреции с мочой метаболитов андростендиона и дегидроэпиандростерона (DHEA), снижение активности 11β-гидроксистероиддегидрогена-зы (11β-ГСДГ) 2-го типа и увеличение активности 5β-редуктазы [3, 4]. СК может быть обусловлен гиперплазией, аденомой и в редких случаях карциномой коры надпочечников [5]. Двусторонние поражения надпочечников, протекающие с СК, являются следствием таких заболеваний, как кортикотропин-независимая билатеральная макронодулярная гиперплазия коры надпочечников (БМГН), двустороннее первично-пигментированное заболевание коры надпочечников, изолированное микронодулярное заболевание коры надпочечников, солитарная функционирующая аде-нома в сочетании с нефункционирующей контралатеральной аденомой коры надпочечников [6–8]. Описаны единичные случаи двусторонних кортизол-продуцирующих аденом [9]. Анализ 16 стероидов плазмы крови больных БМГН методом жидкостной хромато-масс-спектрометрии выявил повышение уровней 11-дезоксикортизола, кортикостерона, 11-дезоксикортикостерона, 18-гидроксикортизола, альдостерона по сравнению с группой контроля (ГК), в то время как прогестерон, DHEA, DHEA-сульфат были снижены [10]. У больных СК с БМГН авторы получили увеличение уровней ГКС, альдостерона и 18-OHB в сыворотке крови по сравнению с пациентами с СК с САН [10].
Цель исследования: в представленной работе проведен сравнительный анализ клинической картины и лабораторных показателей, полученных методами хроматографии от пациентов с СК с одиночными и двусторонними ОКН.
Методы
Обследованы 36 пациентов, сопоставимых по возрасту и индексу массы тела (ИМТ), с кортикотропин-независимой формой СК. Больные были распределены в три группы на основании данных обследования надпочечников с помощью мультиспиральной компьютерной томографии и результатов гистологического анализа послеоперационного материала [11]. В ходе морфологического анализа тканей ОКН оценивали размер и полиморфизм клеток и ядер, наличие митозов, некрозов, инвазию в капсулу и сосуды. Злокачественный потенциал (ЗП) определялся на основании критериев световой микроскопии по шкале L.M. Weiss [12]. Диагноз аденомы КН устанавливали при наборе менее 3 баллов по шкале L.M. Weiss.
Восемь больных составили группу СК с БМГН, девять вошли в группу СК с ДАН. Группа сравнения представлена 19 больными СК с САН без ЗП по шкале L.M. Weiss. В ГК вошли 22 здоровых донора. ИМТ пациентов с СК с САН составил 27,7 (24,2–29,1) кг/м2, ИМТ больных СК с ДАН был 28,9 (25,6–31,8) кг/м2, ИМТ пациентов с СК с БМГН – 30,7 (28,4–32,4) кг/м2.
Средний возраст составил 53 (35–65) года. Диагноз СК устанавливался согласно клиническим рекомендациям Российской ассоциации эндокринологов по диагностике эндогенного гиперкортицизма [13]. Для определения уровней адренокортикотропного гормона (АКТГ) в плазме крови, кортизола в 9,00 (Ку), в 20,00 (Кв) и после подавляющего дексаметазонового теста с 1 и 2 мг, дегидроэпиандростерон-сульфата (ДГЭА-С) в сыворотке крови, свободного кортизола слюны (СКС) в 23 часа, свободного кортизола в моче (СКМ) был использован метод иммунохемилюминисцентного анализа. Иммуноферментный анализ применяли для оценки уровней 17-ОН прогестерона (17-ОНП), альдостерона и ренина в сыворотке крови. Методом ВЭЖХ исследовали экскрецию с мочой свободного кортизола (UFF), свободного кортизона (UFE), 6β-гидроксикортизола (6β-OHF), 18-гидроксикортикостерона (U18-OHB). Методом ГХ-МС определяли стероидный профиль мочи (СПМ) с использованием жидкостной экстракции [3]. Результаты СПМ получены на газовом хромато-масс-спектрометре SHIMADZU GCMS-QP2020. Статистическая обработка полученных результатов осуществлена с применением пакета программ для статистического анализа Statistic for Windows (версия 10). Основные количественные показатели представлены в виде медианы (Ме), 25-го и 75-го перцентилей (Q25–Q75). Выводы основывались на статистических различиях. Критерием статистической достоверности считалась общепринятая в медицине величина p<0,05.
Результаты исследования
У больных СК с САН период времени от появления симптомов заболевания до момента обращения и установки диагноза составил 1,14±0,7 года, в то время как у больных СК с БМГН − 4,5±0,5 года, СК с ДАН − 3,9±1,2, что указывает на более быстрое развитие клинической картины и бόльшую выраженность проявлений болезни у пациентов с односторонними аденомами. Пациенты с СК с САН чаще предъявляли жалобы на набор массы тела и ускоренный темп набора массы тела. В группе больных СК с БМГН медленное увеличение массы тела отметили 75% пациентов. У всех обследованных пациентов была отмечена артериальная гипертензия (АГ). Частота развития кризового течения АГ имела место у половины всех обследованных пациентов. Дислипидемия, нарушение углеводного обмена выявлялись во всех группах пациентов. У больных СК с САН при осмотре были представлены все основные симптомы, характерные для синдрома гиперкортицизма: центрипетальное ожирение, багровые атрофические стрии, склонность к образованию внутрикожных гематом. У больных СК с ДАН и БМГН не было стрий, реже встречалось центрипетальное ожирение. Жалобы на мышечную слабость предъявляли все обследованные лица.
У пациентов с СК всех групп получено снижение уровня АКТГ в плазме крови, увеличение уровней Кв и после подавляющего дексаметазонового теста с 1 и 2 мг в сыворотке крови, СКС и CКМ по сравнению с ГК (табл. 1).
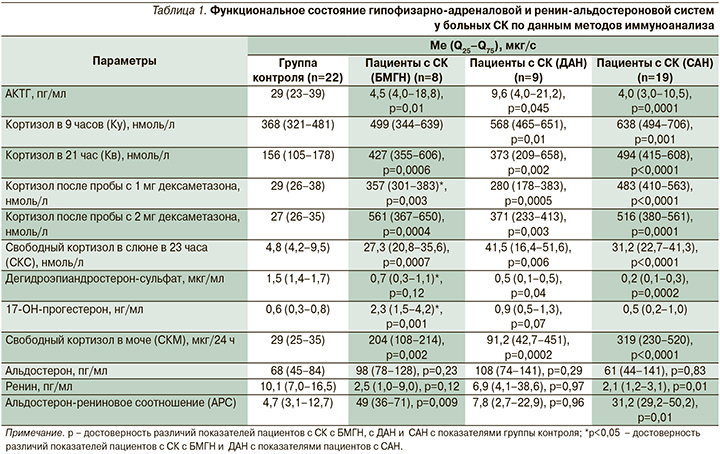
У пациентов с САН и ДАН уровень Ку был увеличен, а ДЭА-С в сыворотке крови снижен по сравнению с ГК (табл. 2). У больных с БМГН получено повышение уровня 17-ОНП в сыворотке крови по сравнению с ГК и САН, а уровень ДЭА-С (р=0,015) был выше по сравнению с САН и не отличался от ГК (табл. 1). У пациентов с СК с ДАН и САН показатели, полученные методами иммуноанализа, не различались (р>0,1). Уровень альдостерона в сыворотке крови пациентов с СК во всех группах не отличался от ГК (табл. 1). Уровень ренина был снижен у больных САН, АРС повышено у пациентов с БМГН (более 35) и с САН (более 25).
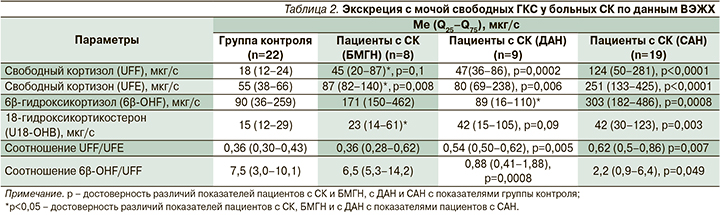
Высокоэффективная жидкостная хроматография
У всех пациентов с СК получено увеличение ЭМ UFE, а у больных СК с САН и ДАН была также повышена ЭМ UFF по сравнению с ГК.
У пациентов с СК с САН дополнительно обнаружено увеличение ЭМ 6β-ОНF и U18-ОНВ (табл. 2). ЭМ UFF и UFE у пациентов с СК с БМГН была ниже, чем у больных СК с САН. Полученные данные свидетельствуют о повышении глюкокортикоидной функции КН в большей степени у больных СК с САН. У пациентов с СК с САН и ДАН повышено соотношение UFF/UFE и снижено соотношение 6β-ОНF/ UFF, что указывает на уменьшение активности фермента 11β-ГСДГ 2-го типа, участвующего в превращении кортизола в кортизон, и изофермента CYP 3A4 в данных группах больных СК (табл. 2).
Газовая хромато-масс-спектрометрия
Метаболомика андрогенов. У больных СК с САН и ДАН по сравнению с ГК была снижена ЭМ андрогенов: андростерона (Аn), этиохоланолона (Et), DHEA и его метаболитов (16-ОН-DHEA-1, 16-ОН-DHEA-2), андростентриола (dA3). У пациентов с БМГН была уменьшена ЭМ только 16-ОН-DHEA-1 по сравнению с ГК, а ЭМ других андрогенов была повышена по сравнению с показателями больных СК с САН (табл. 3).
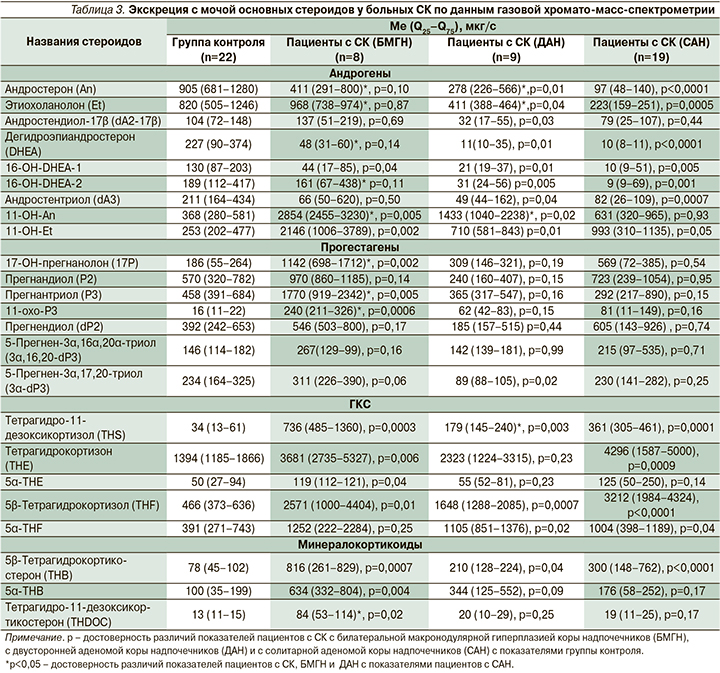
У пациентов c СК с БМГН и ДАН получено увеличение ЭМ метаболитов андростендиона (11-OH-An, 11-OH-Et) по сравнению с ГК (табл. 3). Таким образом, наиболее низкие значения андрогенов получены у больных СК с САН по сравнению с БМГН.
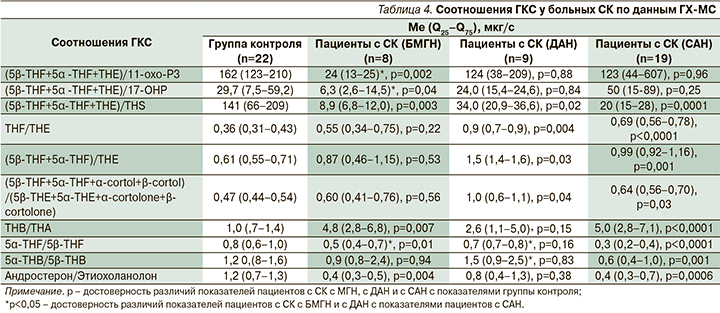
Метаболомика глюкокортикоидов и минералокортикоидов. У всех пациентов с СК по сравнению с ГК выявлено повышение различных 5α- и 5β тетрагидрометаболитов кортизола (ТНF), кортизона (ТНЕ), кортикостерона (ТНВ): у больных БМГН увеличена ЭМ 5α- и 5β- ТНЕ, 5α- и 5β-ТНВ, и 5β-ТНF; у больных ДАН получено повышение ЭМ 5α- и 5β-ТНF, 5β-ТНВ; у пациентов с САН – увеличение ЭМ 5β- ТНF, ТНЕ, ТНВ. ЭМ тетрагидро-11-дезоксикортизола (ТНS) была увеличена у пациентов с СК во всех группах. Однако у больных СК с ДАН ЭМ ТНS была меньше, чем у пациентов с САН (табл. 3). У пациентов с СК с БМГН соотношение (5β-THF+5α -THF+ТНЕ)/ТНS было меньше 12, что в сочетании с увеличением ЭМ ТНS (>485 мкг/с) и определением гексагидро-11-дезоксикортизола (ННS) 189 (108–200) мкг/с могут указывать на недостаточность фермента 11β-гидроксилазы. У пациентов с САН получены 4 признака снижения активности 11β-ГСДГ 2-го типа: повышение соотношений THF)/THE, (5β-THF+5α-THF)/THE, (5β-THF+5α-THF+α-cortol+β-сortol)/(5β-THE+5α-THE+α-cortolone+β-cortolone) и ТНВ/ТНА по сравнению с ГК (табл. 4). У больных СК с ДАН получены 3 признака, а у пациентов с СК и БМГН – 1 признак уменьшения активности 11β-ГСДГ 2-го типа (увеличение соотношения ТНВ/ТНА). Полученные данные указывают на снижение активности 11β-ГСДГ 2-го типа в большей степени у пациентов с СК с САН и ДАН, свидетельствующее о замедлении превращения наиболее активного глюкокортикоидного гормона кортизола в малоактивный кортизон, что способствует поддержанию высокой глюкокортикоидной активности. ЭМ тетрагидро-11-дезоксикортикостерона (ТНDOC), 2-го по биологической активности минералокортикоида после альдостерона, была увеличена только у пациентов с БМГН по сравнению с ГК и САН (табл. 3).
Метаболомика прогестагенов. У пациентов с СК с БМГН было получено увеличение ЭМ 17-ОН-прегнанолона (17-ОНР) более 1000 мкг/с, прегнантриола (Р3) более 900 мкг/с и 11-охо-Р3 более 200 мкг/24 ч, снижение соотношений (5β-THF+5α -THF+ТНЕ)/11-охо-Р3 (<25) и (5β-THF+5α -THF+ТНЕ)/17-ОНР (<15,0) по сравнению с ГК и САН. ЭМ метаболита 21-дезоксикортизола, тетрагидро-21-дезоксикортизола, биомаркера недостаточности 21-гидроксилазы, не определяемого у здоровых лиц, cоставила 170 (118–242) мкг/с. Полученные результаты являются признаками недостаточности фермента 21-гидроксилазы (21-ОН) у пациентов с СК с БМГН (табл. 3 и 4). У пациентов с СК с САН получены 3 признака увели-чения активности 5β –редуктазы: снижение соотношений Аn/Et, 5α-THF/5β-THF и 5α-THB/5β-THB в сравнении с ГК. У больных БМГН определены только 2 признака, а у пациентов с ДАН признаки повышения активности данного фермента не получены (табл.4). У пациентов с СК с ДАН соотношения 5α-THF/5β-THF, 5α-THB/5β-THB были увеличены в сравнении с показателями больных САН (табл. 4).
Обсуждение
Диагностика СК классическими методами иммунохимического анализа представляет собой сложный многоэтапный процесс. Анализ полного стероидного профиля с применением хроматографических методов диагностики позволяет выявить нарушения стероидогенеза, специфичные для определенного типа ОКН [2, 3, 14, 15].
При исследовании классическими методами у больных СК с БМГН, с ДАН и с САН нами отмечены общие признаки, характерные для СК: снижение уровня АКТГ, нарушение ритма секреции кортизола, повышенная экскреция СКМ и СКС, отсутствие подавления секреции кортизола в ходе ночного теста с ДМТ. По результатам проведенных ранее исследований другими авторами у больных СК с БМГН и СК с САН статистически значимой разницы по данным показателям не было выявлено [16]. В нашем исследовании, у больных СК с БМГН уровни 17-ОНП и ДЭА-С в сыворотке крови были выше показателей ГК и больных СК с САН.
При анализе стероидного профиля больных СК с БМГН методом жидкостной хроматографии с масс-спектрометрией ряд исследователей установили повышение уровней 11-дезоксикортизола, кортикостерона, 18-гидроксикортизола, альдостерона в сыворотке крови [10]. Уровни прогестерона и DHEA в сыворотке крови были снижены по сравнению с показателями ГК. Стероидный профиль больных СК c БМГН по уровню ГКС отличался от показателей больных СК с односторонней аденомой [10]. В нашем исследовании методом ГХ-МС также были получены различные СПМ у больных СК с БМГН, СК с ДАН и СК с САН. У пациентов с СК с БМНГН была повышена экскреция андрогенов с мочой и снижена глюкокортикоидная активность по сравнению с СК с САН, получены признаки недостаточности 21-ОН и 11β-гидроксилазы. У больных СК с САН наличие 4 признаков снижения активно-сти 11β-ГСДГ 2-го типа свидетельствует в пользу более высокой глюкокортикоидной активности. У больных этой группы были более выражены характерные признаки СК. Только у пациентов с СК с БМГН получено повышение ЭМ THDOC, 5α- и 5β-ТНВ методом ГХ-МС, что в сочетании с повышением АРП более 35 указывает на увеличение минералокортикоидной функции КН у больных БМГН. Транзиторное повышение концентрации альдостерона с последующей нормализацией значений при БМГН описано в литературе, и, вероятно, обусловлено наличием мутаций ARMC5 [17, 18].
У пациентов с СК с БМГН установлено увеличение экскреции с мочой THS более 485 мкг/сек, что предполагает наличие злокачественного потенциала у ряда больных и имеет значение при выборе тактики хирургического вмешательства, требует более динамичного и длительного контроля при данном типе заболевания.
Заключение
Методами хроматографии получены различные СПМ у больных СК с БМГН, ДАН и с САН. У больных СК с САН определена наиболее высокая глюкокортикоидная активность по данным хроматографических методов обследования, что сопровождалось выраженными клиническими проявлениями заболеваниями. Снижение активности 11β-ГСДГ 2-го типа в большей степени у пациентов с СК и САН способствует поддержанию более высокой глюкокортикоидной активности данных больных. У пациентов с СК и БМГН выявлены увеличение минералокортикоидной функции КН, наиболее высокая экскреция андрогенов с мочой по сравнению с САН, признаки недостаточности 21-ОН. Увеличение экскреции с мочой THS (более 485 мкг/с) и снижение соотношения 5β-THF+5α -THF+ТНЕ)/ТНS<12 указывает на недостаточность 11β-гидроксилазы и возможность наличия злокачественного потенциала у ряда пациентов с СК и БМГН, что подтверждено результатами гистологического исследования послеоперационного материала 3 больных (2 балла по шкале Weiss). У пациентов с СК и САН получены 3 признака увеличения активности 5β-редуктазы, у больных СК и БМГН – 2 признака, у пациентов с СК и ДАН не были получены признаки повышения активности данного фермента, что свидетельствует о наличии существенных различий в метаболомике андростендиона, тетрагидрометаболитов кортизола и кортикостерона у больных СК с односторонними и двусторонними ОКН, может быть использовано для дифференциальной диагностики.



