Главной задачей лечения бесплодия методами вспомогательных репродуктивных технологий (ВРТ) является помощь в наступлении беременности и рождении здорового ребенка. Повышение частоты имплантации и продолжающейся беременности достигается несколькими путями, основной из которых - отбор эмбриона для переноса в полость матки с высоким потенциалом к имплантации и дальнейшему развитию. Оценка эмбрионов в настоящее время чаще всего проводится на основании морфологических критериев, а также результатов преимплантационного генетического тестирования на анеуплоидии (ПГТ-А). По данным современных исследований, проведение ПГТ-А увеличивает частоту имплантации на перенос, снижает риск потери беременности в I триместре и сокращает время до наступления беременности [1, 2]. При этом проведение ПГТ-А имеет и свои недостатки, главным из которых является инвазивность процедуры. Необходимо выполнение биопсии клеток эмбриона, что может вызывать снижение его имплантационных возможностей.
В настоящее время чрезвычайно актуален поиск методов неинвазивной диагностики преимплантационных эмбрионов человека в программах лечения бесплодия методами ВРТ. В качестве источника ДНК эмбриона исследователи все чаще рассматривают отработанную культуральную среду (собранную после культивирования эмбриона). Показано, что использованная культуральная среда содержит внеклеточную ДНК эмбриона и митохондриальную ДНК (мтДНК), анализ которых имеет высокий потенциал для оценки и отбора эмбрионов, наиболее перспективных для переноса в полость матки.
В ряде научных работ уже прослежено возможное эффективное проведение неинвазивного ПГТ-А с оценкой свободной ДНК эмбриона, детектированной в использованной культуральной среде [3—5]. Оценка мтДНК, выделенной из питательной среды после культивирования, в комбинации с морфологическими методами оценки качества эмбрионов также перспективна для выбора эмбрионов с большим потенциалом к дальнейшему развитию [6—12]. Результаты исследований предполагают возможность проведения неинвазивной оценки содержания эмбриональной мтДНК в культуральной среде. В сочетании с морфологией эмбриона они могут помочь клиническим эмбриологам ранжировать эмбрионы с целью селективного переноса эмбриона, имеющего больший потенциал развития.
Цель исследования: изучить возможность использования количественной оценки копийности гена MT-ND1 в отработанной культуральной среде как маркера успешной имплантации и качества эмбрионов.
Материалы и методы
Исследование проведено на базе отделения вспомогательных технологий в лечении бесплодия им проф. Б.В. Леонова ФГБУ «НМИЦ акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России. Проанализировано 173 образца культуральной среды: 142 образца, содержащих эмбрионы, 31 образец в качестве отрицательного контроля без эмбриона. В исследование включены 53 супружеские пары. У всех пациентов овариальная стимуляция проходила в рамках стандартных протоколов. Через 36 ч после введения триггера производился забор ооцитов с помощью трансвагинальной пункции фолликулов. Оплодотворение ооцитов проводилось методом ИКСИ, после чего оплодотворенные клетки переносили в культуральную среду CSCM (Irvine Sc., США). Все этапы культивирования выполняли в мультигазовых инкубаторах СООК (Ирландия) в каплях по 25 мкл под маслом (Irvine Sc., США). Среду CSCM (Irvine Sc., США) не меняли в течение 5—6 суток культивирования. На 5-е или 6-е сутки после оплодотворения проводилась морфологическая оценка бластоцист согласно классификации D. Gardner et al. (1999) и методическим рекомендациям РАРЧ по оценке ооцитов и эмбрионов в лаборатории ВРТ (2021) (табл. 1).
Всего оценили 142 эмбриона: 102 бластоцисты и 40 эмбрионов, остановившихся на стадии дробления или дегенеративных. В зависимости от морфологической оценки, все бластоцисты разделили на 2 группы: 1-я группа (отличные и хорошие) — 60 эмбрионов, 2-я группа (средние и плохие) — 42 эмбриона. На основании морфологической оценки отобраны эмбрионы, наиболее перспективные для переноса в полость матки. Выполнено 24 селективных переноса эмбрионов 5—6 суток в полость матки в нативном цикле. Перенос эмбрионов в полость матки осуществлялся с помощью мягкого катетера Wallace (Германия) или Cook (Австралия). Перенос эмбрионов был произведен у 24 пациенток. В зависимости от исхода переноса пациенты разделены на группы: 1-я группа (отрицательный результат) — 17 случаев, 2-я группа (клиническая беременность) — 7 случаев.
Кроме того, все бластоцисты разделили на группы в зависимости от возраста пациенток: 1-я группа (до 35 лет) - 63 эмбриона, 2-я группа (после 35 лет) - 39 эмбрионов.
Отрицательным контролем служили капли куль-туральной среды (31 образец), находящиеся в тех же условиях культивирования, но не содержащие эмбрионы. После завершения культивирования эмбрионов все образцы культуральной среды (содержащие и не содержащие эмбрионы) собирались и криоконсервировались.
Определение абсолютного числа копий гена Mitochondrially Encoded NADH:Ubiquinone Oxidoreductase Core Subunit 1 (MT-ND1) мтДНК осуществляли с помощью метода полимеразной цепной реакции в реальном времени (ПЦР-РВ). Ген MT-ND1 кодирует белок NADH-убихинон- оксидоредуктазную цепь 1, который является субъ-единицей NADH-дегидрогеназы, расположенной во внутренней мембране митохондрий, и крупнейшим из пяти комплексов цепи переноса электронов. Для этого в стерильных условиях собирали среду культивирования. Весь объем (10 мкл) полученной среды использовали для проведения ПЦР (общий объем смеси - 50 мкл). Для подсчета копий мтДНК проводили ПЦР-РВ с использованием праймеров зонда к митохондриальному гену субъединицы 1 NAD H-дегидрогеназы (NADHdehydrogenase, subunit 1) (прямой праймер: CCACATCTACCATCACCCTC; обратный праймер: TAGAATAAATAGGAGGCCTAGGTT; зонд: R6G ATC ACC GCC CCG ACC TTA GCT CTC A BHQ1). Для получения результата ПЦР в виде абсолютного числа копий гена субъединицы 1 NADH дегидрогеназы во время каждого запуска использовали кали-бровочные растворы плазмид (30 копий/10 мкл, 125 копий/10 мкл, 250 копий/10 мкл) с закло- нированным соответствующим ампликоном.
Реакцию проводили в амплификаторе Real-Time PCR Detection System CFX96 (BioRad, США) с набором для ПЦР (М-428, Синтол, Россия) по следующей программе: 95°С - 5 мин, (95°С - 10 с, 60°С - 20 с) 50 циклов. Детекцию флюоресценции осуществляли в канале, соответствующем флюорохрому зонда (R6G). Полученные данные флюоресценции были пересчитаны в абсолютное количество копий с помощью программного обеспечения амплификатора CFX96 BioRad.
Статистический анализ
Статистический анализ проводился в программе Jamovi. Оценена связь между морфологическим качеством эмбрионов, возрастом пациенток, исходами переносов и профилем мтДНК в культуральной среде. Для описания категориальных бинарных данных использовали абсолютные значения и процентные доли от общего числа в группе. Непрерывные переменные были представлены в виде медианы (Ме) и межквартильных значений (Q1; Q3). Качество бластоцисты, возраст до и после 35 лет и исход переноса эмбрионов соответствовали категориальным переменным, копийность мтДНК - непрерывным. С целью определения статистической значимости различий мтДНК в исследуемых группах был выбран непараметрический критерий Манна- Уитни. Анализ качественных признаков проводили с помощью Хи-квадрата (х2) Пирсона. Величину порогового уровня значимости p принимали равной 0,05.
Результаты
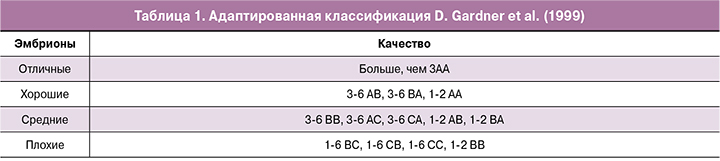
В исследование включено 173 образца куль-туральной среды: 142 образца, содержащих эмбрион, от 53 супружеских пар и 31 образец - в качестве контроля. Распределение копий мтДНК в среде, содержащей эмбрионы, находилось в диапазоне от 0 до 8623 копий. Медиана распределения составила 156 копий (58,6;349). В контрольной культуральной среде - от 0 до 2831 копий, медиана - 7,1 копий (1;14,6), что было статистически значимо меньше, чем в исследуемых (содержащих эмбрионы) образцах, (p<0,001) (рис. 1).
На 5-6-е сутки культивирования получено 142 эмбриона: 102 бластоцисты различного качества, 40 эмбрионов оценены как дробящиеся или подвергнутые атрезии. Распределение копий мтДНК в среде эмбрионов, достигших стадии бластоцисты, находи-лось в диапазоне от 0 до 8623 копий. Медиана рас-пределения составила 160 копий (59,4;309). В среде эмбрионов, дробящихся или подвергшихся атрезии, - от 3,8 до 6677 копий, Ме - 138 копий (54,8;486), что не имело статистически значимой разницы (p=0,919).
В зависимости от морфологической оценки все бластоцисты разделили на 2 группы: 1-я группа (отличные и хорошие) - 60 эмбрионов, 2-я группа (средние и плохие) - 42 эмбриона. В 1-й группе (отличные и хорошие бластоцисты) медиана рас-пределения копий мтДНК составила 120 копий (35,5;311), во 2-й группе (средние и плохие) медиана мтДНК составила 198 копий (93,5;304), что не достигло статистически значимых различий (p=0,082).
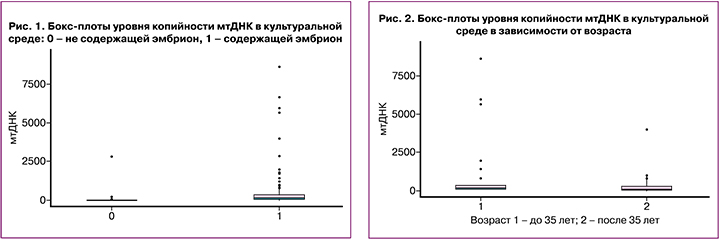
Все бластоцисты разделили на группы в зависимости от возраста пациенток: 1-я группа (до 35 лет) - 63 эмбриона, 2-я группа (после 35 лет) - 39 эмбрионов. В 1-й группе (до 35 лет) медиана мтДНК составила 196 копий (103;366), во 2-й группе (после 35 лет) медиана мтДНК составила 58,5 копий (24,5;294). Количество копий мтДНК статистически было значимо выше в группе пациенток в возрасте до 35 лет (p=0,001) (рис. 2).
В зависимости от исхода переноса эмбрионов пациентки разделены на группы: 1-я группа (отри-цательный результат) - 17 пациенток, 2-я группа (клиническая беременность) - 7 пациенток. В 1-й группе (отрицательный результат) - медиана мтДНК составила 106 копий (39,6;168), во 2-й группе (клиническая беременность) - медиана мтДНК составила 299 копий (83,6;680), что не имело стати-стически значимой разницы (p=0,234).
С целью оценки качественных различий (морфология эмбриона) в группах сравнения (возраст до и после 35 лет) использовали Хи-квадрат (х2) Пирсона и таблицу сопряженности (табл. 2). Статистически значимой разницы между группами не было (p=0,093).
Дополнительно отдельно сравнивали уровень копийности мтДНК в зависимости от качества (1-ю и 2-ю группу) среди пациенток до и после 35 лет, p-уровень составил 0,195 и 0,425 соответственно, что не имело статистически значимой разницы (табл. 3).
Кроме того, дополнительно отдельно оценивали уровень копийности мтДНК в зависимости от возраста (группы до и после 35 лет) среди бластоцист 1-й и 2-й групп. Количество копий мтДНК было статистически значимо выше в группе пациенток в возрасте до 35 лет: для бластоцист 1-й и 2-й группы p-уровень составил 0,034 и 0,042 соответственно (табл. 3).
Обсуждение
Для ВРТ одним из главных вопросов был и остается выбор эмбриона для переноса. В настоящее время морфологическая оценка остается первичным методом селекции эмбрионов. Однако эмбрионы высокого качества с точки зрения морфологии также могут иметь анеуплоидный набор хромосом и/или низкий потенциал к имплантации и рождению здорового ребенка.
В связи с этим в области репродуктивной медицины значительное внимание уделяется разработке новых неинвазивных методов оценки эмбриона на преимплантационном этапе. Интенсивно развиваются несколько направлений: методы микроскопии в сочетании с искусственным интеллектом, про- теомный и метаболомный анализ культуральной среды, а также анализ внеклеточной ДНК (в отра-ботанной культуральной среде и полости бластоци-сты) [13-17].
Известно, что митохондрии играют важнейшую роль в клеточном метаболизме и функционировании, снабжая клетки необходимой энергией. Отечественными и зарубежными авторами проведено значительное количество работ, посвященных изучению митохондрий и мтДНК в фолликулярной жидкости, половых клетках, клетках эмбриона и жидкости полости бластоцисты [18-21]. Однако результаты исследований остаются противоречивыми, и ни один из методов в настоящее время не рекомендован к применению в рутинной клинической практике. Кроме того, данные методы предполагают инвазивное вмешательство. Перспективным инновационным методом оценки преимплантаци- онных эмбрионов считают анализ внеклеточной ДНК в культуральной среде, в том числе и мтДНК. Исследователи предполагают роль мтДНК как потенциального маркера успешности имплантации. Однако исследования, посвященные изучению мтДНК в культуральной среде, в мировой литературе крайне немногочисленны.
В нашем исследовании мы изучали связь между морфологическим качеством эмбрионов, возрастом пациенток, исходами переносов и профилем мтДНК в культуральной среде. Кроме того, в качестве контроля изучался уровень копийности мтДНК в культуральной среде, не содержащей эмбрионы и находившейся в тех же условиях.
Полученные данные подтверждают то, что куль-туральная среда является источником мтДНК, которая может быть детектирована и анализирована методом количественной ПЦР. Что согласуется с данными других исследователей, заявляющих о возможности детекции мтДНК в культуральной среде методом ПЦР в 99% случаев [9].
Согласно полученным данным, уровень копий- ности мтДНК в культуральной среде значительно выше в группе пациенток до 35 лет. Следует отметить, что статистически значимая разница отмечалась как при сравнении всех бластоцист (в группах по возрасту матери до и после 35 лет), так и при отдельном сравнении бластоцист различного качества. Указанные результаты согласуются с выводами исследования 2019 г. S. Stigliani et al. [11]. По данным других исследований, противоположно, количество мтДНК выше для пациенток старшего репро-дуктивного возраста [9, 12]. Ряд авторов отмечают отсутствие какой-либо связи между уровнем мтДНК в культуральной среде и возрастом матери [6, 8].
Также мы получили, что уровень копийности мтДНК в среде культивирования не связан с уровнем развития эмбриона на 5-6-е сутки, с морфоло-гической оценкой бластоцисты и частотой успешной имплантации. Схожие данные также отмечают исследователи некоторых работ [6, 8]. Кроме того, в литературе описывают и другого рода результаты.
Команда авторов под руководством S. Stigliani в 2013 г. сделала вывод, что большая концентрация мтДНК в культуральной среде на 2—3-и сутки культивирования ассоциирована со степенью фрагментации эмбриона, а также со старшим репродуктивным возрастом пациенток (35 лет и старше) [9]. В более позднем исследовании 2014 г. те же авторы проанализировали 605 образцов куль-туральной среды на 3-и сутки и получили обратные результаты: большая концентрация мтДНК выступала предиктором успешной бластуляции эмбрионов хорошего качества с незначительной (mild) степенью фрагментации. Кроме того, высокая концентрация мтДНК ассоциирована с частотой успешной имплантации при переносе эмбриона 3-х суток [10]. Авторы анализировали уже не только уровень копийности мтДНК, но соотношение мтДНК и геномной ДНК в культуральной среде. В 2019 г. исследователи дополнили свое исследование и попытались разработать комбинированный подход к выбору эмбрионов [11]. Авторы подчеркнули, что уровень мтДНК значительно выше для эмбрионов, которые достигали стадии бластоцисты, в сравнении с теми, что остановились в развитии. Кроме того, количество мтДНК в культуральной среде было выше среди женщин до 35 лет. Таким образом, исследователи заключили, что соотношение мт/геномной ДНК на 3-и сутки (пороговое значение >184) в сочетании с морфологической оценкой улучшает эффективность прогнозирования бластуляции, вне зависимости от характеристик пациента и цикла (чувствительность — 95%, специфичность — 65%).
Другая команда авторов определила, что количе-ство мтДНК в отработанной культуральной среде имеет положительную корреляционную связь с количеством мтДНК в клетках бластоцисты (иссле-довали материал всей бластоцисты), а также с воз-растом матери и качеством эмбриона [12].
В исследованиях показано, что концентрация мтДНК в культуральной среде значительно превышает концентрацию геномной ДНК [9, 18]. Одни исследователи отмечают, что уровень копийно- сти мтДНК в культуральной среде выше на 5-е сутки, в сравнении с 3-ми сутками культивирования [7]. Другие авторы подчеркивают отсутствие связи между уровнем мтДНК в культуральной среде и плоидностью эмбриона [6, 12]. Согласно исследованиям Kobayashi M. et al., копийность мтДНК в культуральной среде выше для бластоцист, испытывающих коллапсы (blastocyst collapse), и имеет положительную корреляционную связь с их количеством [8]. Известно, что перенос бластоцисты, испытывающей эпизоды коллапса («сжатия»), сопряжен со снижением частоты успешной имплантации с 48,5 до 35,1% [22]. Те же авторы замечают, что длительность между стартом бластуляции и формированием полной бластоцисты имеет значительную положительную корреляцию с количеством мтДНК в культуральной среде [8].
Учитывая полученные нами данные, а также результаты других аналогичных работ, вопрос о возможном использовании показателя копийности мтДНК в культуральной среде в качестве неинва-зивного маркера выбора эмбриона для переноса в полость матки остается открытым и требует прове-дения дополнительных исследований.
Данные, опубликованные к настоящему времени в мировой литературе, крайне противоречивы, что может быть связано с целым рядом факторов. Главные из них — это малое количество работ, посвященных изучению мтДНК в культуральной среде, небольшой объем выборок, разные дизайны исследований, разные методы анализа мтДНК (ПЦР, NGS), выбор разных фрагментов с целью детекции мтДНК. Кроме того, часть исследований выполнялась в условиях одной клиники (как в нашем случае), часть — в нескольких. Влияние на полученные результаты могли оказать такие факторы, как условия и длительность культивирования эмбриона, а также тип среды культивирования и время (сутки) ее коллекции. Помимо прочего, следует отметить, что морфологическая оценка эмбрионов проводится эмбриологом и носит субъективный характер, что также может отражаться на конечных результатах исследования.
В то же время наличие единичных результатов анализа контрольной культуральной среды, содер-жащих высокие уровни мтДНК, свидетельствует о возможной внешней контаминации во время сбора, транспортировки или анализа материала. Общими причинами контаминации могут выступать: белковые компоненты культуральной среды, материнская или отцовская контаминация (клетками куму- люса, полярными тельцами или сперматозоидами), а также внешняя контаминация во время периода культивирования [18].
Наше исследование выполнено как пилотный проект и было ограничено небольшой выборкой, что, вероятно, повлияло на результат. Тем не менее в данной работе показано, что уровень копийности мтДНК в культуральной среде эмбрионов выше для пациенток до 35 лет в сравнении с пациентками старшего репродуктивного возраста. Уровень копийности мтДНК не связан со степенью развития эмбриона на 5-6-е сутки культивирования, мор-фологической оценкой бластоцисты или частотой успешной имплантации.
Необходимо проведение дополнительных крупных унифицированных многоцентровых исследований с использованием единого дизайна, метода анализа мтДНК, нескольких вариантов контролей (пустая культуральная среда на 0, 3 и 5-е сутки куль-тивирования), фильтров при работе с материалом, а также нескольких фрагментов (праймеров) с целью детекции мтДНК.
Заключение
Культуральная среда является источником мтДНК, которая может быть детектирована и анализирована методом количественной ПЦР. Уровень мтДНК в культуральной среде — перспективный дополнитель-ный маркер для выбора эмбриона, переносимого в полость матки. Требуются дополнительные исследо-вания с целью разработки единого подхода к методам детекции мтДНК, а также протоколам культивирова-ния и определения возможности их использования в клинической практике.



