Наиболее частой причиной тиреотоксикоза во время беременности служит ДТЗ – органное аутоиммунное заболевание, в основе патогенеза которого лежит продукция лимфоцитами АТ-рТТГ, стимулирующих функцию щитовидной железы (ЩЖ) [1]. Частота ДТЗ во время беременности, по данным разных авторов, варьируется от 0,05 до 3% [2, 3].
Известно, что тиреотоксикоз оказывает неблагоприятное влияние на течение беременности и родов, негативно сказывается на состоянии плода и новорожденного, ассоциируется с угрозой невынашивания, гестозом, преждевременным излитием околоплодных вод, стремительными родами, повышенным риском врожденных аномалий развития, задержкой внутриутробного развития, гипотрофией плода [4, 5]. АТ-рТТГ, которые при ДТЗ в высоком титре определяются в крови беременной женщины, могут свободно проникать через плаценту и стимулировать ЩЖ плода с развитием в 2–3% случаев внутриутробного и врожденного тиреотоксикоза [6, 7]. По данным ряда авторов, родоразрешение на фоне неустраненного тиреотоксикоза может провоцировать развитие тиреотоксического криза у беременной женщины [8].
Целью терапии тиреотоксикоза стала нормализация концентрации гормонов ЩЖ в сыворотке крови, что достигается при применении тиреостатических препаратов. В последние годы чаще всего используются препараты группы тионамидов (производные имидазола – тиамазол, тирозол, мерказолил) или тиоурацила (пропилтиоурацил, пропицил). Карбонат лития и перхлорат натрия противопоказаны при беременности из-за частого развития побочных эффектов, а также «ускользания» тиреостатического эффекта через 2–3 месяца от начала терапии.
Наиболее доступным и информативным показателем контроля функции ЩЖ является содержание в сыворотке крови свободного трийодтиронина (свТ3) и свободного тироксина (свТ4), которые рекомендуется контролировать каждые 4–6 недель. Следует отметить, что уровень Т3 снижается позже, чем Т4, при этом уровень тиреотропного гормона (ТТГ) может оставаться подавленным в течение нескольких месяцев после достижения нормальных значений уровней гормонов ЩЖ [9].
Согласно исследованиям последних лет, лечение ДТЗ при беременности следует начинать с назначения тиреостатиков в терапевтических дозах: рекомендуемая начальная доза производных имидазола составляет 15–30, тиоурацила – 150–300 мг/сут. После устранения тиреотоксикоза дозы антитиреоидных препаратов уменьшают до «поддерживающих», чтобы добиться уровня свТ4 в крови у верхней границы нормы или несколько выше таковой [10].
Накопленные данные свидетельствуют, что в период беременности при чрезмерном подавлении уровня свТ4 (до нижнего диапазона нормы или ниже нормы) лечение необходимо полностью отменять, а в случае рецидива тиреотоксикоза прием препаратов следует возобновлять. Показано, что гипотироксинемия, способная развиваться вследствие применения тиреостатических препаратов, особенно в I триместре беременности, ассоциирована с нарушением нейропсихологического развития плода [11]. С прогрессированием беременности происходит закономерное уменьшение тяжести тиреотоксикоза и снижение потребности в тиреостатических препаратах, поэтому для большинства женщин в III триместре возможна полная отмена антитиреоидной терапии.
До сих пор обсуждается вопрос безопасности длительного приема беременными женщинами поддерживающих доз производных имидазола 5–10 мг/сут и пропилтиурацила 50–100 мг/сут.
По данным многих исследователей, тиреостатические препараты, назначаемые беременным женщинам с ДТЗ, угнетают функцию ЩЖ плода и новорожденного, вследствие чего формируется клиническая картина врожденного гипотиреоза. Также хорошо известно отрицательное влияние тиреостатиков на развитие систем и органов плода, преимущественно – на центральную нервную систему [12]. По этой причине на протяжении всего периода органогенеза плода в I триместре беременности препаратом выбора остается пропицил, поскольку полагают, что он практически не проникает через плаценту благодаря большей степени связывания с белками плазмы [13]. Ряд авторов показали, что его длительный прием ассоциируется с гепатотоксичностью, в связи с чем после завершения I триместра беременных женщин рекомендуется переводить на производные имидазола [14].
В литературе встречаются противоречивые данные об ассоциации антитиреоидных препаратов с риском эмбриопатии у плода. Так, препараты имидазола могут приводить к формированию врожденных аномалий, таких как нарушение волосяного покрова головы, атрезия хоан или пищевода, амфолоцеле [15]. В свою очередь выявление у плода мальформаций лица, шеи, пороков развития сердечно-сосудистой системы (деформации перегородок сердца, клапанов, стеноз легочной артерии) ряд авторов связывают с приемом пропицила [16].
Схему «блокируй–замещай», предусматривающую назначение поддерживающих доз тиреостатических препаратов в сочетании с препаратами тиреоидных гормонов, во время беременности большинство авторов не рекомендуют в связи с возрастанием потребности в тиреостатиках, что ассоциируется с риском формирования зоба и гипотиреоза у плода [17].
К радикальным методам лечения ДТЗ относятся предельно субтотальная или тотальная тиреоидэктомия и лечение радиоактивным йодом (I131). Показания к оперативному лечению ДТЗ во время беременности: аллергические реакции на тиреостатики, развитие агранулоцитоза, низкая приверженность пациенток, высокая потребность в тиреостатиках (более 30 мг тиамазола или более 450 мг 6-пропил-2-тиоурацила). Оптимальным сроком для проведения тиреоидэктомии считается II триместр беременности с последующим назначением заместительной терапии препаратами тиреоидных гормонов [11, 18]. Терапия I131, которая ассоциируется с радиационным риском и риском разрушения ЩЖ у плода в случае применения данной терапии после 12 недель гестации, противопоказана при беременности. Планирование беременности после терапии I131 по поводу ДТЗ разрешено не ранее, чем через 1 год [19].
Согласно данным, в период лактации прием небольших доз тиреостатических препаратов в «поддерживающих» дозах безопасен как для кормящей матери, так и для ребенка.
В случае рецидива тиреотоксикоза, который, как правило, развивается через 2–3 месяца после родов, большинство авторов рекомендуют возобновление приема антитиреоидных препаратов в терапевтических дозах, что может потребовать подавления лактации [20, 21].
Целью исследования стало изучение влияния тиреотоксикоза и тиреостатической терапии на течение и исход беременности.
Методы
В исследование были включены 116 беременных женщин, разделенных на 2 группы. Основную группу составили 67 беременных женщин с ДТЗ в возрасте от 19 до 37 лет (средний возраст – 27,4±0,5 года). Продолжительность заболевания варьировалась от нескольких недель до 7 лет. Пятидесяти двум женщинам диагноз ДТЗ был установлен до беременности, из них у 36 беременность наступила на фоне приема тиреостатических препаратов, у 16 в период с 6-й по 32-ю неделю беременности произошел рецидив тиреотоксикоза после длительной ремиссии ДТЗ. Пятнадцати женщинам диагноз ДТЗ впервые установлен во время беременности.
В контрольную группу были включены 49 беременных женщин в возрасте от 17 до 40 лет (средний возраст – 26,7±0,7 года) без патологии ЩЖ, получавших йодид калия в дозе 200 мкг/сут.
Всем женщинам проведено общеклиническое обследование, размеры ЩЖ оценены методом пальпации по Международной классификации Всемирной организации здравоохранения [22]. Ультразвуковое исследование (УЗИ) ЩЖ всем беременным женщинам и новорожденным детям на 4–7-й день жизни осуществлено на аппарате Voluson 730, Expert GE. Измерение долей ЩЖ проведено при продольном и поперечном сканировании, объем ЩЖ рассчитан по формуле J. Brunn [23]. Содержание в сыворотке крови беременных женщин и в пуповинной крови новорожденных свТ4, ТТГ и АТ-рТТГ определено иммуноферментным методом с использованием стандартных наборов фирмы «Алкор-Био» (Россия) и «DRG diagnostics» (Германия). Для оценки функционального состояния ЩЖ новорожденного высчитан коэффициент ТТГ/свТ4.
Полученные результаты обработаны с помощью стандартной программы SPSS (версия 6.0) на персональном компьютере методом вариационной статистики. Проверка гипотезы о равенстве двух средних проведена с помощью t-критерия Стьюдента. Различия между сравниваемыми величинами считали статистически достоверными при p<0,05.
Результаты
Женщинам основной группы диагноз ДТЗ установлен на основании жалоб на учащенное сердцебиение, дрожь в теле, потливость, эмоциональную лабильность, частый стул, снижение массы тела или на недостаточную прибавку массы тела в период гестации.
Во время беременности 38 пациенткам основной группы был назначен мерказолил в начальной дозе 20 мг/сут, 29 пациенток получали пропицил в дозе 100–200 мг/сут. Начало применения тиреостатических препаратов 48 (71%) женщинами пришлось на I триместр беременности, 19 (29%) – на II триместр беременности. После устранения основных симптомов тиреотоксикоза 21 (32%) пациентке тиреостатическая терапия была отменена, 46 (68%) продолжили прием поддерживающих доз тиреостатических препаратов: мерказолил – 5–10 мг/сут или пропицил – 50 мг/сут. Перед отменой терапии или при переводе с терапевтических доз тиреостатических препаратов на поддерживающие вновь оценивали клиническую картину заболевания, ориентируясь на улучшение самочувствия женщин, снижение частоты сердечных сокращений, нормализацию артериального давления, исчезновение тремора кистей рук, адекватную прибавку массы тела.
Объем ЩЖ женщин основной группы был исходно выше (p<0,001), чем в контрольной группе. Данные представлены в табл. 1.

Функциональное состояние ЩЖ женщин в исследуемых группах представлено в табл. 2.

У всех женщин основной группы до назначения тиреостатической терапии определен повышенный титр АТ-рТТГ в сыворотке крови. Проведенный анализ выявил достоверное снижение этого показателя (p<0,05) к родоразрешению (рис. 1).
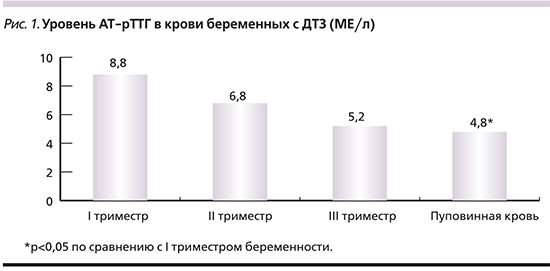
Показанием к отмене терапии служило чрезмерное подавление уровня свТ4 в сыворотке крови (до нижнего диапазона нормы или ниже). Показания к переводу на «поддерживающие» дозы тиреостатических препаратов: сохраняющееся повышенное содержание в сыворотке крови свТ4 и АТ-рТТГ, поскольку отмена лечения на ранних сроках беременности приводила к рецидиву тиреотоксикоза перед родами.
Сравнительный анализ показателей беременности и родов в группе женщин с ДТЗ до и после тиреостатической терапии выявил ряд достоверных различий, представленных в табл. 3 и 4.

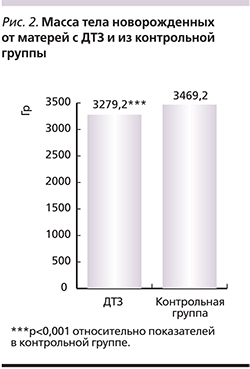
От матерей с ДТЗ родились 68 детей (одна двойня). Средняя масса тела новорожденных была достоверно (р<0,001) ниже данного показателя в контрольной группе (рис. 2).
 Средний объем ЩЖ у новорожденных от матерей с ДТЗ достоверно превышал (p<0,001) соответствующий показатель в контрольной группе, пределы колебаний этого показателя в контрольной группе при р=0,001 варьировались от 0,36 до 0,71 см3 (рис. 3). Объем ЩЖ новорожденных (1,85±0,18 см3), матери которых получали тиреостатики в течение всего срока беременности, достоверно превышал анологичный показатель (1,14±0,23 см3) у новорожденных, матерям которых тиреостатическая терапия была отменена на более раннем сроке беременности (p<0,05). Объем ЩЖ и частота зоба у новорожденных, матери которых получали препараты имидазола (1,7±0,2 см3, 83,3±8,8%) или пропицил (1,9+0,3 см3, 100%), достоверно не различались.
Средний объем ЩЖ у новорожденных от матерей с ДТЗ достоверно превышал (p<0,001) соответствующий показатель в контрольной группе, пределы колебаний этого показателя в контрольной группе при р=0,001 варьировались от 0,36 до 0,71 см3 (рис. 3). Объем ЩЖ новорожденных (1,85±0,18 см3), матери которых получали тиреостатики в течение всего срока беременности, достоверно превышал анологичный показатель (1,14±0,23 см3) у новорожденных, матерям которых тиреостатическая терапия была отменена на более раннем сроке беременности (p<0,05). Объем ЩЖ и частота зоба у новорожденных, матери которых получали препараты имидазола (1,7±0,2 см3, 83,3±8,8%) или пропицил (1,9+0,3 см3, 100%), достоверно не различались.
Для оценки функционального состояния ЩЖ у новорожденных высчитывали коэффициент ТТГ/свТ4. У здоровых детей коэффициент ТТГ/свТ4 составил 0,27–0,72 при р=0,001. В основной группе данный коэффициент был достоверно выше (р<0,01), чем аналогичный показатель в контрольной группе (табл. 5).
По коэффициенту ТТГ/свТ4 все новорожденные от матерей с ДТЗ были разделены на три подгруппы. В 1-ю подгруппу вошли 36 из 68, которым был диагностирован субклинический гипотиреоз. Гипофункция ЩЖ выявлена преимущественно у новорожденных, матери которых принимали тиреостатические препараты во II и III триместрах беременности (ТТГ/свТ4 – 1,34±0,2) (р<0,05) по сравнению с новорожденными, матерям которых тиреостатическая терапия была отменена на более ранних сроках (ТТГ/свТ4 – 0,82±0,1). Достоверных различий в частоте возникновения врожденного гипотиреоза на фоне приема мерказолила или пропицила выявлено не было.
 Вторую подгруппу составили 11 новорожденных, у которых была выявлена гиперфункция ЩЖ. При нормальных показателях АТ-рТТГ (0,8±0,2 МЕ/л) в основной группе средний объем ЩЖ у детей составил 1,27±0,2 см3, тогда как в группе новорожденных с повышенным уровнем АТ-рТТГ (5,2±0,7 МЕ/л) объем ЩЖ был 1,96±0,2 см3 (p<0,05).
Вторую подгруппу составили 11 новорожденных, у которых была выявлена гиперфункция ЩЖ. При нормальных показателях АТ-рТТГ (0,8±0,2 МЕ/л) в основной группе средний объем ЩЖ у детей составил 1,27±0,2 см3, тогда как в группе новорожденных с повышенным уровнем АТ-рТТГ (5,2±0,7 МЕ/л) объем ЩЖ был 1,96±0,2 см3 (p<0,05).
У 21 новорожденного (3-я подгруппа) показатели функционального состояния ЩЖ не выходили за пределы физиологических значений. Результаты оценки функционального состояния ЩЖ новорожденных представлены в табл. 6.
Обсуждение
В ходе исследования был проведен анализ результатов лечения ДТЗ у пациенток основной группы. При этом было установлено, что степень выраженности зоба у беременных женщин основной группы достоверно снижалась (p<0,05), но по-прежнему превышала исходный показатель в контрольной группе. Также выявлено статистически значимое снижение уровня свТ4 (p<0,001) в основной группе, что свидетельствовало о нормализации функции ЩЖ и достижении эутиреоза. Уровень ТТГ после лечения достоверно не отличался от исходных данных, но был ниже, чем в контрольной группе, что согласуется с данными других авторов [11]. Достоверное снижение титра АТ-рТТГ (p<0,05) к моменту родов в основной группе женщин можно связать как с проводимым лечением тиреотоксикоза, так и с иммуносупрессивным действием непосредственно самой беременности [19].
Следует отметить, что у женщин с ДТЗ до назначения лечения достоверно чаще выявлялись такие осложнения беременности, как ранний токсикоз (83%), угроза прерывания беременности (94%), гестоз (100%), плацентарная недостаточность (55%) с гипотрофией плода (89%) и родов: преждевременные роды (33%), гипоксия плода (44%), несвоевременное излитие околоплодных вод (83%), чем в группе женщин, получавших тиреостатическую терапию, и в контрольной группе, что подтверждает негативное влияние неустраненного тиреотоксикоза на течение беременности и родов. Частота гипотрофии плода также была достоверно выше. Важно, что частота аномалии родовой деятельности и оперативного родоразрешения достоверно (p<0,01) превышала этот показатель в контрольной группе и статистически значимо снижалась в результате антитиреоидной терапии ДТЗ (p<0,01) [4, 5].
Было показано, что новорожденные от матерей с ДТЗ имели достоверно (p<0,001) более низкие весовые показатели относительно новорожденных от матерей контрольной группы, что было показано ранее другими авторами [5] . При этом гипотрофией страдали 8 детей, матерям которых во время беременности диагностирована хроническая плацентарная недостаточность, однако связи гипотрофии плода с функциональным состоянием ЩЖ новорожденных не было выявлено.
Кроме того, размеры ЩЖ новорожденных основной группы достоверно превышали (p<0,001) соответствующий показатель в контрольной группе. Особо следует отметить, что сравнение объема ЩЖ, а также частоты развития зоба у новорожденных, матери которых получали препараты имидазола или пропицил, не было статистически достоверным. Однако было установлено, что объем ЩЖ новорожденных, матери которых получали тиреостатики в течение всего срока беременности, достоверно превышал анологичный показатель у новорожденных, матерям которых тиреостатическая терапия отменена на более раннем сроке беременности (p<0,05). Длительность тиреостатической терапии также влияла на функциональное состояние ЩЖ новорожденного, повышая частоту гипотиреоза (p<0,05), однако связи с видом используемого тиреостатического препарата не отмечено. Возникновение субклинического тиреотоксикоза можно связать с трансплацентарным переходом АТ-рТТГ от матери к плоду. Была выявлена прямая достоверная зависимость между объемом ЩЖ новорожденных от матерей с ДТЗ и уровнем АТ-рТТГ в пуповинной крови (p<0,05).
Полученные результаты оценки коэффициента ТТГ/свТ4 позволили углубленно изучить функциональное состояние ЩЖ новорожденных от матерей основной группы. Высокая частота субклинического гипотиреоза (более 50%) у новорожденных связана с трансплацентарным переходом тиреостатических препаратов. Кроме того, полученные сведения подтверждают данные о возможности равнозначного трансплацентарного перехода как препаратов группы производных имидазола, так и пропицила.
Следует подчеркнуть, что длительная тиреостатическая терапия беременных женщин с ДТЗ также способствовала увеличению частоты возникновения неонатальной гипофункции ЩЖ. Субклиническая гиперфункция ЩЖ выявлена у 17% новорожденных. Данный феномен можно связать с трансплацентарным переходом АТ-рТТГ, что подтверждается значительным их преобладанием у новорожденных данной подгруппы (р<0,001). Явный тиреотоксикоз встречается относительно редко от общего числа детей от матерей с ДТЗ (1,4%).
Выводы
Таким образом, полученные в проведенном нами исследовании данные подтверждают негативное влияние тиреотоксикоза на течение беременности и родов у женщин с ДТЗ, повышая риск осложнений, выраженность которых значительно усугубляется на фоне неустраненного тиреотоксикоза, а также указывают на то, что на объем и функциональное состояние ЩЖ новорожденных одновременно влияет трансплацентарный перенос АТ-рТТГ и тиреостатических препаратов. Высокая частота субклинического гипотиреоза у новорожденных (53%) от матерей с ДТЗ требует оптимиза-ции доз тиреостатиков, назначаемых для лечения ДТЗ во время беременности.



