ОПРЕДЕЛЕНИЕ
Острый инфаркт миокарда (ОИМ) – заболевание, обусловленное острым нарушением коронарного кровотока, приводящим к возникновению ишемии миокарда с последующим образованием некроза. Как правило, ОИМ осложняет течение ишемической (коронарной) болезни сердца (ИБС)
Международное универсальное определение ОИМ (2018 год)
Согласно международным согласительным документам, ОИМ диагностируется, когда признаки острого некроза миокарда возникают в клинической ситуации, указывающей на наличие ишемии миокарда.
ОИМ, не связанный с недавними инвазивными вмешательствами на коронарных артериях (при разрыве/эрозии атеросклеротической бляшки, дисбалансе между потребностью миокарда в кислороде и его доставкой, тромбозе/рестенозе стента), диагностируется при наличии повышения и/или снижения уровня сердечного тропонина в крови, когда его концентрация как минимум в одной пробе крови превышает 99-й перцентиль от верхней границы нормы и имеется как минимум одно из следующих свидетельств ишемии миокарда:
а) клиническая картина ишемии миокарда;
б) изменения ЭКГ, указывающие на появление ишемии миокарда (возникновение смещений ST-T, блокады левой ножки пучка Гиса (ЛНПГ);
в) появление патологических зубцов Q на ЭКГ;
г) появление признаков потери жизнеспособного миокарда или нарушений локальной сократимости, характерных для ишемической этиологии, при использовании методик, позволяющих визуализировать сердце;
д) выявление тромба в коронарной артерии при коронарной ангиографии (КАГ) или патологоанатомическом исследовании (для ИМ, связанного с разрывом/эрозией атеросклеротической бляшки, тромбозом/рестенозом стента, а также в случаях, когда смерть наступила раньше, чем появилась возможность определения уровня сердечного тропонина в крови или можно ожидать его повышения).
Для констатации ОИМ, связанного с инвазивными вмешательствами на коронарных артерий, учитывается более выраженное увеличение сердечного тропонина (более 5 раз от верхней границы нормы после чрескожного коронарного вмешательства [ЧКВ] и более 10 раз от верхней границы нормы после операции коронарного шунтирования у больных с исходно нормальной концентрацией тропонина в крови). При исходно повышенном уровне тропонина в крови до процедуры следует убедиться, что его концентрация остается стабильной (варьируется не более чем на 20%) или снижается, чтобы не приписать последующее увеличение уровня биомаркера процедуре в случаях, когда концентрация тропонина продолжает расти из-за недавно перенесенного ОИМ. У этой категории больных о наличии ОИМ, связанного с вмешательством, свидетельствует сочетание высокой концентрации сердечного тропонина в крови с его повышением более 20% от исходного.
Кроме того, необходимо как минимум одно из следующих:
а) изменения ЭКГ, указывающие на появление ишемии миокарда (для ОИМ, связанного с ЧКВ);
б) появление патологических зубцов Q на ЭКГ (достаточно для констатации наличия ОИМ даже в случаях, когда степень повышения концентрации сердечного тропонина в крови после вмешательства не достигает указанных выше значений);
в) появление признаков потери жизнеспособного миокарда или нарушений локальной сократимости, характерных для ишемической этиологии, при использовании методик, позволяющих визуализировать сердце;
г) ангиографические признаки осложнений инвазивного вмешательства, приводящих к ограничению коронарного кровотока (диссекция коронарной артерии, окклюзия крупной эпикардиальной коронарной артерии или шунта, тромботическая окклюзия боковой ветви коронарной артерии, нарушение коллатерального кровотока);
д) тромб, связанный с ЧКВ, или макроспопически большая ограниченная зона некроза миокарда при патологоанатомическом исследовании (для ОИМ, связанного с ЧКВ).
В более поздние сроки заболевания о перенесенном ИМ свидетельствуют:
- наличие патологических зубцов Q на ЭКГ при отсутствии других, неишемических причин для возникновения некроза миокарда;
- свидетельства локальной потери жизнеспособного миокарда, характерные для ишемической этиологии, при использовании методик, позволяющих визуализировать сердце;
- признаки перенесенного ИМ при патологоанатомическом исследовании.
КОДЫ МКБ-10
Острый инфаркт миокарда (121)
121.0 – Острый трансмуральный инфаркт миокарда передней стенки
121.1 – Острый трансмуральный инфаркт миокарда нижней стенки
121.2 – Острый трансмуральный инфаркт миокарда других уточненных локализаций
121.3 – Острый трансмуральный инфаркт миокарда неуточненной локализации
121.4 – Острый субэндокардиальный инфаркт миокарда
121.9 – Острый инфаркт миокарда неуточненный
Повторный инфаркт миокарда (122)
122.0 – Повторный инфаркт миокарда передней стенки
122.1 – Повторный инфаркт миокарда нижней стенки
122.8 – Повторный инфаркт миокарда другой уточненной локализации
122.9 – Повторный инфаркт миокарда неуточненной локализации
Другие формы острой ишемической болезни сердца (124)
124.0 – Коронарный тромбоз, не приводящий к инфаркту миокарда
124.8 – Другие формы острой ишемической болезни сердца
О соотношении диагностических терминов «ОКС», «ОИМ» и «ОИМпST»
Термин «острый коронарный синдром» (ОКС) используется, когда диагностической информации еще недостаточню для окончательного суждения о наличии или отсутствии очагов некроза в миокарде.
Соответственно, ОКС – это рабочий диагноз в первые часы и сутки заболевания, тогда как понятия «ОИМ» и «нестабильная стенокардия» (ОКС, не закончившийся появлением признаков некроза миокарда) используются при формулировании окончательного диагноза.
Если признаки некроза миокарда обнаруживаются у больного ОКС, у которого на исходных ЭКГ отмечены признаки трансмуральной ишемии миокарда (стойкие – более 20 минут –
подъемы сегмента ST), это состояние обозначают как ОИМ с подъемом сегмента ST электрокардиограммы (ОИМпST). В дальнейшем зависимости от ЭК-картины или/и данных методов, регистрирующих движения стенки сердца, ИМ может оказаться крупноочаговым, мелкоочаговым, с патологическими зубцами Q, без зубцов Q и т.д.
ЭПИДЕМИОЛОГИЯ
ИБС является самой частой причиной смерти в мире. Более 7 млн человек каждый год умирают от ИБС, что составляет 12,8% от всех смертей. Каждый шестой мужчина и каждая седьмая женщина в Европе умирают от ИМ. ОИМпST – одна из самых тяжелых форм ИМ, при которой наблюдается наивысшая смертность среди больных и высокая частота потери трудоспособности. Наиболее полный регистр ОИМпST имеется, вероятно, в Швеции, где заболеваемость составляет 66 случаев ОИМпST на 100 тыс. населения в год. Аналогичные цифры были представлены в Чехии, Бельгии и США: в этих странах заболеваемость ОИМпST снизилась в период между 1997 и 2005 гг. с 121 до 77 случаев на 100 тыс. человек, в то время как показатели заболеваемости ИМ без подъема ST увеличились с 126 до 132 случаев на 100 тыс. человек. Смертность от ОИМпST зависит от многих факторов, среди которых размер и локализация очага некроза, возраст, класс по Killip, время задержки начала лечения, наличие в анамнезе перенесенного ИМ, сопутствующие сахарный диабет (СД), почечная недостаточность, количество пораженных коронарных артерий, фракция выброса (ФВ), а также проводимое лечение. Госпитальная смертность больных ОИМпST, по данным национальных регистров, колеблется между 6 и 14%.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
ОКС – это угрожающее жизни проявление атеросклероза. Обычно он развивается в результате острого тромбоза коронарной артерии на фоне разрыва или эрозии атеросклеротической бляшки, которые приводят к внезапному критическому снижению кровоснабжения миокарда. Ключевое значение в патогенезе разрыва атеросклеротической бляшки имеет воспаление. Лишь в редких случаях ОКС имеет неатеросклеротическое происхождение и может быть обусловлен артериитом, травмой, расслоением стенки артерии, тромбоэмболией и др. ОИМпST характеризуется наличием сохраняющихся электрокардиографических признаков трансмуральной ишемии миокарда, указывающих на стойкую окклюзию крупной эпикардиальной коронарной артерии.
Причины развития ИМ:
- в подавляющем большинстве случаев — кровоизлияние в атеросклеротическую бляшку или нарушение ее целостности с последующим формированием в этой области окклюзирующего тромба, богатого фибрином;
- длительный спазм коронарных артерий;
- несоответствие притока крови по коронарным сосудам возросшей потребности миокарда в кислороде (менее характерно для ИМпST).
Размеры зоны некроза определяются:
- уровнем поражения коронарного русла;
- длительностью и стойкостью окклюзии коронарной артерии;
- состоянием коллатеральных связей
- в системе коронарных сосудов;
- сопутствующим спазмом коронарных сосудов;
- степенью и объемом нарушения микроциркуляции в мышце сердца.
Как правило, участок миокарда вокруг формирующегося очага некроза по условиям метаболизма и функционирования находится в промежуточном состоянии между интактным миокардом и некротически измененными кардиомиоцитами. Его судьба во многом зависит от состояния коллатеральных связей, спазма коронарных сосудов и выраженности нарушений микроциркуляции. При улучшении коронарного кровотока возможно восстановление нормальной жизнеспособности этой зоны. Характер и степень поражения миокарда во многом зависят от длительности прекращения кровотока по коронарной артерии.
При восстановлении кровотока:
- через 15 минут обычно полностью сохраняется жизнеспособность миокарда;
- через 30 минут, как правило, наблюдается гибель отдельных кардиомиоцитов в субэндокардиальных отделах мышцы сердца;
- через 60 минут некротические изменения чаще всего локализуются во внутренней трети миокарда;
- через 3 часа подвергается некрозу средний слой миокарда;
- через 6 часов, как правило, формируется очаг трансмурального некроза.
Таким образом, ИМ у больных с электрокардиографическими признаками трансмуральной ишемии миокарда в конечном итоге не всегда является крупноочаговым.
При быстрой ликвидации окклюзии коронарной артерии размер очага некроза может оказаться незначительным, а иногда некроз не удается выявить даже с помощью чувствительных методов биохимической диагностики. В этих случаях говорят о «прерванном» ИМ.
КЛАССИФИКАЦИЯ
Клиническая классификация типов ИМ
Тип 1. ИМ, развившийся без видимых причин (спонтанно) в результате первичного нарушения коронарного кровотока, обусловленного образованием эрозии, разрыва, трещины или диссекции атеросклеротической бляшки с появлением тромба в просвете коронарной артерии.
Тип 2. ИМ, развившийся в результате ишемии, связанной с дисбалансом между потребностью миокарда в кислороде и его доставкой (например, при спазме или эмболии коронарной артерии, анемии, нарушениях ритма сердца, анемии, дыхательной недостаточности, артериальной гипертензии [АГ] или гипотензии), когда нет острых проявлений атеротромбоза.
Тип 3. Сердечная смерть на фоне симптомов, позволяющих заподозрить ишемию миокарда у больных с предположительно остро возникшими ишемическими изменениями на ЭКГ или фибрилляцией желудочков, в случаях когда летальный исход наступил до появления возможности забора образцов крови или раньше, чем отмечается повышение уровня сердечных тропонинов в крови.
Тип 4а. ИМ, связанный с процедурой ЧКВ.
Тип 4б. ИМ, связанный с тромбозом коронарного стента.
Тип 4с. ИМ, связанный с рестенозом в месте установки коронарного стента.
Тип 5. ИМ, связанный с операцией коронарного шунтирования.
Периодика ИМ
На основании клинических, морфологических и других признаков согласительный документ, принятый рядом международных кардиологических сообществ в 2007 г., предлагает разделить течение ИМ на несколько периодов:
- развивающийся ИМ – от 0 до 6 часов;
- ОИМ – от 6 часов до 7 суток;
- заживающий (рубцующийся) ИМ – от 7 до 28 суток;
- заживший ИМ – начиная с 29-х суток.
Относительность такого деления очевидна, однако оно может оказаться полезным для статистических и исследовательских целей. Под повторным понимают ИМ, развившийся после 28 суток от предыдущего. Если же этот срок меньше, то речь идет о рецидивирующем ИМ.
Клиническая периодика ИМ отличается от терминов, используемых в МКБ-10. Согласно правилам этой статистической системы «острым» считается ИМ в первые 28 суток. после его возникновения, «повторным» – новый ИМ, развывшийся в этот период времени. Второй ИМ, возникший после 28 суток после первого, обозначается как «острый». Таким образом, по МКБ-10 термины «рецидивирующий» и «повторный» ИМ являются синонимами.
ДИАГНОЗ
Клинические признаки и симптомы
Анамнез. При сборе анамнеза у больных ОИМпST необходимо выяснить наличие ИБС, а также факторов риска ИБС и ИМ (атеросклероз других сосудистых областей, АГ, курение, СД, ожирение и др.). Следует расспросить больного о факторах, спровоцировавших развитие настоящего заболевания: чрезмерная физическая нагрузка, психоэмоциональное напряжение, инфекции и т.п.
Физикальное обследование. Физика-льное обследование в остром периоде ИМ редко позволяет найти симптомы, специфичные для этого заболевания. Кожные покровы могут быть бледными и повышенной влажности, особенно на высоте ангинозного приступа, слизистые умеренно цианотичны. Более выраженный цианоз, потливость и снижение кожной температуры, особенно кистей и стоп, наблюдаются при острой сердечной недостаточности (СН). Для острого периода ИМ, особенно на фоне продолжающегося ангинозного приступа, характерна нейрогуморальная активация, в связи с чем при неосложненном ИМ часто встречается тахикардия и склонность к повышению артериального давления (АД). Появление влажных хрипов в нижних отделах легких свидетельствует о левожелудочковой недостаточности.
Прединфарктный период. Неста-бильная стенокардия. ОИМпST нередко развивается как внезапная катастрофа без продромальных синдромов. Вместе с тем более чем у половины больных за несколько дней до этого наблюдаются симптомы, которые ретроспективно могут быть расценены как признаки появления или обострения коронарной недостаточности. Нередко их серьезность недооценивается больным, и он не обращается за медицинской помощью. Но не менее 75% этих больных обращаются к врачу с соответствующими жалобами, и они во многих случаях неправильно интерпретируются. Как правило, речь идет о стенокардии, которая в период, предшествовавший развитию ИМ, нередко изменяет свой характер: приступы могут учащаться (иногда они следуют с интервалом в несколько минут), становиться более интенсивными, изменять или расширять область иррадиации, появляться при меньшей нагрузке.
К стенокардии напряжения нередко присоединяется стенокардия покоя, в т.ч. ее ночные приступы. Особенно неблагоприятны прогностически затяжные (10–15 и более минут) ангинозные приступы, сопровождающиеся выраженной вегетативной реакцией, нарастанием признаков СН, аритмиями. Такая форма стенокардии называется «нестабильной». Изменения ЭКГ – частый, но необязательный признак нестабильной стенокардии. Вместе с тем стенокардия, сопровождающаяся изменениями на ЭКГ: депрессией сегмента ST, кратковременной элевацией сегмента ST, изменениями полярности – обычно инверсией – зубцов Т, имеет худший прогноз.
В ряде случаев продромальный период ИМ проявляется неспецифическими для коронарной недостаточности симптомами: повышенной утомляемостью, общей слабостью и т.п. «Нестабильная стенокардия» и «прединфарктное состояние» – не синонимы, хотя нестабильная стенокардия важна именно как возможный предвестник ИМ: при естественном течении заболевания или неадекватном его лечении у 15–20% больных этой группы ИМ развивается в течение ближайших 4–6 недель.
Нестабильная стенокардия, особенно наиболее тяжелые и прогностически неблагоприятные ее формы, требует безотлагательного начала лечения и немедленной госпитализации.
Классический (типичный) вариант ОИМпST
Классическое начало ОИМпSТ характеризуется появлением ангинозного приступа, который встречается в 75–80% случаев. Типичный ангинозный приступ характеризуется загрудинной болью давящего, жгучего, сжимающего или распирающего характера с иррадиацией в левую руку, шею, нижнюю челюсть, левую лопатку или межлопаточное пространство. По характеру боль сходна с таковой при приступе стенокардии, но отличается по силе и продолжительности. В большинстве случаев она полностью не купируется приемом нитроглицерина, а иногда и повторными инъекциями наркотических анальгетиков. Интенсивность болевого синдрома при ИМпSТ может быть различной – от незначительной до невыносимой. Характер болевых ощущений разнообразен: сжимающий, давящий, жгучий. Наиболее типично чувство сжатия или давления за грудиной. Может наблюдаться иррадиация боли в левую руку, левое плечо, горло, нижнюю челюсть, эпигастрий и т.д. Иногда больные предъявляют жалобы на атипичные боли только в области иррадиации, например, в левой руке. При ОИМпSТ боль может носить волнообразный характер и продолжается от 20 минут до нескольких часов.
Болевой синдром часто сопровождается чувством страха («страх смерти»), возбуждением, беспокойством, а также вегетативными нарушениями, например повышенным потоотделением.
Атипичные формы ОИМпST
Астматический вариант чаще развивается при повторном ИМ. Он обычно встречается у больных пожилого и старческого возраста, особенно на фоне предшествовавшей хронической СН, при повторных ИМ. При этом ангинозные боли могут быть не очень интенсивными или вовсе отсутствовать и приступ сердечной астмы или отек легких являются первым и единственным клиническим симптомом ИМ.
Абдоминальный вариант. Для него характерны боль в верхней части живота, тошнота, рвота, метеоризм, а в ряде случаев – парез желудочно-кишечного тракта. Неправильно поставленный диагноз бывает причиной ошибочной лечебной тактики. Известны случаи, когда таким больным делают промывание желудка и даже производят оперативное вмешательство. Поэтому у каждого больного с подозрением на «острый живот» необходимо зарегистрировать ЭКГ.
Аритмический вариант – в клинической картине преобладают различные нарушения ритма и проводимости. При аритмической форме ИМ болевой синдром может отсутствовать или быть выраженным незначительно. Если же тяжелые нарушения ритма возникают на фоне типичного ангинозного приступа или одновременно с ним, говорят не об атипичной форме ИМ, а о его осложненном течении, хотя условность такого деления очевидна.
Цереброваскулярный вариант наиболее часто встречается у пациентов пожилого возраста с исходно стенозированными экстракраниальными и внутричерепными артериями, нередко с нарушениями мозгового кровообращения в прошлом. Он может проявляться обмороком, головокружением, тошнотой, рвотой, иногда признаками преходящего нарушения мозгового кровообращения, а порой носить характер тяжелого, протекающего параллельно инсульта.
В некоторых случаях тяжелые ишемические инсульты развиваются вследствие тромбоэмболии мозговых сосудов из-за фрагментации тромба в левом желудочке, образовавшегося вследствие обширного ИМ. В подобных случаях, по-видимому, правильнее говорить об осложнении ИМ, а не о клиническом варианте его дебюта.
Малосимптомная (безболевая) форма ИМ наблюдается часто: по некоторым данным, в 25% всех случаев ИМ он оказывается неожиданной находкой на аутопсии у умерших от других причин. В некоторых из них, по-видимому, речь идет о случаях ИМ, когда медицинское обследование было невозможно, а впоследствии больные забывали об этих эпизодах или по каким-то иным причинам не обращались к врачу. Однако у существенной части больных симптомы ИМ, в т.ч. болевой синдром, могут быть настолько слабо выраженными, что практически незаметно проходят для больного. Такой вариант начала ИМ чаще наблюдается при СД, у женщин, у лиц пожилого возраста, после перенесенного нарушения мозгового кровообращения.
Лабораторные и инструментальные методы исследования
Начальная диагностика ОИМпST
- ЭКГ в 12 отведениях как можно быстрее (<10 минут от первого контакта с медицинским персоналом);
- При подозрении на ОИМпST следует как можно быстрее наладить мониторирование ЭКГ;
- Рекомендуется взятие крови для определения маркеров некроза в острый период, но нельзя откладывать реперфузионное лечение в ожидании результатов;
- Следует рассмотреть использование «задних» отведений ЭКГ (V7–V9) у больных с подозрением на нижне-базальный ИМ (окклюзию огибающей артерии);
- ЭхоКГ может помочь в диагностике неясных случаев, но не должна задерживать выполнение КАГ.
Клеточный состав крови и СОЭ. При ОИМпST увеличивается содержание лейкоцитов в крови (нейтрофилов) до 12–15×109/л, а иногда и более. Выраженный лейкоцитоз считается неблагоприятным прогностическим признаком. Вместе с тем эти лабораторные показатели не входят в критерии диагностики ИМ.
Повышение температуры тела. Характерный симптом крупноочагового ИМ – повышение температуры тела. Она обычно повышается к концу первых суток заболевания, достигает субфебрильных цифр и сохраняется в течение 3–5 дней. Повышенная температура тела, сохраняющаяся более 7 дней, температура >38,0–38,5°С позволяют заподозрить осложнения заболевания (пневмония, флебит и т.п.). Повышение температуры не является критерием диагностики ИМ.
ЭКГ. ЭКГ – важнейший инструментальный метод диагностики ИМ. Для ОИМпST характерно возникновение подъема ST на ≥0,1 мВ в двух смежных отведениях (≥0,05 мВ в отведениях V7–V9; ≥0,25 мВ до 40 лет/≥0,2 у мужчин ≥40 лет или ≥0,15 мВ у женщин в отведениях V2–V3), который оценивается на уровне точки J в случаях, когда нет блокады ЛНПГ и гипертрофии левого желудочка. При подозрении на ОКС ЭКГ в 12 отведениях следует зарегистрировать как можно раньше. Необходимо, чтобы это было сделано уже на догоспитальном этапе. Интервал между первым контактом с медицинским работником и регистрацией ЭКГ не должен превышать 10 минут. Несмотря на высокую диагностическую ценность ЭКГ, следует учитывать, что она оказывается информативной далеко не всегда. Чтобы своевременно обнаружить диагностически значимые изменения ЭКГ, рекомендуются не только как можно более ранняя ее регистрация, но и повторные записи в течение суток (иногда с интервалом в несколько десятков минут), особенно если у больного возобновляются ангинозные приступы. В неясных случаях полезно мониторирование степени смещения сегмента ST в 12 отведениях в режиме реального времени. Важно иметь возможность сравнения с ЭКГ, зарегистрированной до наступления настоящего коронарного приступа.
В зависимости от сформировавшихся изменений на ЭКГ выделяют:
- ИМ с формированием патологических зубцов Q;
- ИМ без формирования патологических зубцов Q.
В зависимости от локализации очага некроза выделяют:
- ИМ межжелудочковой перегородки (ишемические изменения в отведениях V1–V2);
- ИМ передней стенки левого желудочка (ишемические изменения в отведениях V3–V4);
- ИМ боковой стенки левого желудочка (ишемические изменения в отведениях I, aVL, V5–V6);
- ИМ нижней стенки левого желудочка: нижний (ишемические изменения в отведениях II, III, aVF), нижне-базальный (ишемические изменения в отведениях V7–V9);
- ИМ правого желудочка (ишемические изменения в отведениях V3R–V4R);
- ИМ предсердий.
Биохимические маркеры некроза миокарда. Уровень в крови одного из сердечных тропонинов – Т или I – играют центральную роль в диагностике ОИМ и стратификации риска неблагоприятного исхода. Для диагностики крупноочагового ИМ, каким, как правило, бывает ОИМпST, достаточно оценки к чувствительности к МВ-фракции креатинфосфокиназы (КФК). При использовании современных высокочувствительных тест-систем для определения сердечных тропонинов повышение их уровня в крови отмечается уже через 3 часа от начала приступа, а повторный забор пробы еще через 1–3 часа позволяет получить диагностически значимый результат у большинства больных (для тест-систем с «обычной» чувствительностью повышение уровня сердечного тропонина в крови происходит через 6 часов от начала приступа и при первом отрицательном результате повторный забор крови на анализ рекомендуется через 6–9 часов). Отрицательный тест на сердечный тропонин в сроки, когда ожидается его повышение, позволяет исключить диагноз ИМ. Важное свойство сердечных тропонинов – длительный период повышения концентрации в крови: до 10 суток для тропонина I и до 14 суток для тропонина T.
Желательно использовать современные высокочувствительные методы с низким пороговым значением, которые позволяют диагностировать ОИМ чаще и раньше. Использование общей КФК для диагностики ИМ не рекомендуется.
Концентрация сердечного тропонина в крови может повышаться не только при ИМ, но и при других поражениях сердца и даже внесердечных заболеваниях. Более часто это наблюдается при использовании современных высокочувствительных тест-систем.
Уровень сердечного тропонина (и других биомаркеров некроза миокарда) в крови не является основанием для принятия решения о необходимости проведения реперфузионного лечения.
Рентгенография органов грудной клетки
Всем больным ОИМпST рекомендуется рентгеновское исследование грудной клетки для выявления сопутствующих заболеваний и осложнений, которые могут повлиять на выбор лечебной тактики.
ЭХО-кардиография (ЭхоКГ).
ЭхоКГ – важнейший дополнительный метод диагностики крупноочагового ИМ, особенно в стадии развития, когда исследование биохимических маркеров некроза миокарда еще неинформативно, а ЭКГ-диагностика затруднена. Выявление локальных нарушений сократимости левого желудочка (а нередко и правого желудочка) на фоне соответствующей клинической картины – важный признак очагового поражения миокарда. Следует помнить, что локальные нарушения сократительной функции желудочков сердца могут наблюдаться и при тяжелой ишемии, не приведшей к развитию некроза, например при нестабильной стенокардии, а также в случае рубцового поражения после ранее перенесенного ИМ.
УЗИ сердца важно для распознавания таких осложнений, как тромбоз полости, разрывы сердца, нарушение функции клапанов, в частности митральная регургитация, ИМ правого желудочка, перикардит. Существенна роль УЗИ в диагностике расслоения аорты и тромбоэмболии легочной артерии.
Радионуклидные методы
Сцинтиграфия миокарда с 99mTc-пирофосфатом – дополнительный метод диагностики, который показан для верификации некроза миокарда преимущественно в тех случаях, когда имеются существенные затруднения в интерпретации изменений ЭКГ в связи с наличием блокады ножек пучка Гиса, пароксизмальных нарушений сердечного ритма или признаков перенесенного в прошлом ИМ.
Мультиспиральная компьютерная томография. Магнитно-резонансная томография
Компьютерная томография не относится к числу стандартных методов обследования в остром периоде ИМ. Однако она может оказаться весьма полезной для дифференциальной диагностики, если другие методы недостаточно информативны (расслоение аорты, ТЭЛА, пневмоторакс, плеврит и пр.).
Оценка размеров очага поражения миокарда
Современные методы оценки размеров очага поражения в клинических условиях дают лишь приблизительные результаты. Более доступна полуколичественная оценка. При ЭКГ-исследовании обращают внимание на количество отведений, в которых регистрируются признаки некроза миокарда и в какой-то степени их выраженность («глубина» зубца Q). Для той же цели используют серийное исследование биомаркеров некроза (МВ КФК) и об объеме поражений судят по максимуму содержания (активности) фермента или пользуются специальными формулами расчета по площади под кривой содержания (активности). ЭхоКГ дает косвенное представление о величине очага поражения миокарда, однако на его результат могут влиять поражения сердечной мышцы, имевшие место ранее. Более точные данные могут быть получены с помощью таких методов, как магнитно-резонансная томография и позитронно-эмиссионная томография.
Дифференциальная диагностика
ОИМпST необходимо дифференцировать от следующих заболеваний:
- заболевания пищевода (эрозии и др.)
- язвенная болезнь;
- острый холецистит, острый панкреатит и др.;
- обострение остеохондроза, межреберная невралгия;
- плексит;
- тромбоэмболия легочной артерии;
- пневмония или плеврит;
- опоясывающий герпес;
- расслаивающая аневризма аорты;
- острый перикардит;
- спонтанный пневмоторакс.
Для проведения дифференциальной диагностики важен тщательный анализ клинических проявлений, данных физического обследования, характера изменений ЭКГ. Существенную помощь могут оказать ЭхоКГ, рентгенография органов грудной клетки, лабораторные данные (уровни гемоглобина, гематокрита, лейкоцитов, биохимических маркеров некроза мио- карда). В сложных случаях требуются динамическое наблюдение за больным и применение дополнительных методов обследования.
ЛЕЧЕНИЕ
Медикаментозное лечение
Неотложная помощь:
1. Обезболивание. Обезболивание имеет первостепенное значение в связи тем, что боль вызывает симпатическую активацию, приводящую к сужению сосудов и увеличению нагрузки на сердце. Для купирования боли при ОИМ рекомендуется морфин. Морфин вводится внутривенно дробно: 10 мг (1 мл 1%-ного раствора) разводят в 10 мл физиологического раствора и вводят медленно сначала 4–8 мг, далее дополнительно по 2 мг с интервалами 5–15 минут до полного устранения болевого синдрома либо до появления побочных эффектов (тошнота и рвота, артериальная гипотония, брадикардия и подавление дыхания). Гипотонию и брадикардию купируют медленным внутривенным введением атропина: 1 мг (1 мл 0,1%-ного раствора) разводят в 10 мл физиологического раствора и вводят по 0,1–0,2 мг с интервалами 15 минут (максимальная доза – 2 мг).
При выраженном урежении дыхания рекомендуется использовать медленное внутривенное введение налоксона: 0,4 мг (1 мл раствора) разводят в 10 мл физиологического раствора и вводят по 0,1–0,2 мг с интервалами 15 минут (максимальная доза – 10 мг). Для предупреждения рвоты одновременно с морфином можно вводить противорвотные средства (метоклопрамид 5–10 мг внутривенно). Нестероидные противовоспалительные препараты не должны применяться как из-за недостаточного антиангинального эффекта, так и из-за отрицательного влияния на течение ОИМ.
2. Оксигенотерапия. Дыхание кислородом через носовые катетеры или маску со скоростью 2–8 л/мин показано при артериальной гипоксемии (насыщение крови кислородом, измеренное пульсоксиметром, менее 90%). При тяжелой сердечной недостаточности (отек легких, кардиогенный шок) для коррекции выраженной гипоксемии могут потребоваться различные способы поддержки дыхания, включая интубацию трахеи с искусственной вентиляцией легких.
3. Транквилизаторы. При выраженном возбуждении могут потребоваться транквилизаторы (например, диазепам в/в 2,5–10 мг).
Восстановление проходимости артерии, снабжающей кровью зону ИМ (реперфузионная терапия)
Реперфузионная терапия или восстановление кровотока по инфарктсвязанной коронарной артерии является основой современного лечения ОИМпST. Она может быть проведена с помощью тромболитической терапии либо путем экстренного чрескожного коронарного вмешательства (ЧКВ).
Экстренное первичное ЧКВ является наиболее эффективным методом. Оно позволяет полностью восстановить коронарный кровоток более чем в 90% случаев с низким (3%) риском повторной окклюзии. Главным недостатком метода является потеря времени на транспортировку больного. Тромболизис позволяет восстановить кровоснабжение только в 50–60% случаев, и его эффективность резко падает с течением времени по мере организации коронарного тромба. В настоящее время тромболизис рассматривается только как вынужденный способ попытки экстренного восстановления кровотока при невозможности проведения ЧКВ в течение ближайших 120 минут после постановки диагноза. При этом, чем тяжелее состояние больного, тем в большей степени ему показано ЧКВ. В первую очередь это относится к больным с кардиогенным шоком, отеком легких, угрожающими жизни аритмиями, высоким риском кровотечения.
Основные положения
- Реперфузионная терапия (первичное ЧКВ или тромболитическая терапия) показана всем пациентам с продолжительностью симптомов ОКС <12 часов при наличии стойких подъемов сегмента ST достаточной степени выраженности как минимум в двух смежных отведениях ЭКГ или вновь (предположительно) возникшей блокадой ЛНПГ.
- Реперфузионная терапия (предпочтительно первичное ЧКВ) показана при продолжающейся ишемии миокарда с соответствующими изменениями на ЭКГ продолжительностью 12–24 часа, особенно если боль и изменения на ЭКГ непостоянны (волнообразны).
- Реперфузионная терапия с помощью первичного ЧКВ вне зависимости от сроков начала ОИМпST показана больным с сохраняющимися симптомами ишемии миокарда, гемодинамической нестабильностью, угрожающими жизни аритмиями.
- Больным с сохраняющимися симптомами, возможно связанными с ишемией миокарда, но не имеющим стойких подъемов сегмента ST, срочная КАГ с намерением выполнить ЧКВ показана при полной блокаде правой ножки пучка Гиса (ПНПГ), острой СН, угрожающих жизни аритмиях или остановке сердца, стойких или возобновляющихся смещениях сегмента ST (особенно преходящих подъемах) или появлении отрицательных зубцов Т.
- Реперфузионная терапия с помощью первичного ЧКВ может рассматриваться у стабильных пациентов через 12–24 часа после начала симптомов ОИМпST, и этот срок предлагают расширить вплоть до 48 часов.
- Стабильным бессимптомным больным ЧКВ окклюзированной коронарной артерии не рекомендуется, если после начала ОИМпST прошло >48 часов.
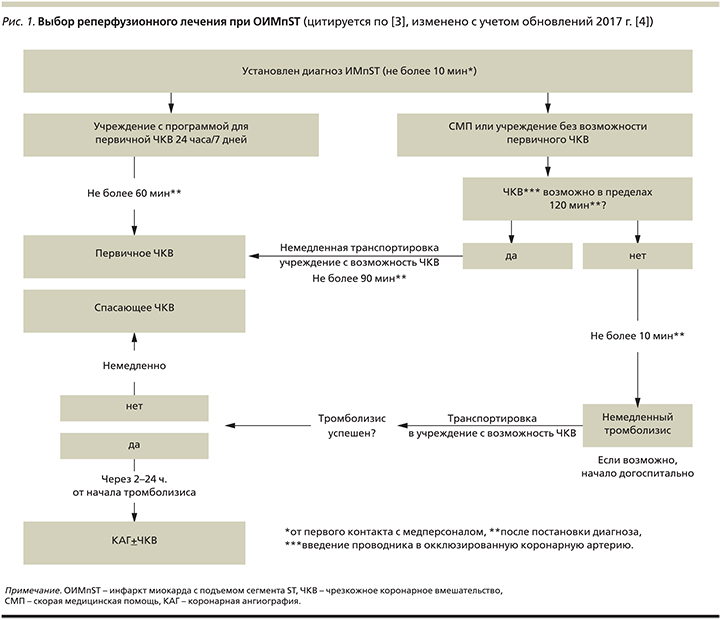
Алгоритм выбора подхода к реперфузионному лечению при ОИМпST представлен на рис. 1, временные интервалы – в табл. 1.

Тромболитическая терапия
Тромболитическая терапия – медикаментозный способ ликвидации окклюзии тромбом коронарной артерии. Она является обязательным мероприятием при ОИМпST в случаях, когда ЧКВ невозможно или противопоказано. Решающий фактор эффективности вмешательства – время начала лечения после возникновения ОКС. Если возможно, тромболизис следует начать на догоспитальном этапе. Тромболитическая терапия рекомендуется в пределах 12 часов от начала симптомов у больных без противопоказаний, если первичное ЧКВ не может быть выполнено опытной командой в пределах 120 минут после постановки диагноза ОИМпST.
Показания: боль или дискомфорт в грудной клетке, возникшие в предшествовавшие 12 часов и сочетающиеся со стойкими подъемами сегмента ST на ≥0,1 мВ в двух смежных отведениях ЭКГ (≥0,05 мВ в отведениях V7–V9; ≥0,25 мВ до 40 лет/≥0,2 у мужчин ≥40 лет или ≥0,15 мВ у женщин в отведениях V2–V3) или остро возникшей (предположительно остро возникшей) блокадой ЛНПГ.
Противопоказания к тромболизису тесно связаны с риском развития геморрагических осложнений. В зависимости от значимости их разделяют на абсолютные и относительные.
Абсолютные противопоказания:
- геморрагический инсульт или инсульт неизвестной этиологии в анамнезе;
- ишемический инсульт в предшествовавшие 6 месяцев;
- повреждение или новообразования центральной нервной системы;
- недавняя обширная травма, операция или повреждение головы (в последний месяц);
- желудочно-кишечное кровотечение в последний месяц;
- геморрагический диатез (за исключением месячных);
- расслоение стенки аорты;
- пункция органов, не поддающихся компрессии (например, биопсия печени, люмбальная пункция).
Относительные противопоказания:
- транзиторная ишемическая атака в предшествовавшие 6 месяцев;
- продолжающееся лечение пероральными антикоагулянтами;
- беременность и 1 неделя после родов;
- нарушение целостности стенки сосудов, не поддающихся прижатию;
- длительные или травматичные реанимационные мероприятия;
- рефрактерная АГ (систолическое артериальное давление [АД] более 180 мм рт.ст. и/или диастолическое АД более 110 мм рт.ст.);
- выраженное нарушение функции печени;
- инфекционный эндокардит;
- язвенная болезнь в стадии обострения.
При наличии относительных противопоказаний вопрос о целесообразности проведения тромболитической терапии решается по результатам оценки соотношения пользы и риска в каждом конкретном случае. На практике выбор фибринолитика основывается на индивидуальном соотношении пользы и риска, а также доступности и стоимости лекарственных средств.
В целом предпочтительнее применять фибринспецифичные тромболитики (тенектеплаза, альтеплаза) вместо нефибринспецифичных (стрептокиназа).
Алтеплазу в/в в максимальной дозе 100 мг вводят в течение 90 минут: первые 15 мг болюсно, затем 0,75 мг/кг (максимум 50 мг) инфузионно в течение 30 минут, затем 0,5 мг/кг (максимум 35 мг) инфузионно в течение 60 минут) или стрептокиназу в/в 1,5 млн ЕД (вводят в течение 30–60 минут), или тенектеплазу в/в 0,5 мг/кг за 5–10 секунд; могут применяться на догоспитальном этапе. При применении тенектеплазы в рамках фармакоинвазивного подхода целесообразно уменьшить дозы наполовину больным ≥75 лет.
Все фибринолитики применяют в сочетании с ацетилсалициловой кислотой, клопидогрелом и парентеральным введением антикоагулянта (эноксапарина, фондапаринукса или нефракционированного гепарина), которые должны быть начаты до или сразу после начала введения фибринолитика.
Диагностика и оценка восстановления перфузии миокарда после тромболизиса
Для диагностики состояния кровотока по коронарным артериям используют прямой (КАГ) и косвенные методы. КАГ – наиболее точный метод диагностики состояния коронарного кровотока и степени его восстановления. Важное преимущество КАГ– возможность детальной оценки коронарной анатомии и выработка оптимальной тактики последующего лечения. Очевидный минус – методическая сложность, опасность развития осложнений.
Наиболее эффективный и доступный из косвенных методов – оценка выраженности смещений сегмента ST. При восстановлении коронарного кровотока наблюдается быстрое снижение сегмента ST в отведениях, в которых он был повышен, и формирование отрицательных («коронарных») зубцов Т. Более полному и раннему восстановлению коронарного кровотока соответствует большее снижение ST. О динамике сегмента ST судят через 60–90 минут от начала тромболитической терапии.
Антитромботическая терапия при тромболизисе
Независимо от того, какой тромболитический препарат используется при лечении ОИМпST, дополнительное назначение ацетилсалициловой кислоты (нагрузочная доза – 150–300 мг внутрь с последующим приемом в дозе 75–100 мг 1 раз в сут) и клопидогрела (первая доза больным моложе 75 лет – 300 мг внутрь, в остальных случаях – 75 мг внутрь; поддерживающая доза – 75 мг внутрь 1 раз в сут) улучшает прогноз.
Тромболитические препараты должны сочетаться с парентеральным введением антикоагулянтов. При использовании стрептокиназы возможно применение фондапаринукса натрия, эноксапарина или нефракционированного гепарина (НФГ), при введении алтеплазы или тенектеплазы – эноксапарина или НФГ.
Фондапаринукс натрия или эноксапарин являются предпочтительными. Оптимальный срок их введения – вплоть до 8 сут или меньше, если в эти сроки было выполнено успешное ЧКВ (после которого парентеральное введение антикоагулянтов прекращают) или больной был рано выписан. Больным с высоким риском кровотечения, тяжелой почечной недостаточностью показана внутривенная инфузия НФГ в течение 24–48 часов (при высоком риске артериальных тромбоэмболий, тромбозе вен ног и таза или тромбоэмболии легочной артерии инфузия НФГ может быть более длительной). При высоком риске кровотечений возможен также отказ от использования парентеральных антикоагулянтов у пациентов, получивших стрептокиназу.
Дозы эноксапарина: в/в болюс 30 мг; через 15 минут п/к в дозе 1 мг/кг 2 раза/сут (первые 2 дозы для п/к введения не должны превышать 100 мг). У лиц ≥75 лет первоначальная в/в доза препарата не вводится, а поддерживающая уменьшается до 0,75 мг/кг (первые 2 дозы не должны превышать 75 мг). При сниженной функции почек (клиренс креатинина <30 мл/мин) препарат вводится п/к в дозе 1 мг/кг 1 раз/сут вне зависимости от возраста. Не рекомендуется при скорости клубочковой фильтрации <15 мл/мин/1,73 м2.
Дозы фондапаринукса натрия: в/в болюсом 2,5 мг, со 2-х суток п/к в дозе 2,5 мг 1 раз/сут. Фондапаринукс натрия противопоказан при скорости клубочковой фильтрации <20 мл/мин/1,73 м2.
Дозы НФГ: в/в болюсом 60 ЕД/кг (максимально 4000 ЕД) сразу вслед за этим постоянная инфузия 12 ЕД/кг/ч (максимально 1000 ЕД/ч), в последующем подбор дозы, обеспечивающей увеличение активированного частичного тромбопластинового времени в 1,5–2 раза выше контрольной величины для конкретной лаборатории (верхняя граница нормы или среднее нормальное значение для здоровых лиц). Этот показатель следует определить через 3, 6, 12 и 24 часа после начала инфузии НФГ.
Действия после тромболизиса
Быстрая транспортировка в центр с возможностями для первичных ЧКВ показана всем больным после начала тромболитической терапии.
Вмешательства после тромболизиса:
- ЧКВ показано немедленно после тромболизиса при его безуспешности (уменьшении степени подъема сегмента ST менее 50% к 60–90 минут);
- ЧКВ показано в случае повторной ишемии или признаков реокклюзии после начально успешного тромболизиса;
- неотложная КАГ с оценкой возможности реваскуляризации показана больным острой СН (отек легких, кардиогенный шок), угрожающими жизни аритмиями;
- КАГ с оценкой возможности реваскуляризации артерии, ответственной за ИМ, показана всем больным после успешного тромболизиса. Оптимальное время для ангиографии у стабильных больных после успешного тромболизиса – 2–24 часа от начала введения фибринолитика.
ЧКВ
Данное вмешательство – альтернатива тромболитической терапии.
ЧКВ предпочтительнее тромболитической терапии, если имеется возможность его выполнения опытной командой в течение 120 минут после постановки диагноза ОИМпST.
Проблема остаточного стеноза после тромболитической терапии является чрезвычайно важной, т.к. частота возникновения повторных окклюзий в первые 2–3 недели после успешного тромболизиса достигает 8–12%, в течение 1-го года наблюдения – 15–25%. Кроме того, оптимальный уровень коронарного кровотока к 90-й минуте тромболизиса отмечается лишь у 50–60% больных. Поэтому в последние годы широко используют инвазивные способы восстановления коронарного кровотока: баллонную ангиопластику и стентирование, объединенных общим термином «чрескожное коронарное вмешательство» (ЧКВ). Стентирование предпочтительнее баллонной ангиопластики. Современные стенты, выделяющие лекарство, предпочтительнее голометаллических стентов. Располагая современным оборудованием, полноценного восстановления коронарного кровотока с помощью ЧКВ можно достичь более, чем в 90% случаев. Кроме того, геморрагические осложнения при ЧКВ встречаются существенно реже, снижаются также частота развития повторного ИМ и смертность (по сравнению с результатами тромболитической терапии).
При планируемом первичном ЧКВ (как правило – коронарное стентирование) целесообразно безотлагательно разжевать 150–300 мг ацетилсалициловой кислоты и принять внутрь блокатор P2Y12 рецептора тромбоцитов (клопидогрел в дозе 600 мг, тикагрелор в дозе 180 мг или прасугрел в дозе 60 мг). При этом тикагрелор или прасугрел предпочтительнее клопидогрела, если нет высокого риска кровотечений или специфических противопоказаний (внутричерепное кровотечение в анамнезе для тикагрелора; внутричерепное кровотечение, инсульт или транзиторная ишемическая атака, возраст ≥75 лет, масса тела <60 кг для прасугрела). При этом следует учитывать, что убедительных данных о необходимости догоспитального приема тикагрелора нет и его использование может быть начато в стационаре (в т.ч. больными, получившими клопидогрел). Догоспитальное применение прасугрела не изучено. В целом при наличии сомнений в диагнозе, неясном риске кровотечений добавление блокатора P2Y12 рецептора тромбоцитов к ацетилсалициловой кислоте (а иногда и начало любого антитромботического лечения) разумно отложить до поступления в стационар.
Выбор антикоагулянта желательно отложить до поступления больного в ангиографическую лабораторию.
Лечение ОИМпST после реперфузионной терапии
Антитромботическая терапия
После восстановления кровотока в артерии, снабжающей кровью зону ИМ, важнейшей задачей является предупреждение повторного тромбоза. В отношении больных, не имеющих показаний к длительному использованию высоких (лечебных доз) антикоагулянтов, должна использоваться двойная антитромбоцитарная терапия – сочетание ацетилсалициловой кислоты с блокатором P2Y12 рецептора тромбоцитов (клопидогрелом, прасугрелом или тикагрелором). Ее длительность должна составлять как минимум 1 год, и можно рассмотреть отмену блокатора P2Y12 рецептора тромбоцитов через 6 месяцев, когда опасения спровоцировать тяжелое кровотечение перевешивают ожидаемые риски преждевременного прекращения двойной антитромбоцитарной терапии. После состоявшегося кровотечения или при невозможности отсрочить крупную несердечную операцию, возможность перехода на монотерапию антиагрегантом может рассматриваться и раньше – как минимум через 1 месяц после имплантации голометаллического стента и через 3 месяца после имплантации стента новой генерации, выделяющего лекарство. Вместо преждевременной отмены P2Y12 рецептора тромбоцитов при плохой переносимости тикагрелора или прасугрела можно рассмотреть переход на клопидогрел.
У отдельных больных с наиболее высоким риском осложнений атеротромбоза двойная антитромбоцитарная терапия может быть продолжена по крайней мере до 36 месяцев. К ним можно отнести больных ≥50 лет, которые перенесли ИМ и не имели кровотечений на фоне 12-месячной двойной антитромбоцитарной терапии, при наличии у них как минимум одного из факторов высокого сердечно-сосудистого риска: возраст ≥65 лет, требующий лечение СД, предшествующий спонтанный ИМ, многососудистый коронарный атеросклероз, скорость клубочковой фильтрации <60 мл/мин/1,73 м2.
Наиболее хорошо в этой ситуации изучено сочетание ацетилсалициловой кислоты и тикагрелора (через 1 год после ИМ его доза должна быть уменьшена с 90 до 60 мг 2 раза в сутки).
Ацетилсалициловую кислоту в дозе 75–100 мг 1 раз в день следует назначать пациентам и продолжать неопределенно долго при хорошей его переносимости.
Ингибиторы P2Y12 рецепторов. Клопидогрел в дозе 75 мг 1 раз в день используется в добавление к ацетилсалициловой кислоте или может служить ее заменой после отмены двойной антитромбоцитарной терапии (прежде всего при непереносимости ацетилсалициловой кислоты) или в сочетании с пероральными антикоагулянтами.
Прасугрел и тикагрелор превосходят клопидогрел в снижении сердечно-сосудистых осложнений, но и повышают риск кровотечений. Эти блокаторы P2Y12 рецептора тромбоцитов предпочтительнее клопидогрела после первичного коронарного стентирования, если нет чрезмерного риска кровотечений. Они применяются только в сочетании с ацетилсалициловой кислотой – тикагрелор в дозе 90 мг 2 раза в день (через 1 год при продлении его использования доза должна быть уменьшена до 60 мг 2 раза в день), прасугрел – в дозе 10 мг 1 раз в день.
После тромболитической терапии или у больных, оставшихся без реперфузионного лечения, есть положительные данные только о применении сочетания ацетилсалициловой кислоты с клопидогрелом. Однако если после тромболитической терапии было выполнено коронарное стентирование, через 48 часов после введения фибринолитика не исключают возможности перехода с клопидогрела на тикагрелор или прасугрел, хотя доказательства пользы подобного подхода ограничены.
Больным с низким риском кровотечений, которым с первых суток лечения было назначено сочетание ацетилсалициловой кислоты с клопидогрелом, после прекращения парентерального введения антикоагулянтов может быть добавлен прием ривароксабана в дозе 2,5 мг 2 раза в день как минимум в течение ближайшего года. Этот подход эффективнее сочетания ацетилсалициловой кислоты с клопидогрелом, но повышает частоту кровотечений.
Больным с повышенным риском желудочно-кишечных кровотечений (c язвенной болезнью желудка или 12-перстной кишки в анамнезе, язвенным кровотечением в анамнезе, одновременным использованием нестероидных противовоспалительных средств, кортикостероидов или как минимум двух из следующих факторов риска – возраст ≥65 лет, диспепсия, желудочно-пищеводный рефлюкс, инфекция Helicobacter pylori, хроническое использование алкоголя), получающих два антиагреганта, для предотвращения желудочно-кишечных кровотечений рекомендуют использовать ингибиторы протонного насоса. Аналогичное решение может быть принято и в отношении более широкого круга больных, получающих два антиагреганта, а также при использовании сочетания антиагреганта с антикоагулянтом. При тройной антитромботической терапии применение ингибиторов протонного насоса считается обязательным. Кроме того, в отношении больных с язвенным анамнезом рекомендуются активный поиск и при необходимости эрадикация Helicobacter pylori.
Ряд больных имеет показания к длительному использованию высоких (лечебных доз антикоагулянтов). Среди них – фибрилляция/трепетание предсердий, тромбоз глубоких вен/тромбоэмболия легочных артерий, образовавшийся тромб в полости ЛЖ. Соответственно, у них имеются показания к длительному применению пероральных антикоагулянтов – антагониста витамина К или прямых пероральных антикоагулянтов (при наличии неклапанной фибрилляции предсердий, после проксимального тромбоза глубоких вен ног/тромбоэмболии легочных артерий). Подходы к вторичной профилактике коронарного тромбоза у этих больных представлены на рис. 2. Для профилактики желудочных-кишечных кровотечений при тройной антитромботической терапии следует использовать ингибитор протонного насоса.

Бета-адреноблокаторы
Бета-адреноблокаторы уменьшают вероятность внезапной смерти, повторного ИМ и увеличивают продолжительность жизни больных, перенесших ИМ.
Бета-адреноблокаторы снижают частоту сердечных сокращений (ЧСС) и таким образом оказывают антиангинальное (противоишемическое) действие.
Все больные после перенесенного ИМ должны получать бета-адреноблокаторы как минимум в ближайшие 3 года и дольше (вплоть до пожизненного приема), особенно у больных с ФВ левого желудочка ≤40% или с сохранением симптоматических показаний к применению препаратов этой группы (необходимость контроля ишемии миокарда, желудочковых аритмий, необходимость поддержания нормосистолии при фибрилляции/трепетании предсердий, лечение АГ).
В крупных клинических исследованиях больных ИМ доказана эффективность метопролола и карведилола (для больных ФВ левого желудочка ≤40%). Доказательства пользы препаратов этой группы получены преимущественно до начала широкого применения реперфузионной терапии, особенно ЧКВ. В целом следует использовать препараты без внутренней симпатомиметической активности. При бронхообструкции предпочтительны кардиоселективные бета-адреноблокаторы (например, метопролол).
В отсутствие противопоказаний к гемодинамически стабильным больным бета-адреноблокаторы рекомендуется начать использовать в первые сутки ОИМ. Обычно бета-адреноблокаторы начинают титровать с невысоких доз, которые при хорошей переносимости постепенно увеличивают до целевых (табл. 2), позволяющих поддерживать ЧСС в покое у больных без выраженной СН в пределах 50–60 уд/мин.

Начало применения бета-адреноблокаторов с внутривенного введения можно рассматривать при необходимости получить быстрый симптоматический эффект (уменьшить или устранить проявления ишемии миокарда, тахиаритмию, злокачественные желудочковые аритмии, АГ) и оценить переносимость препаратов этой группы. Есть свидетельства, что внутривенное введение бета-адреноблокатора до первичного ЧКВ способно уменьшить размеры некроза миокарда, поэтому такой подход предлагают для широкого применения в отсутствие противопоказаний и СН в отношении больных с систолическим АД >120 мм рт. ст.
Если в первые сутки ОКС начать лечение бета-адреноблокаторами не удается из-за противопоказаний и/или плохой переносимости, состояние больного надо регулярно переоценивать и при исчезновении ограничивающих факторов начать подбирать дозу, соблюдая соответствующие предосторожности.
Бета-адреноблокаторы абсолютно противопоказаны при кардиогенном шоке, выраженной бронхообструкции, атриовентрикулярной блокаде 2–3-й степеней без функционирующего электрокардиостимулятора. К относительным противопоказаниям относят признаки СН (включая свидетельства низкого сердечного выброса), систолическое АД ниже 100 мм рт.ст., ЧСС меньше 60 ударов в минуту, длительность интервала PR более 0,24 секунды, наличие обструктивной болезни легких в анамнезе, а также совокупность факторов, свидетельствующих о повышенном риске кардиогенного шока у больных ИМ (возраст старше 70 лет, систолическое АД ниже 120 мм рт.ст., ЧСС более 110 или менее 60 ударов в минуту, длительное время после начала симптомов ИМ). При сохранении тахикардии после купирования болевого синдрома и возбуждения следует убедиться в отсутствии выраженного нарушения сократимости миокарда. Наличие относительных противопоказаний – основание для начала применения бета-адреноблокаторов в наиболее низких дозах, более медленного титрования доз, отказа от внутривенного введения бета-адреноблокаторов и/или отсрочки начала титрования доз до стабилизации состояния больного. Бета-адреноблокаторы не следует использовать при подозрении на вазоспастическую стенокардию.
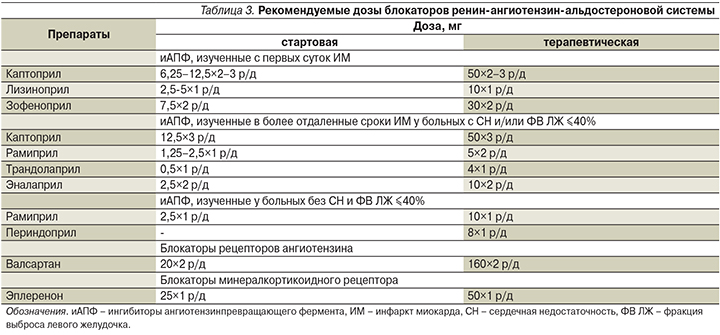
Ингибиторы ангиотензин-превращающего фермента (иАПФ) и блокаторы рецепторов ангиотензина
В клинических исследованиях с первых суток ИМ при последующей 1-месячной продолжительности лечения изучены каптоприл, лизиноприл и зофеноприл. При более избирательном подходе (больные с признаками СН и/или ФВ левого желудочка [ЛЖ] ≤40%), начале титрования дозы в ближайшие несколько дней и последующем многолетнем использовании – каптоприл, рамиприл, трандолаприл и в меньшей степени эналаприл; при длительной вторичной профилактике осложнений атеросклероза у больных, не имеющих признаков СН и известной сниженной ФВ ЛЖ, – рамиприл и периндоприл. Соответственно, есть основания использовать иАПФ у всех больных, перенесших ИМ, не имеющих противопоказаний.
В целом лечение иАПФ рекомендуется начинать в первые 24 часа ОИМпST, особенно при наличии СН, сниженной ФВ ЛЖ (≤40%), СД и(или) ИМ передней локализации. Первоначально используют низкую дозу иАПФ, которую при хорошей переносимости при каждом приеме удваивают до достижения целевой (или максимально переносимой). Противопоказания к началу титрования доз иАПФ – систолическое АД ниже 100 мм рт.ст. или его снижение более 30 мм рт.ст. от исходного, выраженная почечная недостаточность, двусторонний стеноз почечных артерий.
При непереносимости иАПФ у больных ИМ в сочетании с СН и/или ФВ ЛЖ ≤40% альтернативой могут служить блокаторы рецептора ангиотензина, предпочтительно – валсартан.
Ингибиторы минералкортикоидного рецептора
У больных ФВ ЛЖ ≤40% в сочетании с СН или СД, не имеющих существенного нарушения функции почек (уровень креатинина в крови выше 2,5 мг/дл [221 мкмоль/л] у мужчин и выше 2,0 мг/дл [177 мкмоль/л] у женщин) и гиперкалиемии (уровень калия в крови выше 5,0 ммоль/л) к терапевтическим дозам иАПФ и бета-адреноблокатора следует добавить блокатор рецепторов альдостерона, предпочтительно эплеренон. При этом наилучшие результаты достигаются, когда титрование дозы начинают в ранние сроки заболевания. Из-за опасности выраженной гиперкалиемии обязателен регулярный уровень калия в крови.
Статины
Интенсивная терапия статинами рекомендуется всем пациентам с ОИМпST в отсутствие противопоказаний. Начинать терапию следует как можно раньше и желательно с высоких доз вне зависимости от исходного уровня холестерина липопротеидов низкой плотности (например, 40–80 мг аторвастатина или 20–40 мг розувастатина). В дальнейшем доза титруется по уровню холестерина липопротеидов низкой плотности. Целевой уровень – менее 1,8 ммоль/л. При недостаточном эффекте максимально переносимой дозы статина у больных с сохраняющимся высоким риском прогрессирования атеросклероза рекомендуется добавление второго гиполипидемического лекарственного средства – эзетимиба в дозе 10 мг 1 раз в день или алирокумаба (после его регистрации по соответствующему показанию). Продолжительность терапии неопределенно длительная.
Нитраты
Нитраты назначают при наличии показаний. Их применение всеми больными ОИМпST не приводит к уменьшению частоты неблагоприятных исходов и считается нецелесообразным. Внутривенное введение нитроглицерина показано больным АГ, острой левожелудочковой недостаточностью, а также при стойкой или возобновляющейся ишемии миокарда. В отношении пациентов с ранней постинфарктной стенокардией инфузия нитроглицерина может рассматриваться только как временная мера – этим пациентам показана экстренная КАГ и реваскуляризация миокарда.
Нитроглицерин в/в инфузионно с начальной скоростью 5–10 мкг/мин в течение 24–48 часов.
При необходимости дозу нитроглицерина удваивают каждые 5–15 минут до исчезновения ишемии миокарда, получения гемодинамически значимого эффекта (уменьшение систолического АД не менее чем на 15 мм рт.ст., но не ниже 90 мм рт.ст.) или возникновения побочных реакций.
Противопоказания:
- выраженная сократительная дисфункция правого желудочка;
- гиповолемия;
- систолическое АД менее 90 мм рт.ст.;
- ЧСС менее 50/мин;
- выраженная тахикардия;
- применение ингибиторов фосфодиэстеразы V в предшествующие 48 часов.
Применение таблетированных форм нитратов в острой стадии ИМ не рекомендуется. В дальнейшем их применение может рассматриваться при сохранении ишемии миокарда, несмотря на максимально переносимые дозы бета-адреноблокаторов.
Антагонисты кальция
Антагонисты кальция не показаны к рутинному использованию при ОИМ. В дальнейшем при наличии противопоказаний к бета-адреноблокаторам верапамил (суточная доза 120–480 мг) может быть использован для вторичной профилактики ИМ больными с нормальной ФВ ЛЖ. Дигидропиридины пролонгированного действия назначаются только при наличии дополнительных показаний (АГ, стенокардия).
Препараты, не рекомендуемые к применению больными ОИМпST (Эффективность не доказана или доказан неблагоприятный эффект.)
В рандомизированных исследованиях не удалось подтвердить эффективность ряда препаратов, применявшихся ранее для лечения больных ОИМ. К этим препаратам относятся глюкозоинсулинокалиевая смесь, магнезия, профилактическая инфузия лидокаина у больных без устойчивых пароксизмов желудочковой тахикардии. Нет убедительных данных об эффективности т.н. метаболических препаратов и антиоксидантов.
Нестероидные противовоспалительные средства могут ухудшать прогноз за счет блокирования действия ацетилсалициловой кислоты и замедления рубцевания. Последнее относится и к кортикостероидам, для применения которых требуются серьезные дополнительные показания.
Пациенты, постоянно принимающие нестероидные противовоспалительные средства (кроме ацетилсалициловой кислоты), при развитии ИМ должны немедленно прекратить прием этих препаратов в связи с повышением риска смерти, повторного ИМ, гипертензии, СН и разрыва миокарда, ассоциированных с приемом препарата.
Модификация факторов риска
Включение пациента в программы вторичной профилактики приводит к улучшению приверженности лечению и позволяет снизить риск осложнений в той же степени, что и лечение в острую фазу.
Прекращение курения
У курильщиков риск развития ИМ в 2 раза выше, чем у некурящих, что указывает на выраженный протромботический эффект курения. Результаты наблюдений свидетельствуют о том, что в случае прекращения курения риск смерти в ближайшие годы снижается по крайней мере на 1/3 по сравнению с таковым у пациентов, продолжающих курить. Отказ от курения, вероятно, одна из самых эффективных мер вторичной профилактики. Необходимо прилагать все усилия, чтобы пациент бросил курить.
Идеальным является включение пациента в специальную программу отказа от курения. В каждом лечебном учреждении должен быть протокол борьбы с курением.
Лечение депрессии
После ИМ часто наблюдаются депрессия и раздражительность. Хотя лечение депрессии не снижает риска сердечно-сосудистых осложнений, оно улучшает качество жизни пациента и повышает приверженность лечению.
Контроль АД
Необходимо стремиться к поддержанию АД на уровне до 140/90 мм рт.ст., а у пациентов с СД или хронической болезнью почек до 130/90 мм рт.ст. Для этого рекомендуется проводить мероприятия по улучшению образа жизни: контроль веса, увеличение физической активности, ограничение натрия, увеличение доли сырых овощей, фруктов, продуктов с низким содержанием жиров в рационе питания, а также проведение гипотензивной терапии в соответствии с существующими клиническими рекомендациями.
Физическая активность
Польза регулярных физических нагрузок убедительно доказана в отношении больных, перенесших ОИМпST. Помимо влияния на смертность регулярные физические тренировки улучшают переносимость физических нагрузок, функцию сердечно-легочной системы и общее самочувствие пациента. Рекомендуемый минимум: умеренные физические нагрузки по 30 минут в день 5 раз в неделю.
Контроль веса
Хотя факт увеличения продолжительности жизни пациентов вследствие снижения массы тела не доказан, эта мера рекомендуется, т.к. приводит к уменьшению выраженности многих факторов риска, связанных с ожирением.
Лечение СД2
Нарушения обмена глюкозы часто наблюдаются у больных ИБС. Нарушение толерантности к глюкозе — фактор риска сердечно-сосудистых осложнений после ИМ, поэтому необходимо регулярно контролировать сахар крови. В начале медикаментозного лечения в качестве цели может быть выбрано достижение целевого уровня HbA1 7% и менее.
Здоровое питание
Всем пациентам после ИМ необходимо рекомендовать разнообразное питание, ограничение калорийности пищи, увеличение потребления фруктов и овощей, а также злаков, рыбы (особенно жирной), постного мяса и обезжиренных молочных продуктов. Следует заменять насыщенные и транс жиры мононенасыщенными и полиненасыщенными жирами (растительные жиры и морепродукты) и снизить потребление жиров менее 30%, насыщенных жиров менее 7%, транс жирных кислот менее 1% от общей калорийности пищи, холестерина менее 200 мг в день, а также уменьшить потребление соли.
Вакцинация против гриппа показана всем пациентам с ИБС, в т.ч. после ИМ.
Осложнения ОИМпST
Желудочковые аритмии
В отношении всех больных ОИМ необходимо поддерживать нормальный уровень калия и магния в крови. При пароксизмах устойчивой желудочковой тахикардии и фибрилляции желудочков требуется немедленное устранение с помощью электрического разряда, однако это не предупреждает их повторное возникновение. При возобновляющихся пароксизмах устойчивой желудочковой тахикардии или фибрилляции желудочков необходимо скорейшее устранение ишемии миокарда. Показано внутривенное введение бета-адреноблокаторов, амиодарона (300 мг или 5 мг/кг в течение 10–60 минут, затем инфузионно 900 мг/сут; суточная доза не должна превышать 2,2 г).
Брадиаритмии
Синусовая брадикардия или АВ-блокада II степени типа Мобитц-1 с артериальной гипотонией, ишемией миокарда, появлением или утяжелением СН, выскальзывающими желудочко-выми аритмиями
Атропин в/в 0,5 мг при необходимости повторно с интервалами 5–10 минут до суммарной дозы 0,04 мг/кг.
При недостаточном эффекте показана электрокардиостимуляция.
Атриовентрикулярная блокада II степени типа Мобитц-2, полная поперечная блокада
Метод выбора — электрокардиостимуляция. Профилактическая установка электрода в полость правого желудочка с присоединением электрокардиостимулятора, работающего в режиме «при необходимости» показана при возникновении двух- или трехпучковой блокады проведения.
Острая СН
Данное осложнение возникает в тех случаях, когда нагрузка на сердце превышает его способность совершать необходимую работу. Как правило, имеется прямая зависимость между обширностью ИМ и развитием острой СН. Острая СН может развиваться и при небольших поражениях миокарда, если ИМ возникает в измененной мышце сердца, обычно в связи с перенесенными в прошлом инфарктами. Нередко СН развивается на фоне гипертонического криза. Она часто сопровождает инфаркт папиллярных мышц сердца. Медикаментозное лечение острой СН при ИМ не отличается от тех принципов и схем, которые обычно используются для лечения данного состояния.
Восстановление кровотока по сосуду, снабжающему зону ИМ, повышает выживаемость больных. В тяжелых случаях существенную помощь может оказать внутриаортальная баллонная контрпульсация. В процессе лечения тяжелой СН может быть полезен инвазивный контроль за состоянием центральной гемодинамики.
Острая левожелудочковая недостаточность
Цель лечения – уменьшить давление в капиллярах легких. Основные лечебные мероприятия:
- скорейшее восстановление коронарного кровотока (тромболитическая терапия, ЧКВ);
- оксигенотерапия при насыщении крови кислородом <90%;
- при отеке легких, выраженной одышке у больных без артериальной гипотонии следует рассмотреть использование неинвазивной поддержки дыхания – дыхание под постоянным положительным давлением или двухуровневую дыхательную поддержку;
- при выраженной гипоксемии, гиперкапнии, усталости дыхательных мышц, ацидозе, непереносимости или неэффективности неинвазивной поддержки дыхания показана интубация трахеи с механической искусственной вентиляцией легких;
- внутривенное введение морфина при сохраняющейся боли, удушье;
- внутривенная инфузия нитроглицерина при систолическом АД >90 мм рт.ст.;
- внутривенное введение фуросемида в начальной дозе 20–40 мг больным с признаками задержки жидкости;
- при тяжелой СН с артериальной гипотонией, рефрактерной к стандартному лечению, внутривенная инфузия кардиотонических лекарственных средств (добутамин с начальной скоростью 2,5 мкг/кг/мин, при необходимости увеличение дозы с интервалом 5–10 минут до гемодинамического улучшения или достижения дозы 10 мкг/мин; допамин в дозе 2,5–5 мкг/кг/мин);
- в отсутствие противопоказаний начало титрования доз иАПФ, блокатора минералокортикоидного рецептора, а после стабилизации состояния – бета-адреноблокатора.
Шок
Шок – клинический синдром, при котором наряду с артериальной гипотонией (систолическое АД <90 мм рт.ст.) имеются признаки сниженной перфузии органов и тканей (бледность и похолодание кожных покровов с повышенным потоотделением, олиго-анурия, вялость и заторможенность). Основным механизмом развития кардиогенного шока при ИМ является критическое падение минутного объема сердца, которое не компенсируется повышением общего периферического сопротивления сосудов.
Причины шока при ИМ:
- значительное уменьшение функционирующего миокарда («истинный» кардиогенный шок);
- рефлекторные влияния на работу сердца и тонус периферических сосудов (рефлекторная форма);
- тахи- или брадиаритмии (аритмический шок);
- недостаточное давление заполнения камер сердца (гиповолемия).
Наличие кардиогенного шока констатируется после устранения выраженных тахи- и брадиаритмий и уверенности в достаточном давлении заполнения камер сердца.
Для устранения гиповолемии у больных без влажных хрипов в легких используют положение в кровати с приподнятыми ногами и внутривенное введение 200–250 мл 0,9%-ного раствора хлорида натрия за 5–10 минут. При сохранении артериальной гипотонии возможны повторные введения до общего объема 0,5–1,0 л. В случае появления одышки или влажных хрипов в легких введение жидкости следует прекратить.
Вазовагальная реакция (сочетание артериальной гипотонии и брадикардии) устраняется обезболиванием в сочетании с атропином (в/в 0,5 мг, при необходимости повторно с интервалами 5–10 минут до суммарной дозы 0,04 мг/кг).
Для тахиаритмии, как правило, требуется электроимпульсная терапия, для брадиаритмий – электрокардиостимуляция.
Кардиогенный шок
Фармакотерапия истинной формы кардиогенного шока менее перспективна. В принципе она должна заключаться, с одной стороны, в повышении сократительной способности сохранившегося миокарда, с другой стороны, в повышении общего периферического сопротивления.
В отсутствие функциональной активности значительной части миокарда обеспечить достаточно эффективное повышение сократительной способности сердца крайне трудно. Избыточное повышение периферического сопротивления сосудов может приводить к истощению функциональных возможностей сердечной мышцы. Вот почему при назначении средств, повышающих периферическое сопротивление сосудов, необходимы постоянный контроль и осторожность:
- Скорейшая полная реваскуляризация миокарда. Предпочтительнее инвазивные способы реваскуляризации миокарда (ЧКВ, операция коронарного шунтирования). У больных с кардиогенным шоком без механических осложнений ОИМ может быть рассмотрено выполнение тромболитической терапии, если первичное ЧКВ недоступно в пределах 120 минут после постановки диагноза ИМпST.
- Оксигенотерапия, поддержка дыхания вплоть до механической искусственной вентиляции легких.
- Ввнутривенная инфузия кардиотонических и вазопрессорных лекарственных средств (добутамин в дозе 5–15 мкг/мин; норэпинефрин в возрастающих дозах от 0,5 до 30 мкг/кг/мин).
Обычно при очень низком систолическом АД применяют норэпинефрин, при увеличении АД до 80 мм рт.ст. и выше переходят на допамин, при АД 90 мм рт.ст. и выше добавляют добутамин и стремятся уменьшить дозу допамина. Инфузию негликозидных инотропных стимуляторов прекращают, когда систолическое АД удерживается на уровне 100—110 мм рт.ст. и исчезают признаки сниженной перфузии органов и тканей.
Для поддержания АД и устранения гипоперфузии органов и тканей при кардиогенном шоке более перспективно использование немедикаментозных средств поддержки кровообращения (внутриаортальная контрпульсация, экстракорпоральная мембранная оксигенация и др.), особенно у больных с механическими осложнениями ОИМ (разрывы миокарда, тяжелая митральная регургитация).
ИМ правого желудочка
При артериальной гипотонии у больных ОИМ правого желудочка необходимо:
- обеспечить скорейшую реканализацию окклюзированной коронарной артерии;
- исключить применение вазодилататоров (нитраты, иАПФ и др.) и мочегонных препаратов;
- увеличить преднагрузку для правого желудочка (внутривенное введение 200–250 мл 0,9%-ного раствора хлорида натрия за 5–10 минут; при сохранении артериальной гипотонии возможны повторные введения до общего объема 0,5–1,0 л);
- при недостаточной эффективности этих мероприятий или появлении застоя в легких показано внутривенное введение кардиотонических лекарственных средств (добутамина, допамина) до достижения систолического АД более 90 мм рт.ст.;
- добиваться сохранения согласованности сократительной активности правых предсердия и желудочка (устранять пароксизмы наджелудочковых аритмий и при брадиаритмиях использовать последовательную атриовентрикулярную электрическую стимуляцию сердца).
Оценка эффективности лечения
Адекватное лечение уменьшает число осложнений ИМ и улучшает ближайший и отдаленный прогноз.
Наиболее важным критерием эффективности лечения является скорейшее восстановление проходимости окклюзированной коронарной артерии: чем в более ранние сроки это происходит, тем благоприятнее прогноз при ОИМпST. Неинвазивным методом подтверждения реперфузии миокарда является ЭКГ; важен также симптомный эффект – быстрое и полное обезболивание, ликвидация других острых проявлений заболевания. В последующем эффективное лечение предполагает сохранение проходимости инфаркт-связанной коронарной артерии, отсутствие ишемии миокарда, надлежащее применение лекарственных средств, положительно влияющих на прогноз.
Осложнения и побочные эффекты лечения
Осложнения, связанные с применением лекарственных средств пациентами с ОИМпST, специфики не имеют.
Ошибки и необоснованные назначения:
- отказ от проведения реперфузионной терапии;
- отказ от тромболитической терапии через 6–12 часов от появления симптомов ОИМпST, если первичное ЧКВ недоступно;
- проведение тромболитической терапии в отсутствие сохраняющихся подъемов сегмента ST или остро возникшей (предположительно остро возникшей) блокады ЛНПГ;
- выбор неоптимального способа реперфузионного лечения;
- безосновательный отказ от использования лекарственных средств с положительным влиянием на прогноз;
- ошибки в выборе доз лекарственных средств (в частности, необоснованное использование слишком низких доз);
- недооценка или переоценка имеющихся противопоказаний к использованию лекарственных средств.
ПРОГНОЗ
Прогноз при ОИМпST зависит от многих факторов, включая возраст больного, наличие СД, предшествующее состояние сердца, особенности развившегося ОИМпST, своевременность и правильность его лечения, адекватность профилактики и лечения осложнений, доступность и качество инвазивных вмешательств. В целом в отсутствие надлежащего лечения смертность от ИМ в течение 1-го месяца может достигать 30–50%, причем примерно 50% больных умирают в первые 2 часа заболевания. Адекватная терапия ОИМпST способна снизить смертность до 10% и менее.



