Введение
Хроническая обструктивная болезнь легких (ХОБЛ) – болезнь, обычно вызванная воздействием внешних аэрогенных факторов (частиц и газов), распространенность которой растет, а основные достижения по диагностике и лечению обобщены в обновленной версии глобальной инициативы GOLD 2018 г. [1]. Федеральные эксперты постоянно дорабатывают и обновляют национальные клинические рекомендации по ХОБЛ [2, 3]. Негативные тенденции в эпидемиологических показателях по ХОБЛ имеют место и в Республике Татарстан [4]. Данная публикация отражает продолжение исследований оказания помощи больным ХОБЛ в Казани, начатое в 2016 г. [5].
Целью работы стала оценка состояния больных ХОБЛ, обратившихся за амбулаторной или стационарной помощью в лечебно-профилактические учреждения Казани, распределение их по тяжести болезни и по характеру проводимой терапии.
Методы
Обследованы больные, активно обратившиеся и/или госпитализированные в медицинские учреждения Татарстана. Исследование было активным, наблюдательным, неинтервенционным. Пациенты включались в исследование по мере их обращения. Были обследованы 142 больных ХОБЛ – 140 (98,6%) мужчин и 2 (1,4%) женщины, средний возраст которых составил 64,8±0,7 (8,2) года, от 40 до 89 лет, 69,7% из них обследованы в стационаре, 30,2% – в поликлинике. В разработку не включали больных, имевших сопутствующую бронхиальную астму. Всем больным проведено физикальное обследование, опрос по стандартизированным вопросникам CAT (COPD Assessment Test) и mMRC (Modified Medical Research Council) в соответствии с последней редакцией федеральных клинических рекомендаций [5]; записана спирограмма в режимах спокойного дыхания и форсированного выдоха на приборе «Спиробанк» (MIR, Италия) с определением форсированной жизненной емкости легких (ФЖЕЛ), объема форсированного выдоха за 1-ю секунду (ОФВ1) и емкости вдоха (ЕВ); измерено насыщение крови кислородом посредством пульсоксиметрии с графической регистрацией (SaO2). В анализ были включены данные лейкоцитарной формулы, взятые из медицинской документации пациентов. Уровень терапевтического сотрудничества оценивали по методике Мориски–Грина. Согласно критериям данного теста, приверженными считаются пациенты, ответившие на нижеследующие вопросы «нет» более 3 раз (набравшие более 3 баллов) [6]. Статистическая обработка материала проведена с помощью программы SPSS-18 с расчетом частот явлений, а параметрические данные были представлены в виде средней величины, ошибки средней (M±m) и стандартного отклонения (SD). Исследование носило наблюдательный неинтервенционный характер, поэтому этической экспертизы не потребовалось.
Результаты исследования
Среди 142 больных только 41 курил в момент обследования, 97 курили в прошлом, 4 активно никогда не курили, но были пассивными курильщиками и/или имели стаж работы в условиях загрязненного воздуха; 96,5% курили сигареты, 1 пациент был «вейпером» – курил электронные сигареты. Стаж курения 95,1% пациентов составил 10 и более пачка-лет, 4% имели профессиональную вредность; 33,8% этих больных были вакцинированы от гриппа, 12% прошли пневмококковую вакцинацию. Сопутствующими заболеваниями страдали 80,0% больных: гипертоническая болезнь – 59,2%, ишемическая болезнь сердца – 40,1%, сердечная недостаточность – 36,6%, гастроэзофагальная рефлюксная болезнь – 19%, аллергические заболевания – 8,5%, сахарный диабет – 4,2%, доброкачественная гиперплазия предстательной железы – 5,6%, хроническая почечная недостаточность – 4,9%, ринит – 2,8%.
Индекс массы тела (ИМТ) в среднем составлял 26,2±0,5 (5,3) кг/м2. В соответствии с критериями Всемирной организации здравоохранения 1995 г. он был ниже нормы у 5,6% пациентов, нормальным (18,5–24,99 кг/м2) – у 43,0% и у 51,4% был выше нормы.
В соответствии с градациями GOLD [1] редкие обострения (0–1 за последний год) были у 59 (41,5%) пациентов, частые (2 обострения и более) – у 83 (58,5%). Только 23,9% больных не имели госпитализаций в течение последнего года, 33 (23,3%) попадали в стационар 3 раза и более.
В соответствии с рекомендованными GOLD и национальными клиническими рекомендациями вопросниками 10 и более баллов по шкале CAT имел 131 (92,3%) больной. Средний балл шкалы CAT составил 20,8±0,6 (7,1). Согласно шкале mMRC, 2 балла и более набрали 89,4% больных, средний балл составил 2,71±0,08 (0,95). У 93% число баллов хотя бы по одному из этих вопросников соответствовало критерию GOLD «много жалоб». Между этими двумя шкалами сопряженность, согласно критерию Пирсона, была очень высокой (χ2-критерий=81,47; d.f.=1; p<0,0001).
Лейкоцитарная формула больных характеризовалась следующими показателями: палочкоядерных нейтрофилов – 2,52±0,21 (2,54)%, сегментоядерных нейтрофилов – 63,74±0,78 (9,33)%, эозинофилов – 1,43±0,14 (1,70)%, лимфоцитов – 23,97±0,69 (8,17)%, моноцитов – 6,86±0,27 (3,16)%. Доля больных эозинофилией (5% и более) составила только 5,6%.
Результаты спирометрии: ФЖЕЛ – 73,18±1,79 (21,35)% от должных величин (ФЖЕЛ были ниже 80% от должной у 62,7% больных), ОФВ1 – 47,20±1,62 (19,28)% (ОФВ1 был ниже 80% от должного у 93,7% больных), емкость вдоха – 76,4±1,74 (20,78)% (была менее 80% от должной у 54,9% больных). Насыщение крови кислородом составило 95,6±0,24 (2,88)% (SaO2 менее 95% в покое была у 25,4%), частота сердечных сокращений (ЧСС) – 80,34±1,03 (12,26) в 1 минуту, ЧСС более 90 ударов в минуту была у 7,7%.
У 90,8% больных был кашель, у 74,6% отходила мокрота, гнойной мокрота была у 22,2%. Нарушения сна отмечали 78 (54,9%) больных ХОБЛ, 27,5% пациентов нуждались в применении бронхолитика короткого действия (БКД) в ночное время (23,9% – ипратропий/фенотерол и 3,5% – сальбутамол). В качестве главной жалобы 83,1% больных отметили одышку, 13,4% – кашель, 1 больной – нарушение сна и еще 1 – боль в грудной клетке. Тем не менее 81 (57%) больной отмечал раннее преждевременное пробуждение утром, 41,5% больных худшим временем дня назвали утренние часы после пробуждения, 11,3% – вечер, 4,9% – ночь, 3,5% – день, 38,7% не заметили различий. Лучшим временем суток больные ХОБЛ в 37,3% случаев сочли день, но чаще всего они (42,3%) не выделяли лучшего времени в течение суток. Несмотря на это, 79,6% больных сообщили, что их дневная активность была снижена болезнью, прежде всего утренними симптомами.
Опрос пациентов относительно их приверженности терапии показал, что, согласно тесту Мориски–Грина, полностью приверженными были только 27,5% больных. При этом 62,7% больных забывали принимать препараты, 53,5% не принимали их вовремя, 44,4% пропускали прием препарата, если чувствовали себя хорошо, 32,4% пропускали прием препарата, если чувствовали себя плохо после ингаляций.
При назначении лечения 72,5% больных были обучены медработником правильному использованию своего ингалятора, врачи регулярно контролировали технику ингаляций у 10,6% больных, время от времени – у 48,6% и только 1 раз за все время наблюдения – у 18,3%.
Поскольку данная работа строилась на непосредственной работе с пациентами, представилась возможность применить к ним три классификации GOLD, которые менялись в течение последних 10 лет (табл. 1).
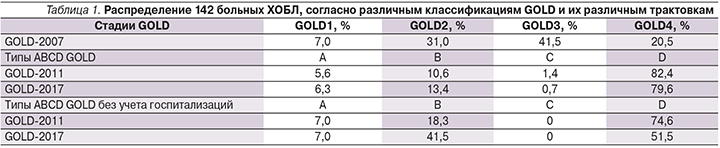
При делении больных ХОБЛ в соответствии с GOLD 2011 и 2017 гг. значительную роль играла частота обострений. Как фактор тяжести обострений был включен критерий «одна госпитализация в году», тождественная или по значимости превышающая признак «два и более обострения в году».
В России в реальной клинической практике госпитализация больных ХОБЛ может быть связана с плановым обследованием, обследованием перед медико-социальным освидетельствованием либо госпитализацией по социальным показаниям. В связи с этим мы провели дополнительно оценку типов ABCD только на основании частоты обострений без учета факторов госпитализации. При этом распределение больных по типам значительно изменилось (последние 2 строки табл. 1) с перераспределением больных из группы D в группу B.
Больные были опрошены на предмет наиболее эффективного препарата и средства доставки: 42,3% из них назвали наиболее эффективными БКД, 23,9% – комбинацию ингаляционных глюкокортикостероидов (ИГКС) с β2-адреномиметиками длительного действия (ДДБА, чаще всего будесонид/формотерол), 12,0% – только бронхолитики длительного действия, ДДБА/ДДАХ (длительно действующие антихолинергические бронхолитики) – 2,8%, по 1 (0,8%) пациенту – системные ГКС и ингибитор фосфодиэстеразы-4 рофлумиласт, 25 (17,6%) больных не смогли назвать лучшее для них лекарство. Среди торговых наименований, названных пациентами, лидировали Беродуал (ипратропий/фенотерол) – 36,6% и Форадил Комби (будесонид/формотерол) – 16,2%, Спирива (тиотропия бромид) – 9,2%.
На вопрос, какое средство доставки Вы предпочитаете при лечении, 40,1% больных назвали дозированный аэрозольный ингалятор, 19,0% – дозированный порошковый ингалятор, 6,3% – небулайзер, 4,9% – Респимат, остальные не определились с предпочтениями.
Чаще всего (52,1%) больные ХОБЛ хотели бы лечиться ситуационно, т.е. применять ингалятор только при ухудшении состояния, 41,5% больных согласились, что ингаляции 1 раз в день удобнее всего. С тем, что наиболее уверенно и комфортно они себя чувствовали при ингаляциях 2 раза в день, согласились 31,7% больных. Исходя из результатов опроса, очевидно, что часть больных согласились со всеми тремя вариантами частоты применения ингаляторов.
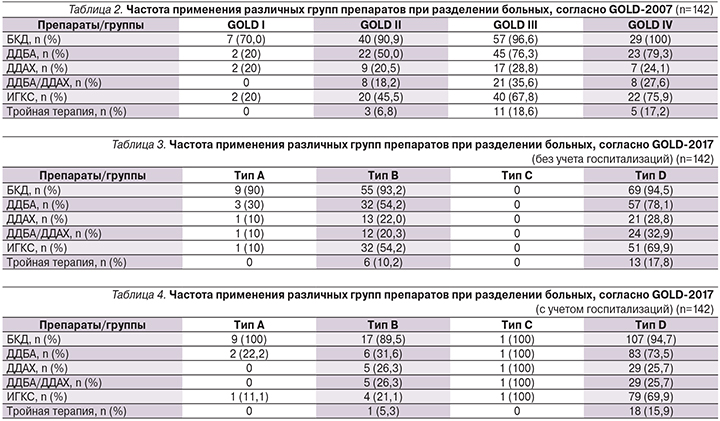
Анализ частоты применявшихся препаратов (по каждой из молекул и по лекарственным комбинациям) дал следующий результат. На момент опроса и обследований 88,7% больных постоянно получали БКД (55,6% – по льготному лекарственному обеспечению, 33,1% – покупали в аптеке), в 77,4% – это была комбинация ипратропий/фенотерол (Беродуал – 64,8%, Ипратерол – 12,7%). При суммации амбулаторного и стационарного этапов лечения в течение последнего года частота применения БКД составила 93,7%.
Бронхолитики длительного действия без ИГКС получал только 21 (14,8%) пациент. При детальном анализе по каждой молекуле установлено, что ДДХА получали 23,8% больных (тиотропий – 19,6%, гликопирроний – 4,2%), ДДБА получали 60,6% (формотерол – 45,8%, сальметерол – 12%, индакатерол – 2,1%, олодатерол – 0,7%).
Сочетание ИГКС/ДДБА получали 55,6% больных (44,3% – будесонид/формотерол и 11,3% – флутиказон/сальметерол). По торговым наименованиям: Форадил Комби – 30,3%, Симбикорт Турбухалер (будесонид/формотерол) – 14,1%, Сальмекорт (салметерол/флутиказона пропионат) – 5,6%, Серетид (салметерол/флутиказона пропионат) – 4,2%, Салтиказон-Натив (салметерол/флутиказон) – 1,4%. ИГКС без бронхолитиков никому назначены не были. В 50% случаев ИГКС/ДДБА получали по льготным рецептам, и только 4,9% покупали в аптеке.
Двойная бронходилатация длительного действия имела место у 26,4% (одновременно с ИГКС или без ИГКС): 12,7% – гликопирроний/индакатерол, 9,9% – тиотропий/формотерол, 2,4% – тиотропий/сальметерол, 0,7% –
тиотропий/олодатерол и 0,7% – гликопирроний/формотерол. Только 21 (14,8%) пациент получал двойную бронходилатацию и не получал ИГКС.
При суммации амбулаторного и стационарного этапов лечения частота применения ИГКС составила 59,2%. Среди 9 пациентов с эозинофилией периферической крови (5% и более) 5 (55,6%) получали ИГКС, без эозинофилии (менее 5%) – 79 (59,4%) больных, что указывало на то, что врачи не учитывали этот фактор при назначении ИГКС.
Тройную терапию (два бронхолитика длительного действия и ИГКС) получали 19 (13,4%) больных, среди них будесонид/формотерол/тиотропий – 9,9%, флутиказон/сальметерол/тиотропий – 2,1%, будесонид/формотерол/гликопирроний – 1,4%.
Системные ГКС на амбулаторном этапе получали только 2 (1,4%) пациента (оба по льготе), тогда как на стационарном этапе – 39,4% (преднизолон – 35,2%, дексаметазон – 4,2%). Муколитики получали только 10,6% больных, антибиотики коротким курсом – 29,6%.
Чаще всего больные ХОБЛ получали ИГКС/ДДБА регулярно и короткодействующие β2-агонисты по потребности (42,3%). Остальные препараты применялись реже. Частота применения сочетаний препаратов разных типов отражена на рисунке.

Было проведено сопоставление частоты применения разных препаратов и их сочетаний при делении больных по разным критериям GOLD (табл. 2–4).
Обсуждение
Для понимания значимости результатов работы важно отметить, что она не носила характера скрининга или раннего выявления больных ХОБЛ. Были обследованы больные, уже обратившиеся и находившиеся под наблюдением пульмонологов трех ведущих специализированных отделений Казани. Это были пациенты второй половины жизни, которые в 93% случаев имели много жалоб, в 93,7% – ОФВ1 был ниже нормальных значений и в 93,7% – они продолжали получать БКД, несмотря на различные варианты базисной терапии. Исследование выявило ряд нерешенных проблем, среди которых: низкая приверженность пациентов лечению, низкий уровень контроля техники применения различных ингаляционных устройств, назначение препаратов без учета последних рекомендаций экспертов (в частности, по эозинофилии и применению ИГКС).
Быстрое развитие учения о ХОБЛ, смена классификаций требуют постоянного совершенствования знаний и их быстрого практического применения. Переход от «спирометрической» к «клинической» классификации ХОБЛ требует дальнейшего анализа и осмысления, поскольку непосредственно влияет на выбор рекомендуемой терапии. Так, при делении по степеням нарушения функции внешнего дыхания обследованная группа была в значительной степени гетерогенной, что обосновывало, например, применение ИГКС в 62% случаев. При применении классификации 2011 г. 96,4% пациентов оказались в группе D, допускавшей применение всех существующих средств лечения ХОБЛ. При пересчете тех же больных по классификации 2017 г. доля группы D снизилась до 79,6%.
Полученные нами результаты коррелируют с подобными исследованиями, проведенными в тот же период в разных странах. Так, в Испании и США при перераспределении больных от GOLD-2015 до GOLD-2017 происходило достоверное смещение больных из групп C и D в группы A и B, т.е. существенно переоценивалась тяжесть. При этом каждый из ABCD-типов включал больных со всеми степенями снижения ОФВ1, согласно GOLD-2007 [7], т.е. жалобы и обострения были не зависимыми от объективных данных. Комментируя эти перемены в классификации, A. Kaplan, M. Thomas отметили, что новое определение ХОБЛ включает симптомы как часть диагноза. Однако раннее выявление ХОБЛ возможно на основании выявления ограничения экспираторного потока у лиц без жалоб. В частности, в Канаде применяется «Canada Lung Health Test», который включает спирометрию и позволяет рано выявлять обструкцию и своевременно назначать лечение [8]. Анализ перераспределения больных в когорте ECLIPSE в соответствии с новой классификацией, оценка стабильности групп в течение 3 лет и связь перемен со смертностью от всех причин показали, что GOLD-2017 переводит значительную часть больных GOLD-2011 C и D в группы А и B на момент включения в исследования; примерно половина больных A-, B-, D-групп оставались в той же группе к концу наблюдения, тогда как 74% больных группы C (наименьшей из групп) перемещались либо вследствие обострений, либо при усилении одышки.
В то же время смертность от всех причин достоверно не различалась при делении на группы, согласно GOLD-2011 и GOLD-2017. При этом смертность в группах B (16%) и D (18%) была сходной, с равной степенью ограничения воздушного потока и равными ведущими факторами риска смерти [9].
Вполне логично, что в отечественных рекомендациях нет градаций ABCD, иначе это внесло бы неточность в выбор лечения больных ХОБЛ. Деление ХОБЛ на типы ABCD от 2017 г. не учитывает результаты спирометрии при назначении терапии, тогда как, согласно инструкции, утвержденной Фармкомитетом России, показанием к назначению ИГКС при ХОБЛ служит снижение ОФВ1 менее 50% от должной. Согласно GOLD-2017, фенотип-ориентированная терапия назначается независимо от тяжести снижения ОФВ1, когда обострения сохраняются, несмотря на двойную бронходилатацию и применение ИГКС.
В исследовании, проведенном в Турции, среди пациентов групп C1/D1 (ОФВ1<50%д и без 2 и более обострений или госпитализаций в течение года), согласно GOLD-2011, пересчет по GOLD-2017 привел к их перемещению в A/B-группы. Больные C1/D1 имели достоверно более высокий риск будущих умеренных и тяжелых обострений, чем A/B (p=0,018). При этом риск этих обострений был достоверно выше у лиц с ОФВ1<50%д (p=0,018). Риск в группах A и B, согласно GOLD-2017, был выше, чем в аналогичных группах GOLD-2011. Было сделано заключение: низкие значения ОФВ1 служат важным фактором риска последующих обострений. Понижение стадий C1/D1 вызвано неоднородностью больных групп A/B в отношении прогнозирования обострений. Это привело к снижению дискриминационной силы GOLD-2017 в отношении риска будущих обострений в группах A и B. Авторы отметили, что это может приводить к недооценке тяжести заболевания и неадекватному лечению, особенно пациентов A/B-групп с низкой ОФВ1 [11]. Сам факт отказа от использования результатов спирометрии при создании очередной классификации GOLD удивляет. Так, в 2010 г. был проведен мета-анализ 37 исследований и было показано, что между степенью тяжести, согласно GOLD-2007, и частотой обострений установлена сильная зависимость с вероятностью 0,82 для легкой степени и 2,09 – при крайне тяжелой. Авторы рекомендовали учитывать эти данные при экономическом моделировании в здравоохранении [11]. Более того, вся доказательная база применения ИГКС и бронхолитиков базировалась на спирометрических критериях. Ключевые клинические исследования, на которых основаны принципы лечения ХОБЛ, проведены в соответствии со спирометрической классификацией тяжести заболевания, а одним из основных показателей эффективности лечения (в т.ч. самых современных проектов, включающих двойную бронходилатацию и тройную терапию) остается динамическая оценка ОФВ1 (максимального прироста и конечных значений) [12].
Тот факт, что GOLD частоту обострений учитывает наравне с госпитализациями, не соответствует реальной клинической практике в России. Госпитализация далеко не всегда служит следствием тяжелого обострения. Проведенная работа показала существенное влияние этого фактора на перераспределение больных по группам ABCD.
И наконец, оценка назначений в условиях реальной практики показала, что нарастание тяжести вентиляционной недостаточности, согласно GOLD-2007, сопровождалось таковым объема терапии, тогда как при делении, согласно GOLD-2017, этого не было. Неадекватность терапии при применении классификации GOLD-2011 была установлена в исследовании LEONPOC, проведенном в Испании, в котором было избыточное применение ИГКС в группах GOLD A и B, и отмечена необходимость приближения реальной практики к опубликованным руководствам [13].
Заключение
Проведенное исследование выявило ряд важных моментов:
- больные ХОБЛ только в 3/4 случаев бывают обучены технике ингаляционной терапии и только 1/4 больных полностью соблюдают сделанные врачом назначения;
- при назначении ИГКС врачи не учитывали наличия или отсутствия эозинофилии, но считались со степенью снижения ОФВ1;
- быстро меняющиеся классификации GOLD в течение последних 10 лет и снижение значимости спирометрических показателей не способствуют улучшению качества ведения больных ХОБЛ в условиях реальной практики.



