Фето-фетальный трансфузионный синдром (ФФТС) является одним из наиболее тяжелых осложнений монохориальной многоплодной беременности, который встречается в 10–15% случаев [1].
Причиной развития ФФТС является неравномерное распределение кровотока между близнецами за счет наличия несбалансированных анастомозов плаценты, по которым происходит сброс крови от одного плода к другому [2, 3]. Вследствие этого развивается гиповолемия плода-донора и гиперволемия плода-реципиента. Это приводит к значительным изменениям со стороны сердечно-сосудистых систем плодов [4]. В отсутствие лечения ФФТС ассоциируется с высокой, превышающей 95%, перинатальной заболеваемостью и смертностью; у детей, перенесших ФФТС, наблюдается высокая частота сердечно-сосудистых (87%), неврологических (70%) и дыхательных расстройств (92%) [5].
Своевременная диагностика и выбор оптимальной тактики лечения ФФТС являются решающими в улучшении перинатальных исходов.
В настоящее время существует несколько методов лечения ФФТС: селективный фетоцид одного из плодов, фетоскопическая лазерная коагуляция анастомозов плаценты и серийная амниоредукция.
Селективный фетоцид плода применяют при наличии аномалий развития одного из плодов, сочетании ФФТС с селективной задержкой роста одного из плодов (при дискордантности более 40% и до 22 недель беременности), при IV стадии ФФТС в случае отсутствия технической возможности выполнения лазерной коагуляции анастомозов.
Амниоредукция является паллиативным методом лечения ФФТС, который заключается в уменьшении многоводия плода-реципиента. Это способствует снижению риска преждевременных родов и, возможно, улучшению перфузии плаценты. Обычно амниоредукция применяется при I стадии ФФТС; при поздней, после 26 недель диагностике синдрома, а также при рецидиве вследствие неполной коагуляции анастомозов и отсутствия технической возможности выполнить лазерную коагуляцию.
Фетоскопическая лазерная коагуляция сосудистых анастомозов плаценты является патогенетически обоснованным методом лечения ФФТС, так как в его основе лежит устранение причины заболевания. Внедрение данного метода в клиническую практику способствовало уменьшению заболеваемости и смертности новорожденных.
Таким образом, актуальным остается изучение особенностей перинатальных исходов при монохориальной двойне, осложненной ФФТС, при различных его стадиях и методах лечения.
Целью данного исследования являлось изучение особенностей течения монохориальной многоплодной беременности, эффективности различных тактик ведения и перинатальных исходов при ФФТС.
Материалы и методы
Проведено проспективное исследование на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с 2014 по 2019 гг. Проведен анализ течения беременностей 253 пациенток с монохориальной диамниотической двойней.
Критерии включения: неосложненная беременность монохориальной диамниотической двойней и монохориальная диамниотическая двойня, осложненная ФФТС.
Критерии исключения: монохориальная моноамниотическая двойня, дихориальная диамниотическая двойня, многоплодная беременность высшего порядка (тройни, четверни), неизвестная хориальность, хромосомные аномалии у одного или обоих плодов, синдром обратной артериальной перфузии при монохориальной двойне.
Срок беременности рассчитывался от первого дня последней менструации, согласно данным ультразвукового исследования (УЗИ) – копчико-теменного размера большего плода, измеренного в 11–136 недель беременности, при наступлении беременности в результате вспомогательных репродуктивных технологий – по дате переноса эмбриона с учетом сроков культивирования.
Определение типа хориальности и амниальности при многоплодии проводилось до 14 недель беременности на основании эхографической оценки. Подтверждением монохориальной диамниотической двойни являлось наличие одного плодного яйца (одного хориона), содержащего два живых плода и два амниона (наличие Т-признака).
Диагностика ФФТС основывалась на следующих эхографических критериях: выявлении маловодия у плода-донора (максимальный вертикальный карман (МВК) менее 2 см) и многоводия у плода-реципиента (МВК более 8–10 см). Оценка степени тяжести ФФТС проводилась согласно классификации, предложенной R. Quintero et al. [6].
Все пациенты были разделены на две группы: основная включала 153 беременных монохориальной диамниотической двойней, осложненной ФФТС, и контрольная – 100 беременных с неосложненной монохориальной диамниотической двойней. В зависимости от тактики ведения беременности были сформированы три подгруппы. Выбор тактики ведения зависел от срока диагностики и/или поступления в Центр, стадии ФФТС, технической возможности выполнения оперативного лечения. В 1-ю подгруппу вошли 126 пациенток, которым проводились фетоскопия, лазерная коагуляция сосудистых анастомозов плаценты при I–IV стадиях ФФТС до 27 недель беременности; во 2-ю подгруппу – 11 пациенток, которым выполнялась серийная амниоредукция при I стадии ФФТС и при II стадии в сроке обращения после 26 недель и/или отсутствии технической возможности проведения фетоскопии; 3-ю подгруппу составили 16 беременных с ФФТС, которым внутриутробное лечение не проводилось, в связи с обращением с V стадией ФФТС и при других стадиях ФФТС в случае самопроизвольного прерывания беременности до проведения фетоскопии.
Фетоскопическая лазерная коагуляция сосудистых анастомозов плаценты проводилась трансабдоминальным доступом под местной анестезией на фоне антибиотикопрофилактики (предпочтительны цефалоспорины II–III поколения) и токолиза (выбор препаратов осуществляется индивидуально). Троакар диаметром 3,3 мм под эхографическим контролем вводился в амниотическую полость плода-реципиента, затем вводился фетоскоп с проводником лазерной энергии, бесконтактно коагулировались анастомозы. Операцию завершали амниоредукцией до достижения нормального количества околоплодных вод (МВК 4–6 см).
Серийная амниоредукция выполняется под местной анестезией с непрерывным ультразвуковым контролем. Методика операции заключается в пункции передней брюшной стенки, стенки матки иглой 18G и ее введении в амниотическую полость плода-реципиента. Околоплодные воды удаляются до достижения нормального количества (МВК менее 8 см). Появление и нарастание многоводия у реципиента являются показаниями для повторения процедуры.
Анализ течения беременности включал: выявление осложнений, данных о внутриутробной гибели одного или обоих плодов, сроков и характера родоразрешения (экстренное, плановое), показаний к родоразрешению (плодовые, материнские).
Оценка неонатальных исходов включала гестационный возраст и массо-ростовые показатели при рождении, состояние новорожденных по шкале Апгар на 1-й и 5-й минутах, продолжительность пребывания в отделении интенсивной терапии новорожденных, возникновение дыхательных расстройств, поражение центральной нервной системы (внутрижелудочковые кровоизлияния, перивентрикулярная лейкомаляция) и других систем, раннюю неонатальную смертность. Долгосрочные исходы у выписанных из стационара пациентов в ходе данного исследования не оценивались.
Статистический анализ
Для статистической обработки данных и построения графиков использовали электронные таблицы Excel (Microsoft, США) и пакет программ GraphPadPrism 8 (GraphPadSoftware, США). Для определения нормальности распределения использовали обобщенный тест Д᾽Агостино–Пирсона. Данные с нормальным распределением представлены как среднее значение (стандартное отклонение), для их сравнения использовали t-test. Данные с распределением, отличным от нормального, представлены как медиана (интерквартильный размах), для их сравнения использовали критерий Манна–Уитни. Качественные данные представлены как абсолютное значение (n) и %, для их сравнения использовали точный тест Фишера и χ2. Различия считали статистически значимыми при p<0,05. Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Результаты
Проведен проспективный анализ течения беременности 253 пациенток с монохориальной диамниотической двойней; из них 153, осложненные ФФТС, составили основную группу и 100 неосложненных беременностей – контрольную.
I стадия ФФТС была выявлена у 25 (16,3%) беременных, II – у 75 (49,1%), III – у 33 (21,6%), IV – у 12 (7,8%) и V – у 8 (5,2%).
Среди исследуемых подгрупп различались стадии ФФТС. В подгруппе лазерной коагуляции наиболее часто встречалась II стадия (49,1%), амниоредукции – I стадия, а естественного течения ФФТС – IV и V стадии (р<0,01).
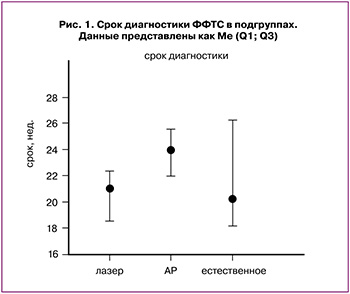 В подгруппах достоверно различался срок диагностики ФФТС: он был наибольшим в подгруппе амниоредукции – 24 недели, в то время как в 1-й и 3-й подгруппах медиана срока диагностики составила 21 и 20,3 недели соответственно, р=0,01 (рис. 1).
В подгруппах достоверно различался срок диагностики ФФТС: он был наибольшим в подгруппе амниоредукции – 24 недели, в то время как в 1-й и 3-й подгруппах медиана срока диагностики составила 21 и 20,3 недели соответственно, р=0,01 (рис. 1).
Средний возраст беременных в исследуемых группах различался статистически, он был меньше у пациенток с ФФТС – 30,2 (5,3) года, в то время как в контрольной группе составлял 33,3 (5,1) года, р<0,001. Сравнение возраста беременных в подгруппах не выявило статистически значимых различий.
Сравнение как в группах, так и подгруппах таких характеристик, как индекс массы тела беременных, паритет, соматические заболевания показало отсутствие значимых различий.
Количество беременностей, наступивших в результате применения вспомогательных репродуктивных технологий, было больше в контрольной группе, составляя 30%, в основной – 11,1%, р=0,002. В подгруппах различий выявлено не было.
Частота таких осложнений беременности, как гестационный сахарный диабет и преэклампсия, не различалась в основной и контрольной группах. В подгруппах различий также выявлено не было.
Укорочение шейки матки менее 25 мм по данным УЗИ статистически чаще встречалось у беременных с ФФТС – 35,9%; при неосложненной беременности диагностировано только в 17% случаев (р=0,001). Разницы в подгруппах обнаружено не было. Проанализировано влияние степени выраженности многоводия на укорочение шейки матки в основной группе. Установлено, что у пациенток с короткой шейкой матки МВК был статистически больше (медиана 13 см) по сравнению с теми, у кого длина шейка матки была в норме, медиана МВК – 11,5 см (р=0,04). При этом статистически значимого различия срока родов у беременных основной группы с укорочением шейки матки и без не выявлено – 31,8 (28,3;34,3) и 31,7 недели (26,5;34,6) соответственно, р=0,64.
Частота внутриутробной гибели одного из плодов преобладала в основной группе – 79 (51,6%) по сравнению с контрольной – 1(1%), р<0,001, отношение шансов 105,7 (95% доверительный интервал 18,5–1076). Сравнение частоты антенатальной гибели в подгруппах показало отсутствие статистически значимой разницы. Однако подсчет всех случаев внутриутробной гибели, т.е. количества погибших плодов к общему числу плодов в каждой подгруппе показал преобладание данного показателя при отсутствии лечения ФФТС – 53,1% (внутриутробно погибли 17 плодов из 32), в подгруппах лазерной коагуляции и амниоредукции он составлял 36,5% (92 из 252) и 22,7% (5 из 22) соответственно (р=0,047). Антенатальная гибель одного плода из двойни произошла у 28,6% (36 из 126) беременных 1-й подгруппы, у 9,1% (1 из 11) – 2-й и у 31,3% (5 из 16) – 3-й. Чаще внутриутробно погибал плод-донор – в 61,9% (26 из 42) случаев, плод-реципиент – в 38,1% (16 из 42), р=0,001. Антенатальная гибель обоих близнецов произошла в 37,5% (6 из 16) случаев в подгруппе без лечения ФФТС, у 18,2% (2 из 11) пациенток после амниоредукции и у 22,2% (28 из 126) – после лазерной коагуляции.
Исход течения беременности, осложненной ФФТС, в подгруппах оценивался на основании расчета общей (одного или обоих плодов) выживаемости. В первой подгруппе данный показатель составил 77,8%, во второй – 81,8% и в третьей – 62,5%.
Самым распространенным способом родоразрешения в изучаемой когорте было кесарево сечение – 66,8%. При этом его частота в основной (60,8%) и контрольной (76%) группах достоверно различалась, р=0,01. Сравнение частоты оперативного родоразрешения в зависимости от тактики ведения беременности, осложненной ФФТС, не выявило значимого различия, р=0,14.
Большинство беременных, 179 (70,8%) пациенток, были родоразрешены до 36 недель. Частота родоразрешения монохориальной двойни, осложненной ФФТС, до 36 недель составляла 84,9% (130 из 153), неосложненной – 49% (49 из 100), р<0,001. Сравнение частоты родоразрешения до 36 недель в подгруппах показало отсутствие значимого различия, р=0,45.

В ходе исследования было оценено влияние внутриутробной гибели плода на сроки родоразрешения выжившего близнеца. Медиана срока родов при данном осложнении была выше, чем при его отсутствии и составляла 34,7 (31;38) и 32,3 (29,2;34,4) недель соответственно, р=0,002. Сравнение срока родоразрешения при антенатальной гибели плода выявило наибольшее различие в подгруппе с естественным течением ФФТС. Беременность после антенатальной гибели одного плода пролонгировалась, и роды происходили в среднем в 37,1 (1,5) недели, в то время как при ее отсутствии – в 27,2 (1,4) недели, р<0,001. В подгруппе, где проводилась лазерная коагуляция анастомозов плаценты, родоразрешение при антенатальной гибели 1 плода также проводилось в более поздние сроки – 33,7 (4,2) недели против 32,3 (2,7) недели, когда выживали оба плода, р=0,05 (рис. 2).
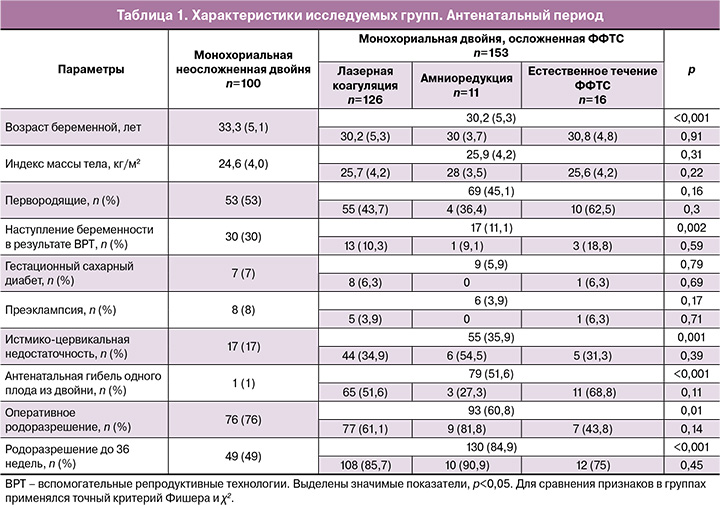
Клинические характеристики беременных и течения антенатального периода в исследуемых группах представлены в таблице 1.
Сравнение гестационного возраста новорожденных показало значительные различия в исследуемых группах. Медиана гестационного возраста монохориальной двойни, осложненной ФФТС, составила 31,8 недели, в то время как при неосложненной – 36 недель (р<0,001). В подгруппе с лазерной коагуляцией этот показатель составил 32 недели, с амниоредукцией – 29,6 недели, а при естественном течении ФФТС – 27,1 недели; при этом статистически значимой разницы выявлено не было, р=0,17 (рис. 3).
Сравнение массы тела новорожденных основной и контрольной групп показало значительно меньшие медианные значения при ФФТС (1490 г) по сравнению с неосложненной беременностью (2359 г), р<0,001. Сравнение в подгруппах не выявило статистически значимого отличия.
Оценка состояния новорожденных проводилась на основании шкалы Апгар. В каждой из групп рассчитывалось количество детей, у которых в конце 1-й минуты после рождения оценка составляла менее 6 баллов, в конце 5-й минуты – менее 7. При монохориальной двойне, осложненной ФФТС, количество детей с низкими оценками по шкале Апгар было значительно больше, чем при неосложненной – на 1-й минуте 21% и 4%, на 5-й – 16,9% и 2% соответственно, р<0,001.
Наибольшее количество новорожденных из монохориальной двойни, осложненной ФФТС, с низкими оценками по шкале Апгар было выявлено в подгруппе с естественным течением процесса (1-я минута – 46,7%, 5-я минута – 37,5%,) по сравнению с подгруппами, где проводилась лазерная коагуляция анастомозов плаценты (1-я минута – 17,8%, 5-я минута – 14,1%) и амниоредукция (1-я минута – 29,4%, 5-я минута – 23,5%), р=0,03.
Сравнение частоты осложнений раннего неонатального периода показало их преобладание в основной группе. Так, частота госпитализации в отделение реанимации и интенсивной терапии новорожденных (ОРИТН) при ФФТС значительно превосходила таковую при неосложненной двойне, 78,5% и 48,2% соответственно, р<0,001. Сравнение данного показателя в подгруппах не выявило статистически значимых различий.
Длительность пребывания новорожденных в ОРИТН была больше при ФФТС. Медиана длительности госпитализации при монохориальной двойне, осложненной ФФТС, составляла 7 дней, в то время как при неосложненном течении беременности – 4, р=0,001. Наибольший койко-день пребывания в ОРИТН наблюдался в подгруппах амниоредукции (медиана 14,5 койко-дня) и естественного течения ФФТС (10 койко-дней), а наименьший – при лазерной коагуляции анастомозов плаценты (6 койко-дней), р=0,005.
В ходе анализа неонатальной заболеваемости установлено повышение частоты неврологических осложнений у новорожденных с ФФТС – 26,2% по сравнению с группой контроля – 5%, р<0,001. Частота неврологических нарушений (внутрижелудочковые кровоизлияния, перивентрикулярная лейкомаляция) была значительно выше в подгруппах амниоредукции и естественного течения ФФТС – 47,1% и 46,7% соответственно, по сравнению с подгруппой, где выполнялась лазерная коагуляция, – 22,1%, р=0,05.
Респираторные нарушения у новорожденных были выявлены только в основной группе – 25,6% случаев: в подгруппе амниоредукции – 41,2%, естественного течения ФФТС – 60%, лазерной коагуляции – 20,9%, р=0,001.
Ретинопатия новорожденных в основной группе встречалась значительно чаще, чем в контрольной – 6,7% и 1% соответственно, р=0,003. Сравнение частоты развития ретинопатии в подгруппах показало ее преобладание в группе, где проводилась амниоредукция – 29,4%, р=0,005.
Такие осложнения неонатального периода, как некротизирующий энтероколит (НЭК) и острое почечное повреждение, отмечались только у новорожденных основной группы. НЭК статистически чаще встречался в подгруппах амниоредукции (29,4%) и естественного течения ФФТС (26,7%) по сравнению с группой лазерной коагуляции (5,5%), р=0,005. Статистически значимых различий частоты острого почечного повреждения в подгруппах не выявлено.
Случаи ранней неонатальной смертности отмечались только в группе новорожденных с ФФТС. Частота данного показателя составила 10,8% (21 случай). Анализ неонатальной летальности в подгруппах показал ее преобладание при естественном течении ФФТС – 40%, в I подгруппе она составила 8,6%, во II – 5,9%, р=0,03.
С целью подробного изучения случаев летальности были проанализированы следующие показатели: срок родов, масса тела новорожденных, стадия ФФТС, а также, кем являлся погибший ребенок – донором или реципиентом. Выявлено наличие статистической разницы в сроке родоразрешения – погибшие дети были рождены в 26,6 (24,8;28,7) недели, в то время как медиана родов при ФФТС составляла 31,8 (26,7;34,4) недели, р=0,001. Медианные значения массы тела погибших детей статистически отличались от массы тела новорожденных с ФФТС – 740 (590;985) и 1490 (950;2042) г соответственно, р<0,001. Стадии ФФТС также различались – у погибших новорожденных наиболее часто была III стадия, тогда как у выживших – II. Среди 21 погибшего новорожденного 12 являлись донорами, а 9 – реципиентами, р=0,54.
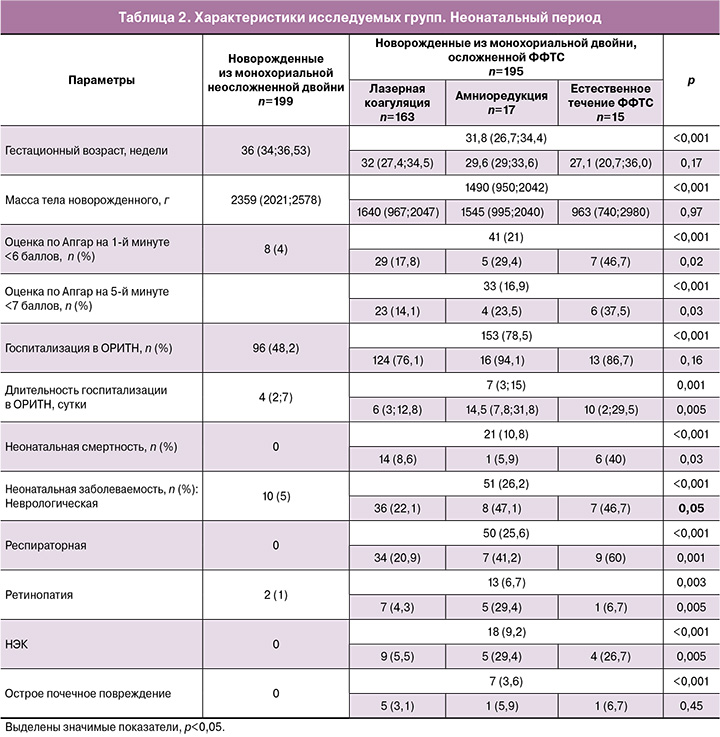
Клинические характеристики новорожденных и неонатального периода исследуемых групп представлены в таблице 2.
Обсуждение
ФФТС, являясь одним из наиболее тяжелых осложнений монохориальной многоплодной беременности, без лечения приводит к внутриутробной гибели одного или обоих плодов и/или к развитию неврологических и дыхательных нарушений новорожденных близнецов [7, 8]. В нашем исследовании частота антенатальных потерь при ФФТС составила 51,6%, в контрольной группе физиологически протекающей беременности – 1%. Неврологическая заболеваемость новорожденных при ФФТС составила 26,2%, в контрольной группе – 5%.
ФФТС является одним из основных детерминант перинатальных потерь при монохориальном многоплодии. Внедрение лазерной коагуляции сосудистых анастомозов плаценты в клиническую практику существенно изменило ход естественного течения данного заболевания [9]. По данным Diehl W. et al., перинатальная выживаемость одного и/или двух плодов при ФФТС при выполнении фетоскопии увеличилась за последние годы с 50% до 89,5% [10]. В нашем исследовании общая выживаемость плодов при выполнении лазерной коагуляции сосудистых анастомозов плаценты составила 77,8%. Полученные результаты демонстрируют высокую эффективность данного метода лечения.
Lenclen R. et al. при сравнительном анализе эффективности амниоредукции и фетоскопии пришли к выводу, что уровень перинатальной смертности (ОР 3,0; ДИ 95%; р<0,001), а также доля глубоконедоношенных новорожденных значительно выше (66,6% против 42,5%; р=0,02) в группе амниоредукции [11].
Частота антенатальной гибели одного из плодов при проведении лазерной коагуляции сосудистых анастомозов плаценты в нашем исследовании составила 36,5%, при проведении амниоредукции – 22,7%. Более низкая частота антенатальных потерь в подгруппе с амниоредукцией сопровождается более ранним родоразрешением, высокой неонатальной заболеваемостью и более длительным пребыванием новорожденных в ОРИТН.
По данным ряда авторов, выполнение амниоредукции коррелирует с более ранними сроками родоразрешения, низкой оценкой по шкале Апгар, высокой перинатальной и неонатальной смертностью, а также неврологической заболеваемостью [7, 11]. При проведении фетоскопической лазерной коагуляции авторы достоверно чаще отмечали проявления анемии и/или полицитемии у новорожденных на 1-е сутки жизни. Таким образом, выполнение амниоредукции оправдано при I стадии ФФТС, а также при его позднем дебюте. Известно, что только в 60% случаев происходит прогрессирование ФФТС, т.е. переход I стадии в последующие [12]. В связи с чем иногда достаточно выполнения 1 или 2 процедур амниоредукции для пролонгирования беременности и возможности более позднего родоразрешения. В случае дальнейшего прогрессирования ФФТС выполнение амниоредукции на ранних сроках может повлиять на эффективность лазерной коагуляции в связи с ухудшением визуализации анастомозов плаценты [12]. Амниоредукция не является методом выбора в лечении ФФТС II–IV стадии, так как установлено, что лазерная коагуляция способствует более высокой перинатальной выживаемости. В Кохрановском обзоре D. Roberts et al. (2008) показали, что выживаемость плодов при выполнении амниоредукции составляет 50%, независимо от стадии и гестационного срока дебюта заболевания [7]. Данную процедуру авторы рекомендуют выполнять в случаях, когда необходим перевод пациентки в учреждение, выполняющее лазерную коагуляцию анастомозов, при выраженном многоводии, а также укорочении шейки матки по данным цервикометрии менее 25 мм.
Закономерно, что масса тела новорожденных основной группы была значительно ниже, чем контрольной. Это обусловлено более ранними сроками родоразрешения. Недоношенность, а также заболеваемость новорожденных, обусловленная ФФТС, способствовали низкой оценке по шкале Апгар и увеличению количества койко-дней в ОРИТН.
R. Lenclen. et al. (2007) показали, что у новорожденных из группы амниоредукции наиболее часто встречались тяжелые поражения головного мозга (37,9% против 16,2%; р=0,03), такие как внутрижелудочковое кровоизлияние 3 степени, перивентрикулярная лейкомаляция [13]. Среди поражений других систем авторы отметили высокую частоту респираторного дистресс-синдрома (88,6%), почечной недостаточности (20,0%), НЭК (17,9%).
Перинатальная заболеваемость в данном исследовании выше в основной группе, за счет подгрупп II и III, и обусловлена ретинопатией, неврологическими и дыхательными нарушениями. НЭК и острое повреждение почек наблюдались только у новорожденных из II и III подгрупп. Это подтверждает необходимость проведения лечения при установлении диагноза ФФТС, высокую заболеваемость близнецов без проведенного антенатального лечения и недостаточную эффективность амниоредукции при II–IV стадиях ФФТС.
Данные, полученные в исследовании, подтверждают, что лазерная коагуляция сосудистых анастомозов плаценты является наиболее оптимальным методом лечения ФФТС II–IV стадии с лучшими показателями перинатальной заболеваемости и смертности.
Настоящее исследование демонстрирует роль ФФТС в развитии перинатальных осложнений монохориальной многоплодной беременности, что требует более пристального внимания, так как данная беременность сопровождается высоким риском внутриутробной гибели плодов, неонатальной заболеваемости и смертности.
Сильная сторона исследования – достаточная выборка из 253 беременных и 394 новорожденных. Ведение беременности, родоразрешение и выхаживание новорожденных проводились в отделениях одного учреждения – ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
Основным ограничением исследования является отсутствие данных об отдаленных последствиях для детей, перенесших ФФТС. Исследования в этом направлении должны быть продолжены с целью детального информирования будущих родителей.
Полученные результаты показывают необходимость изучения предикторов осложнений монохориального многоплодия с целью оптимизации тактики ведения пациенток, своевременной оперативной коррекции и безопасного пролонгирования беременности для снижения неонатальной заболеваемости и смертности.
Заключение
Монохориальная многоплодная беременность, осложненная ФФТС, сопровождается высоким риском перинатальных осложнений, по сравнению с неосложненной монохориальной двойней. Консервативное ведение беременности, осложненной ФФТС, и проведение серийной амниоредукции наиболее часто сопровождаются неблагоприятными исходами – антенатальной гибелью плода/плодов, ранней неонатальной смертностью, неврологическими и дыхательными нарушениями новорожденных. Лазерная коагуляция сосудистых анастомозов плаценты способствует улучшению перинатальных исходов при монохориальном многоплодии, осложненном ФФТС.



