Введение
Первичная медиастинальная (тимическая) В-клеточная лимфома (ПМВКЛ) – агрессивная неходжкинская лимфома (НХЛ), происходящая из т.н. тимических В-лимфоцитов, локализованных в мозговом слое тимуса [1, 2]. ПМВКЛ составляет 2–3% от всех НХЛ и занимает пограничное положение между диффузной крупноклеточной В-клеточной лимфомой (ДВКЛ) и классической лимфомой Ходжкина [3]. В качестве самостоятельной нозологической единицы ПМВКЛ выделена в классификации лимфоидных новообразований ВОЗ в 2001 г. [4].
ПМВКЛ встречается в основном среди молодых женщин, проявляется поражением лимфатических узлов средостения с преимущественным местнораспространенным характером роста и тенденцией к инвазии в близлежащие структуры, включая плевру, перикард и верхнюю полую вену [5]. Поражение костного мозга, а также экстранодальные очаги довольно редки и встречаются главным образом при рецидивирующем течении [6]. Ввиду редкой встречаемости, малого количества проспективных клинических исследований и неоднозначности результатов ретроспективных исследований единые стандарты терапии ПМВКЛ, в т.ч. первой линии, не определены.
Исход терапии при рефрактерном или рецидивирующем течении остается крайне неблагоприятным, поэтому выбор оптимального режима первой линии терапии особенно актуален [7].
В данном обзоре представлены основные этапы эволюции, современные стандарты, перспективы первой линии терапии с учетом патогенетических и иммунофенотипических особенностей ПМВКЛ.
Эволюция первой линии терапии ПМВКЛ
В настоящее время отсутствуют единые общепризнанные стандарты лечения ПМВКЛ, в т.ч. первой линии терапии. Это обусловлено рядом причин. Во-первых, ПМВКЛ встречается относительно редко, что значительно затрудняет проведение проспективных клинических исследований. Во-вторых, большинство имеющихся исследований ретроспективны, имеют малочисленные и разнородные клинические группы, отличаются конечными точками и противоречивыми результатами, что препятствует их комплексной оценке и мета-анализу.
В-третьих, проспективные исследования, результаты которых доступны на данный момент, в основном представляют исследования I/II фаз, благодаря которым можно говорить об эффективности исследуемых режимов, но не о признании их в качестве стандартов лечения.
Небольшое количество исследований III фазы, проводимых в основном для большинства В-клеточных лимфом (ДВКЛ, doube-/triple-hit лимфомы, ПМВКЛ), представляют терапию ПМВКЛ только в подгрупповом анализе, при этом малая выборка пациентов не позволяет полноценно оценивать эффективность исследуемого режима конкретно для ПМВКЛ.
Так как до 2001 г. ПМВКЛ была подгруппой ДВКЛ, долгое время режим СНОР (циклофосфамид, доксорубицин, винкристин, преднизолон) оставался стандартом первой линии терапии [8].
Режимы 3-го поколения
В 2002 г. более интенсивные режимы, т.н. режимы 3-го поколения М/VАСОР-В (метотрексат/этопозид, доксорубицин, циклофосфамид, винкристин, преднизон, блеомицин), показали свое преимущество по сравнению с СНОР во многих ретроспективных исследованиях. Самым масштабным было исследование итальянских ученых под руководством Р. Zinzani, включившее 426 пациентов. Прогнозируемая 10-летняя выживаемость без прогрессирования (ВБП) составила 35% в группе СНОР и 67% в группе M/VACOP-B/ProMACECytaBOM (p=0,0000), а общая выживаемость (ОВ) – 44 и 71% (p=0,0000) [9]. В последующих исследованиях, например G. Todeschini et al. (2004) [10], также было продемонстрировано значительное превосходство режимов M/VACOP-B по сравнению с СНОР и СНОР-подобными режимами. Режимы 3-го поколения с/без последующей лучевой терапии (ЛТ) стали наиболее эффективной терапевтической тактикой на тот период.
Эпоха ритуксимаба
После того как комбинированные ритуксимаб-содержащие режимы показали свое безусловное преимущество по сравнению с химиотерапией для большинства В-клеточных лимфом (ДВКЛ, фолликулярная лимфома, лимфома из клеток зоны мантии) [11–19], эффективность иммунохимиотерапии (ИХТ) стала изучаться и для ПМВКЛ.
В исследовании K. Savage et al. (2006), включившем 153 пациента с ПМВКЛ, сравнивалась эффективность терапии в группах MACOPB/VACOP, R-CHOP и CHOP. Пятилетняя ОВ у пациентов в возрасте <65 лет составила 87, 81 и 71% (р=0,048). Однако при сравнении ОВ в группах MACOPB/VACOPB и R-CHOP достоверных различий выявлено не было [20]. Была продемонстрирована сопоставимая эффективность различных по интенсивности и токсичности режимов MACOPB/VACOPB и R-CHOP.
Теоретически обоснованные предположения о более высокой эффективности режимов 3-го поколения в комбинации с ритуксимабом инициировали ряд исследований, основным из которых стал ретроспективный анализ P. Zinzani et al. (2009). Он продемонстрировал отсутствие значимых различий в достижении полного ответа и безрецидивной выживаемости (БРВ) в группах M/VACOPB и R-M/VACOPB [21]. Подгрупповой анализ исследования Mabthera International Trial Group (2011) показал, что добавление ритуксимаба к стандартной химиотерапии по схеме СНОР значительно увеличивает частоту полных ответов (от 54 до 80%; р=0,015), а также 3-летнюю БРВ (от 52 до 78%, р=0,012) в группе R-CHOP по сравнению с CHOP [22], что полностью доказало нецелесо-образность использования химиотерапии в режиме СНОР без ритуксимаба.
Окончательно уравнять в эффективности более интенсивные режимы 3-го поколения с CHOP-R и доказать необходимость ИХТ позволило исследование A. Avigdor et al. (2014). Пятилетняя ВБП пациентов, получавших R-VACOP-B, R-CHOP, VACOP-B и CHOP, составила 83, 69, 62 и 20% (p=0,039). Однако сравнение групп R-VACOP-B и R-CHOP не выявило значимых различий (p=0,3). При этом 5-летняя ВБП пациентов, получавших ритуксимаб-содержащие режимы, составила 79% и ОВ – 97% по сравнению с режимами без ритуксимаба – 58% (p=0,06) и 88% (p=0,2) [23] (рис. 1).
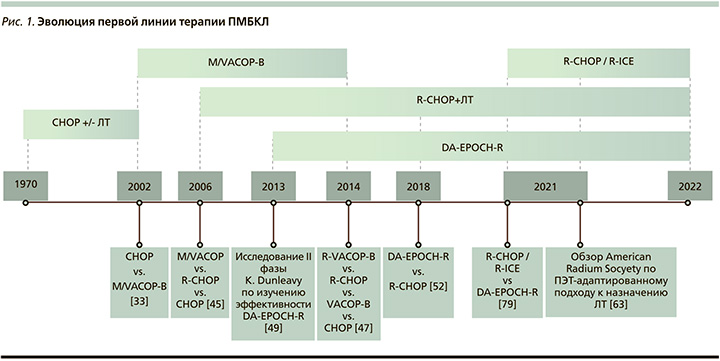
Таким образом, с учетом доказанной эффективности и меньшей токсичности по сравнению с интенсивными режимами 3-го поколения режим R-CHOP с последующей ЛТ на определенное время стал самой оптимальной терапевтической опцией для лечения ПМВКЛ в первой линии.
Однако несколько ретроспективных исследований подтверждали необходимость интенсификации терапии. По данным J. Soumerai et al., при терапии R-CHOP отмечена неприемлемо высокая частота первично-рефрактерных ПМВКЛ, особенно в группе высокого риска рецидива, по Международному прогностическому индексу (IPI) [24].
Необходимо было продолжить поиск новых подходов к терапии ПМВКЛ для уменьшения частоты первично-рефрактерных форм и отказа от облучения средостения у молодых пациентов с остаточными опухолевыми массами.
DA-EPOCH-R
Революционным в терапии ПМВКЛ стало проспективное нерандомизированное исследование II фазы National Cancer Institute под руководством
K. Dunleavy по изучению эффективности комбинированного с ритуксимабом скорректированного по дозе режима EPOCH с длительной инфузией (DA-EPOCH-R). Исследование включило 51 первичного пациента с ПМВКЛ. Пятилетняя бессобытийная выживаемость (БСВ) составила 93%, ОВ – 97%. При наблюдении от 10 месяцев до 14 лет полная ремиссия сохранялась у 49 (96%) из 51 пациента. Только 2 (4%) пациентам была проведена ЛТ при прогрессировании лимфомы с достижением длительной полной ремиссии. Для независимой оценки эффективности режима DA-EPOCH-R в рамках данного исследования Медицинским центром Стэнфордского университета проведен ретроспективный анализ 16 пациентов с ПМВКЛ. Трехлетняя БСВ составила 100%. ЛТ не проводилась ни одному пациенту. Поздние осложнения, а также кардиотоксичность зарегистрированы не были [25].
Режим DA-EPOCH-R продемонстрировал высокую эффективность без консолидирующей ЛТ и стал активно использоваться в медицинских центрах по всему миру. Однако полученные впечатляющие результаты не были подтверждены многоцентровыми рандомизированными исследованиями с большей выборкой пациентов.
Сравнение режимов DA-EPOCH-R и R-CHOP
Результаты дальнейших исследований сравнения эффективности режимов DA-EPOCH-R и R-CHOP, необходимости последующей ЛТ оказались противоречивыми.
Ретроспективное многоцентровое исследование L. Giulino‐Roth et al., включившее 156 пациентов, из которых 38 – дети, подтвердило высокую эффективность режима DA-EPOCH-R. Трехлетняя БСВ составила 85,9%, ОВ – 95,4% [26].
В 2019 г. были опубликованы результаты ретроспективного многоцентрового исследования E. Chan et al. (n=124) сравнения режимов R‐CHOP, R-CHOP+ЛТ и DA-EPOCH-R. Пятилетняя ВБП составила 56, 90 и 88,5% (р=0,02), что также подтвердило высокую эффективность режима DA-EPOCH-R без ЛТ [27].
Одним из самых масштабных стало ретроспективное многоцентровое исследование (N. Shah et al.; 2018) сравнения эффективности режимов DA-EPOCH-R (n=78) и R-CHOP (n=56). Частота полной ремиссии была выше у пациентов, получавших режим DA-EPOCH-R, по сравнению с R-CHOP (84 против 70%; р=0,046). Однако статистически значимых различий в 2-летней ВБП (р=0,28) и ОВ (р=0,83) получено не было (76 и 89% в группе R-CHOP, 85 и 91% в группе DA-EPOCH-R). Консолидирующее облучение средостения чаще проводилось после режима R‐CHOP (59 против 13%; р<0,001). У пациентов, получавших DA-EPOCH-R, была более высокая частота нейтропенической лихорадки (33 против 13%; р<0,01) и госпитализаций в связи с острой токсичностью (35 против 16%; р=0,02) [28]. Было отмечено, что режимы R-CHOP и DA-EPOCH-R в равной степени высокоэффективны.
Анализируя данное исследование, Melani C. et al. (2018) отметили различное влияние острой токсичности химиотерапии и поздних осложнений ЛТ на прогноз, чем обосновали преимущество режима DA-EPOCH-R в первой линии терапии ПМВКЛ по сравнению с R-CHOP+ЛТ. Авторы указывают, что это не одинаково опасные последствия терапии: токсичность химиотерапии временная и хорошо управляемая, в то время как осложнения после ЛТ создают постоянный риск хронической заболеваемости и преждевременной смерти [29].
N. Shah et al. (2019) согласились с мнением C. Melani et al., особенно для молодых пациенток с высоким риском поздних осложнений ЛТ, включая рак молочной железы и кардиотоксичность. Однако для пациентов с коморбидностью (например, пожилые пациенты с почечной недостаточностью, ожирением) наиболее предпочтительным следует считать режим R-CHOP с консолидирующим облучением. Также авторы отмечают значительно большую стоимость лечения по схеме DA-R-EPOCH, т.к. она требует использования колониестимулирующего фактора для профилактики нейтропении, 4 дней инфузии препаратов и большего количества госпитализаций как для самих введений, так и для купирования осложнений лечения [30].
Единственным проспективным исследованием по сравнению режимов R‐CHOP (n=250) и DA-EPOCH-R (n=241) в первой линии терапии В-клеточных НХЛ является исследование III фазы CALGB 50303. Статистически значимой разницы в 2-летней и 5-летней ВБП, ОВ, частоте ответа не было выявлено. При сравнении режимов R‐CHOP (n=20) и DA-EPOCH-R (n=15) без проведения ЛТ пациентам с ПМВКЛ (n=35) получены сопоставимые показатели ОВ и ВБП. Однако полученные результаты эффективности режимов R‐CHOP и DA-EPOCH-R ограничены небольшим набором пациентов с ПМВКЛ [31].
Таким образом, выбор оптимального режима первой линии терапии ПМВКЛ стал определяться индивидуальным профилем пациента (стадия, распространенность лимфомы, наличие сопутствующей патологии), а также возможностями и опытом лечебного учреждения.
Лучевая терапия и ПЭТ-КТ-визуализация
Лучевая терапия
Поиск эффективных программ терапии ПМВКЛ проводился путем повышения интенсивности режимов химиотерапии, добавления новых агентов (ИХТ), а также комбинации химиотерапии и ЛТ.
Роль ЛТ в лечении ПМВКЛ до сих пор остается спорной. Ряд исследований подтверждает необходимость ЛТ с целью консолидации ремиссии. По данным National Cancer Database, применение ЛТ после системной терапии значительно улучшает 5-летнюю ОВ (93 против 83%; р=0,002). Однако важным ограничением анализа является отсутствие данных об индукционных режимах химиотерапии [32]. В исследовании E. Chan et al. применение ЛТ с режимом R-CHOP продемонстрировало улучшение 5‐летней ВБП по сравнению с режимом R-CHOP и сопоставимую эффективность с режимом DA-EPOCH-R. Пятилетняя ВБП при применении режимов R‐CHOP, R-CHOP+ЛТ и DA-EPOCH-R составила 56, 90 и 88,5% (р=0,02) [27].
Другие исследования не выявили различий в выживаемости при комбинированной терапии [20, 26].
В ретроспективном исследовании M. Messmer et al. (n=43) сравнения режимов R-CHOP и R-CHOP+ЛТ частота общего ответа составила 94 и 100%, 3-летняя ВБП – 93 и 100%, ОВ – 100% [33]. Подгрупповой анализ пациентов (n=131) с ПМВКЛ в исследовании UNFOLDER German Lymphoma Alliance (2020) продемонстрировал отсутствие различий в ВБП и ОВ в группах R-CHOP и R-CHOP+ЛТ (90 и 96% против 95 и 98%; p=0,253, р=0,636) [34].
Неоднозначные результаты получены в масштабном (n=474) ретроспективном исследовании S. Jiang et al. (2019), в котором 45,8% пациентов получали ЛТ. В однофакторном анализе ЛТ коррелировала с прогнозом у пациентов в возрасте 40–59 лет (34,2% от общего числа пациентов), в то время как у пациентов в возрасте 18–39 лет (65,8% от общего числа пациентов) ЛТ не оказывала существенного влияния на прогноз [35].
Для снижения риска поздних осложнений ЛТ (сердечно-сосудистая и легочная токсичность, вторичные злокачественные новообразования, наиболее часто рак молочной железы) [36–38] и определения показаний к назначению ЛТ стал активно изучаться ПЭТ-адаптированный подход.
ПЭТ-адаптированная ЛТ
ПЭТ-КТ позволяет различать активную опухолевую ткань и остаточную фиброзную массу в средостении и используется для оценки раннего ответа после ИХТ ПМВКЛ [39]. В исследовании A. Hayden et al. (2020) по изучению ПЭТ-адаптированной ЛТ после режима R-CHOP 5-летняя ВПБ и ОВ для всей когорты пациентов (n=159) составила 80 и 89%. При ПЭТ(-)-ответе (63% от 113 пациентов) отмечено улучшение 5-летней ВБП и ОВ по сравнению с ПЭТ(+)-ответом: 90 и 97% против 71 и 88% (р=0,0002). Также была отмечена значимая разница в 5-летней ВБП при ПЭТ-ответе 4 и 5 по Deauville – 87 и 33% (р=0,0002). Такие различия исследователи объясняют не только эффектом ЛТ, но и возможным ПЭТ-ложноположительным ответом. Это исследование продемонстрировало, что ПЭТ-адаптированный подход позволяет снижать применение ЛТ для большинства (63%) пациентов без ухудшения результатов лечения [40].
Авторы систематического обзора American Radium Society (2021) клинических исследований ПЭТ-адаптированной терапии ПМВКЛ предлагают определять дальнейшую тактику ведения после индукционной лекарственной терапии в зависимости от метаболического ответа опухоли [41]. При ПЭТ(-)-ответе (1–3 по Deauville) после режима DA-EPOCH-R отказ от проведения ЛТ не влияет на показатели выживаемости [26, 42, 43]. При использовании менее интенсивных режимов, например R-CHOP, ЛТ должна проводиться независимо от ПЭТ-ответа [44-47]. В случае ПЭТ-ответа 4 по Deauville тактика неоднозначная.
Общая частота рецидивов составила 18% (в общей сложности у 9 из 50 пациентов) в трех исследованиях [26, 42, 43]. Это позволяет предположить, что частичный ответ может быть вызван воспалительной реакцией после ИХТ, что приводит к высокой частоте ложноположительных результатов. При этом одни исследователи предлагают проводить консолидирующую ЛТ из-за более высокой частоты рецидивов по сравнению с ПЭТ(-)- ответом, другие – активное наблюдение с выполнением ПЭТ и/или биопсии перед дальнейшим этапом лечения [48].
Наконец, ПЭТ-ответ 5 по Deauville может включать частичный ответ, стабилизацию и прогрессирование заболевания. Например, в исследовании T. Vassilakopoulos et al. сообщается о 15 пациентах с ПЭТ-ответом 5 по Deauville после терапии R-CHOP. Трем пациентам с подозрением на прогрессирование проведена терапия второй линии, остальным 12 – консолидирующая ЛТ, в результате у 5 из 12 пациентов развился рецидив [46]. Поэтому у данной когорты пациентов в зависимости от того, является ли результат лечения частичным ответом, стабилизацией или рецидивом заболевания, целесообразно рассмотреть ЛТ, химиотерапию второй линии, ингибиторы иммунных контрольных точек или высокодозную химиотерапию с аутологичной трансплантацией гемопоэтических стволовых кроветворных клеток в качестве последующей терапевтической опции [41].
Такой подход – ПЭТ-КТ в конце лечения – позволяет взвесить соотношение эффекта и рисков, определить показания к ЛТ и избежать ее необоснованного назначения, избегая нежелательных побочных эффектов, а также вовремя диагностировать первично-рефрактерное и прогрессирующее заболевание и назначить соответствующее лечение. Однако следует учитывать, что ПЭТ-КТ в конце лечения в большинстве исследований имеет высокую отрицательную прогностическую ценность, но низкую положительную прогностическую ценность, что при условии отсутствия результатов проспективных клинических исследований существенно ограничивает его применение в качестве дифференциально-диагностического метода для определения дальнейшей тактики лечения.
Альтернативные опции
Кроме режимов R-CHOP с консолидирующей ЛТ и DA-EPOCH-R существует альтернативные подходы, доказавшие эффективность в ретроспективных исследованиях, но требующие подтверждения в рандомизированных проспективных исследованиях для включения в терапевтические стандарты.
R-CHOP/R-ICE
С целью исключения необходимости облучения средостения после режима R-CHOP изучалась эффективность последовательного применения режимов (4 курса) R-CHOP и (3 курса) R-ICE (ифосфамид, карбоплатин, этопозид) с целью консолидации.
В исследовании C. Moskowitz et al. 3-летняя БПВ и ОВ составили 78 и 88% [49]. Сходные результаты получены в израильском исследовании под руководством N. Goldschmidt (2016): 5-летняя ВБП и ОВ составила 87 и 100%. При сравнении данного режима с другими авторы отмечают значительно меньшую продолжительность госпитализации, а также отсутствие необходимости в консолидирующей ЛТ [50]. Наиболее актуально двухцентровое ретроспективное исследование Y. Morgenstern et al. (2021), сравнившее эффективность последовательного режима R-CHOP/R-ICE (n=25) и DA-EPOCH‐R (n=31) – стандарта терапии первой линии ПМВКЛ. Были продемонстрированы сопоставимые результаты: ВБП (2,1 против 2,4 года; p=0,7667), ОВ (2,5 против 2,7 года; p=0,8047), частота полного ответа (80%). Однако применение режима DA‐EPOCH-R было связано с более длительной госпитализацией (29 против 9 дней, p<0,001) и более частыми осложнениями: частота нейтропении составила 97 против 64% (p=0,003). Инфекционные осложнения, стоматит, тромботические осложнения и количество госпитализаций, связанных с фебрильной нейтропенией, не достигли статистических различий [51]. С учетом баланса между эффективностью и токсичностью, а также возможности отказаться от облучения средостения режим R‐CHOP/R-ICE можно рассматривать в качестве альтернативой DA-EPOCH-R опции терапии первой линии ПМВКЛ [52].
Консолидирующая высокодозная химиотерапия с трансплантацией аутологичных стволовых кроветворных клеток (ВДХТ с аутоТГСК)
По причине того, что ПМВКЛ долгое время являлась подгруппой ДВКЛ и относилась к высокоагрессивным лимфомам, предпринимались попытки улучшить отдаленные результаты лечения. Одним из вариантов консолидации ремиссии стала высокодозная химиотерапия с трансплантацией аутологичных стволовых кроветворных клеток (ВДХТ с аутоТГСК). Исследование L. Sehn et al. (1998) подтверждает, что ВДХТ с аутоТГСК в первой линии терапии ПМВКЛ ассоциируется с улучшением ВБП по сравнению с первично-рефрактерной формой или рецидивом [53]. Однако ценность данного исследования невелика из-за недостатка данных о режимах индукционной химиотерапии, а также отсутствия в режимах терапии ритуксимаба.
J. Rodriguez et al. (2008) также продемонстрировали высокие показатели ОВ при проведении ВДХТ с последующей ауто-ТГСК в первой линии терапии ПМВКЛ [54].
В эпоху ритуксимаба в 2017 г. китайские исследователи представили сравнительный анализ результатов режимов R-CHOP с консолидирующей ЛТ, R-CHOP и R-CHOP с консолидирующей ВДХТ. Показатели выживаемости в группах R-CHOP+ЛТ и R-CHOP не имели статистически значимой разницы (5-летняя ВБП: 65 против 62%, p=0,068; ОВ: 67 против 57%, p=0,053). В группе R-CHOP+ ВДХТ с ауто-ТГСК отмечены наиболее высокие показатели 5-летней ВБП и ОВ (94 и 100%) [55].
В исследовании I. Avivi et al. (2018) по изучению роли консолидирующей ВДХТ с ауто-ТГСК 3-летние показатели частоты рецидивов, ВБП и ОВ составили 6, 94 и 100% при достижении ремиссии после индукционной терапии; 31, 64 и 85% для химиочувствительных рецидивов или первично-рефрактерной ПМВКЛ; 52, 39 и 41% для химиорефрактерной ПМВКЛ [56].
Несмотря на благоприятное влияние на прогноз консолидации ВДХТ с ауто-ТГСК при достижении ремиссии или химиочувствительной ПМВКЛ, применение ВДХТ с ауто-ТГСК в первой линии ограниченно в связи с отсутствием проспективных исследований, необходимых для подтверждения полученных результатов.
Современные стандарты
Согласно рекомендациям NCCN (2022), оптимальная терапевтическая тактика в первой линии терапии ПМВКЛ наиболее неопределенная и противоречивая по сравнению с другими типами лимфом [52]. В качестве начальной терапии в равной степени рассматриваются режимы: 6 курсов DA-EPOCH-R или 4 курса R-CHOP-14, или 6 курсов R-CHOP-21.
При ПЭТ(-)-ответе (1–3 по Deauville) тактика определяется в зависимости от предшествующего режима терапии. После 6 курсов DA-EPOCH-R рекомендуется наблюдение, после 6 курсов R-CHOP – наблюдение или ЛТ (наиболее предпочтительна), после 4 курсов R-CHOP – консолидация 3 курсами ICE±R (рис. 2).
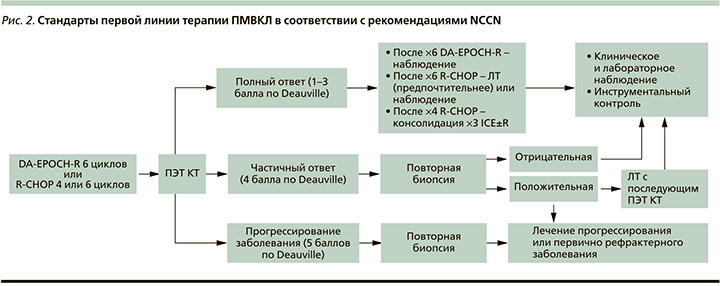
При частичном ответе (4 по Deauville) предлагается повторная биопсия. При отрицательном результате биопсии (отсутствие активной опухолевой ткани) рекомендуется клиническое и инструментальное наблюдение. При выявлении активной опухолевой ткани по данным биопсии возможны два терапевтических подхода: ЛТ с повторной ПЭТ-визуализацией и последующим активным наблюдением или терапия второй линии для рецидивов и рефрактерной формы лимфомы. В случае прогрессирования (5 по Deauville) ПМВКЛ, подтвержденного повторной биопсией, проводится терапия второй линии [52].
В отечественных рекомендациях (2020) в качестве терапии первой линии рассматриваются режимы DA-EPOCH-R, R-MACOP-B, R-CHOP. В нескольких международных и отечественных исследованиях продемонстрированы преимущества в ОВ и ВБП при использовании режимов DA-EPOCH-R и R-MACOP-B по сравнению с R-CHOP. Пациентам с исходным массивным поражением средостения после индукционной терапии рекомендуется проведение консолидирующей дистанционной ЛТ на средостение в СОД 30 Гр, РОД 1,8–2,0 Гр, а при сохранении остаточной опухоли в средостении (63%) с добавлением «буста» в СОД 6(63%) 10 Гр на остаточную опухоль [57].
Перспективы развития
Эффективность режимов терапии первой линии ПМВКЛ продемонстрирована в ретроспективных исследованиях, однако остается необходимость подтверждения полученных результатов в проспективных клинических исследованиях, результаты которых помогут окончательно утвердить ту или иную опцию в качестве доказанного стандарта.
Роль ЛТ при ПЭТ(-)-ответе после ИХТ
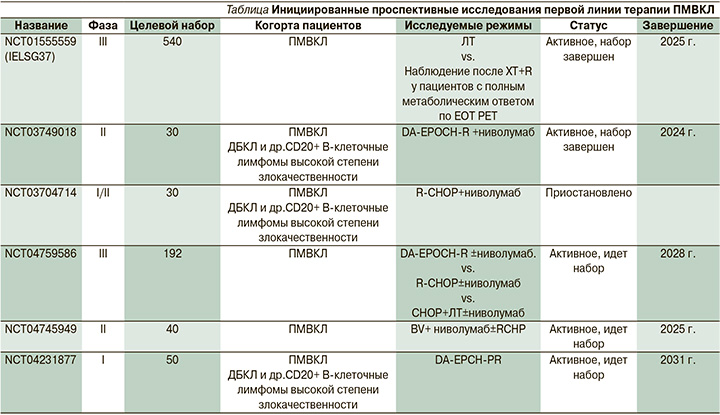
Наиболее неоднозначным остается вопрос о целесообразности облучения средостения и использования ПЭТ-адаптированного подхода для оценки эффективности терапии и определения показаний к последующей ЛТ. Для его решения в 2012 г. инициировано большое (n=540) рандомизированное (III фаза) многоцентровое сравнительное исследование (IELSG37) роли ЛТ после ритуксимаб-содержащих режимов химиотерапии пациентов с ПМВКЛ. При ПЭТ(-)-ответе после ИХТ (1–3 по Deauville) проводится ЛТ или активное наблюдение. Ожидается, что ВБП при наблюдении будет не хуже ВБП после облучения средостения в СОД 30 Гр. Также ожидается, что результаты IELSG37-исследования позволят отказаться от необоснованного облучения средостения при ПЭТ(-)-ответе после ИХТ без ухудшения результатов лечения [NCT01599559] (см. таблицу).
Ингибиторы иммунных контрольных точек
В последнее время активно изучаются молекулярные механизмы взаимодействия опухоли и иммунного микроокружения в качестве терапевтических мишеней.
Инициировано несколько проспективных исследований ингибиторов иммунных контрольных точек в монорежиме или в комбинации с существующими стандартными режимами в терапии первой линии ПМВКЛ.
Ниволумаб – человеческое моноклональное антитело IgG4, ингибитор PD-1, проходит клинические исследования по безопасности и эффективности в комбинации с режимами DA-EPOCH-R [NCT03749018], CHOP-R [NCT03704714] при лечении пациентов с агрессивными В-клеточными лимфомами (ДВКЛ, ПМВКЛ, doube-/triple-hit).
Также в 2021 г. инициировано масштабное (n=192) исследование III фазы по изучению эффективности ниволумаба в терапии первой линии в комбинации с режимами DA-EPOCH-R±ниволумаб, R-CHOP±ниволумаб, R-CHOP+ЛТ±ниволумаб [NCT04759586].
Брентуксимаб ведотин
Еще одной терапевтической мишенью является CD30, экспрессируемый клетками ПМВКЛ в большинстве (80%) случаев [58, 59]. В 2021 г. опубликованы результаты многоцентрового исследования (I/II фазы) брентуксимаба ведотина (BV) в комбинации с режимом R-CHP (ритуксимаб, циклофосфамид, доксорубицин, преднизон) для лечения пациентов с CD30+В-клеточными лимфомами (22 пациента с ПМВКЛ, 5 с ДВКЛ и 2 с лимфомой серой зоны). У пациентов с ПМВКЛ 2-летняя ВБП составила 86%, ОВ – 100% [60]. Результаты данного исследования способствовали активному изучению BV в терапии ПМВКЛ, в т.ч. в первой линии терапии. В 2021 г.
инициировано исследование II фазы PACIFIC по изучению эффективности BV в комбинации с ниволумабом и в комбинации с режимом R-CHP [NCT04745949].
Полатузумаб ведотин
Высокоэффективным в лечении ПМВКЛ в первой линии может быть еще один иммуноконъюгат – полатузумаб ведотин (анти СD79a+MMAE).
В 2020 г. инициировано пилотное исследование безопасности и переносимости полатузумаба ведотина в комбинации с режимом DA-EPCH-PR (ритуксимаб, этопозид, циклофосфамид и доксорубицин с корректировкой дозы) при первичном лечении агрессивных В-клеточных неходжкинских лимфом, в т.ч. ПМВКЛ [NCT04231877].
Заключение
ПМВКЛ – агрессивная неходжкинская лимфома, которая представляет отдельную нозологическую единицу и имеет специфические иммунофенотипические и патогенетические особенности. Результаты лечения ПМВКЛ значительно улучшились в эпоху ритуксимаба. Однако не существует единого мнения относительно стандартов терапии первой линии и роли ЛТ.
Первая линия терапии представлена двумя основными режимами – R-CHOP и DA-EPOCH-R, доказавшими свою эффективность в ретроспективных исследованиях.
Преимущество одного режима перед другим не было доказано в рандомизированных клинических исследованиях. Однако с учетом агрессивного течения ПМВКЛ и неудовлетворительных результатов лечения рецидивов заболевания более интенсивные подходы к терапии остаются наиболее предпочтительными.
С этой целью после индукционной терапии R-CHOP следует консолидация ЛТ или альтернативными режимами (R-ICE), в то время как режим DA-EPOCH-R не требует последующего консолидирующего облучения средостения. После окончания лекарственного лечения с целью дифференцировки остаточной опухолевой ткани от фиброзных и воспалительных изменений в средостении и определения показаний к последующей ЛТ выполняется ПЭТ-КТ. С учетом высокой частоты ПЭТ-ложноположительных ответов при ПМВКЛ ПЭТ-КТ используется для определения показаний к последующей ЛТ только при полном и частичном метаболическом ответе.
Ожидается, что инициированные проспективные клинические исследования помогут определять обоснованность консолидирующей ЛТ после ритуксимаб-содержащих режимов при полном метаболическом ответе, целесообразность применения ПЭТ-КТ после ИХТ в качестве дифференциально-диагностического метода, преимущество режима R-CHOP или DA-EPOCH-R в первой линии терапии, а также необходимость применения иммуноконъюгатов, ингибиторов иммунных контрольных точек в комбинации со стандартной терапией с целью улучшения отдаленных результатов лечения.
На данный момент терапия ПМВКЛ в первой линии имеет ограниченное количество эффективных опций.
В отсутствие результатов рандомизированных исследований выбор первой линии терапии зависит от индивидуальных характеристик пациента, таких как соматический статус и стадия заболевания, а также от опыта и возможностей медицинского центра, осуществляющего лечение.



