Вирусная инфекция играет важную роль в развитии патологических состояний у беременных, плодов и новорожденных [1, 2]. Актуальность проблемы вирусных инфекций в перинатальной медицине возросла в связи с социальными изменениями в жизни общества, способствующими повышению риска инфицирования женщин в период беременности, особенно при инфицировании вирусом иммунодефицита человека (ВИЧ) [3, 4]. По данным различных авторов [5, 6], вирусные инфекции могут приводить как к нарушениям развития и потере беременности, так и к рождению детей с различными осложнениями.
В основе диагностики ВИЧ-инфекции лежит выявление тропных к CCR5 (R5-тропные) штаммов ВИЧ-1. В большинстве случаев, преимущественно на поздних стадиях заболевания, определяются также тропные к CXCR4 (X4-тропные) штаммы или к CCR5 и CXCR4 одновременно (R5X4-тропные) [7, 8].
Основной проблемой при хронических вирусных инфекциях (в том числе ВИЧ-инфекции) считается развитие поражений фетоплацентарного комплекса, которые до настоящего времени, к сожалению, изучены недостаточно [9, 10].
Целью исследования стали клинический анализ течения и исходов беременности и оценка состояния плаценты у ВИЧ-инфицированных беременных.
Материал и методы исследования
Ретроспективно проведен анализ 29 беременных женщин. Основную группу составили 14 беременных, у которых имелось антенатальное инфицирование ВИЧ. Контрольную группу составили 15 женщин с физиологическим течением беременности. Средний возраст пациенток в основной группе составил 28,0±2,6 года, в контрольной группе – 21,1±2,3 года.
Проводился анализ гинекологического анамнеза, течения беременности и родов, а также перинатальных исходов новорожденных. Синдром задержки роста плода диагностировали при выявлении дефицита массы тела у плода более 10 перцентиля номограммы (по данным антенатального ультразвукового исследования). Заключение о форме и степени синдрома задержки роста плода осуществляли на основании рекомендаций Всемирного общества специалистов по ультразвуковой диагностике в акушерстве и гинекологии (ISUOG) [11, 12].
Изучение плаценты включало в себя макроскопическое и гистологическое исследования в соответствии с общепринятыми рекомендациями [13, 14]. Для микроскопического исследования из парацентральной зоны плаценты вырезали фрагменты ткани, которые фиксировали в 10% растворе нейтрального формалина. Гистологическое исследование проводили на парафиновых срезах, окрашенных гематоксилином и эозином. Иммуногистохимическое исследование проводили на парафиновых срезах толщиной 3 мкм с использованием автоматизированной системы окрашивания «BenchMark XT» (Ventana Medical Systems, «Roshe») и моноклональных кроличьих антител к CCR5 (клон Е164) в разведении 1:100 производства фирмы Epitomics. Количественную оценку уровня экспрессии маркера проводили в синцитиотрофобласте и эндотелии капилляров ворсин плаценты при помощи системы анализа изображения на базе микроскопа «Nicon Eclipse 80i» с использованием программы «Nis Elements 3.2». Статистическую оценку количественных данных проводили с использованием программного пакета Statistica 8.0.
Результаты исследования и их обсуждение
Гинекологический анамнез беременных в основной группе был отягощен инфекциями, передающимися половым путем (уреамикоплазменная, папилломавирусная инфекция, хламидиоз, герпетическая, цитомегаловирусная инфекция), хроническими воспалительными заболеваниями органов малого таза, нарушениями менструального цикла и патологией шейки матки в 12 (85,7%) случаях. В контрольной группе указанных процессов не выявлено. Первобеременных в основной группе было 3 (21,4%), а прерывание беременности до 12 недель в анамнезе – у 11 (78,6%) женщин. В контрольной группе у всех женщин отсутствовали прерывания беременности на ранних и поздних сроках. Первобеременные составляли 10 (66,7%) женщин, своевременные роды в анамнезе были у 5 (33,3%) женщин.
У 4 (28,6%) беременных основной группы выявлено сочетание ВИЧ-инфекции с хроническим вирусным гепатитом С в неактивной форме.
При анализе основной группы обращает на себя внимание поздняя явка на учет по беременности в подавляющем большинстве наблюдений – 8 (57,1%) беременных встали на учет после 20 недели, с 12-й по 20-ю неделю – 4 (28,6%) женщины.
Во II триместре беременности наиболее частыми осложнениями в основной группе являлись анемия и угроза преждевременных родов. Так, анемия легкой степени диагностирована у 10 (71,4%) женщин, умеренная преэклампсия – у 2 (14,3%), угроза преждевременных родов – у 3 (21,4%), острое респираторное заболевание (ОРЗ) – у 4 (28,6%), обострение цистита – у 1 (7,1%). В контрольной группе у 2 (13,3%) беременных выявлена анемия легкой степени в III триместре.
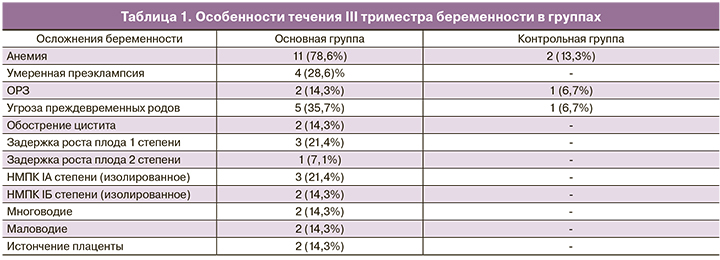
Среди проявлений плацентарной дисфункции в основной группе выявлены различные изменения количества околоплодных вод – умеренное маловодие в 3 (21,4%) случаях, умеренное многоводие – у 1 (7,1%). Изолированное нарушение маточно-плацентарного кровотока (НМПК) отмечено у 2 (14,3%), изолированное нарушение кровотока в сосудах пуповины – у 1 (7,1%), истончение плаценты для данного срока гестации – в 14,3% случаях. Указанных изменений у беременных контрольной группы не выявлено. Основными осложнениями в III триместре, как в основной, так и контрольной группах, были: угроза преждевременных родов, анемия, ОРЗ (табл. 1).
 Характеристика лабораторных показателей в группе с ВИЧ-инфекцией представлена в табл. 2.
Характеристика лабораторных показателей в группе с ВИЧ-инфекцией представлена в табл. 2.
При анализе осложнений родов у беременных с ВИЧ-инфекцией в 5 (35,7%) наблюдениях отмечено несвоевременное излитие околоплодных вод. Различные осложнения родов основной группы представлены в табл. 3. В контрольной группе родоразрешение осуществилось на доношенном сроке естественным путем, без осложнений.
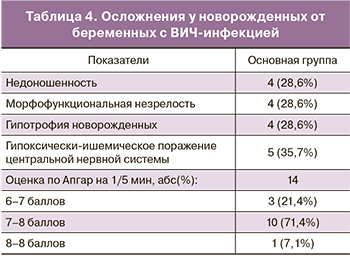
Средний вес новорожденных в основной группе составил 2900±158,1 г, в контрольной группе – 3450±115,2 г. Все новорожденные контрольной группы родились с оценкой по шкале Апгар на 1/5 мин 9/9 баллов. При анализе перинатальных исходов у новорожденных, рожденных от ВИЧ-инфицированных матерей выявлена недоношенность, морфофункциональная незрелость, гипотрофия новорожденных, гипоксически-ишемическое поражение центральной нервной системы. Перинатальные исходы и осложнения у новорожденных основной группы представлены в табл. 4.
С целью профилактики вертикальной передачи инфекции у всех женщин основной группы применяли различные препараты, используемые в качестве антиретровирусной терапии (калетра, эпивир, комбивир, ретровир). Эти препараты не оказывали прямого воздействия на процесс фиброзирования в печени.
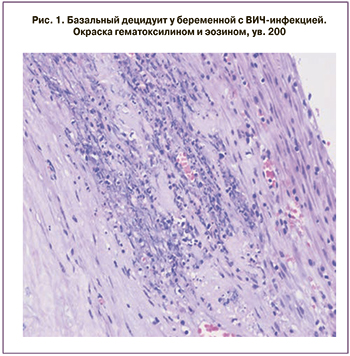
 При морфологическом исследовании препаратов плаценты основной группы нами выявлены признаки развития воспаления и гипоксии. Так, признаки хориоамнионита установлены в 3 (21,4%) наблюдениях. Васкулит сосудов хориальной пластинки диагностирован в 2 (14,3%) случаях, фунизит – в 3 (21,4%). У 11 (78,6%) беременных отмечались признаки острого диффузного базального децидуита (рис. 1).
При морфологическом исследовании препаратов плаценты основной группы нами выявлены признаки развития воспаления и гипоксии. Так, признаки хориоамнионита установлены в 3 (21,4%) наблюдениях. Васкулит сосудов хориальной пластинки диагностирован в 2 (14,3%) случаях, фунизит – в 3 (21,4%). У 11 (78,6%) беременных отмечались признаки острого диффузного базального децидуита (рис. 1).
В 8 (57,1%) наблюдениях основной группы отмечалось соответствие степени зрелости ворсинкового дерева сроку беременности, в 2 (14,3%) – отставание созревания и в 4 (28,6%) – ускоренное созревание ворсинкового дерева. Признаки хронической маточно-плацентарной гипоксии в виде многочисленных мелких терминальных ворсин с множеством синцитиальных узелков определялись у 6 (42,9%) пациенток. В 2 (14,3%) случаях наблюдались крупные и мелкие инфаркты ворсинкового дерева и многочисленные скопления бессосудистых ворсин, а у 3 (21,4%) родильниц – расширение и множественные тромбы межворсинкового пространства. В контрольной группе в 12 (80%) наблюдениях выявлено соответствие степени зрелости ворсинчатого дерева сроку беременности и в 3 (20%) – ускоренное созревание ворсинчатого дерева.
 Известно, что в воспалительных процессах при ВИЧ-инфицировании задействованы не только рецепторы (CD4), но и корецепторы. Одним из основных таких корецепторов считается CCR5 (C-C chemokine receptor type 5, C-C-рецептор хемокина 5).
Известно, что в воспалительных процессах при ВИЧ-инфицировании задействованы не только рецепторы (CD4), но и корецепторы. Одним из основных таких корецепторов считается CCR5 (C-C chemokine receptor type 5, C-C-рецептор хемокина 5).
CCR5 является членом подкласса рецепторов β-хемокинов, сопряженным с G-белком. Именно взаимодействие ВИЧ с CD4-рецептором и корецептором лежит в основе проникновения вируса в клетку и, соответственно, развития заболевания [10, 15]. В свою очередь, люди, имеющие гомозиготную мутацию CCR5-Δ32, невосприимчивы к ВИЧ-1 [16].
В результате проведенного нами иммуногистохимического анализа положительная реакция с антителами CCR5 установлена в синцитиотрофобласте, клетках стромы и эндотелиоцитах капилляров ворсин (рис. 2). При этом уровни экспрессии ССR5 рецепторов в плацентах группы ВИЧ-инфицированных женщин были значимо выше по сравнению с показателями контрольной группы (p<0,05): в синцитиотрофобласте – в 2,07 раза, в эндотелиоцитах капилляров ворсин – в 1,93 раза.
Полученные нами данные об особенностях поражения плаценты согласуются с данными литературы о развитии неспецифических инволютивно-дистрофических изменений и циркуляторных расстройств во всех последах у ВИЧ-инфицированных беременных с развитием различной степени выраженности хронической плацентарной недостаточности [17, 18]. Известно, что существует прямая корреляция между увеличением риска передачи ВИЧ и частотой развития хориамнионита, плацентарной недостаточности, а также преждевременной отслойки плаценты и маточного кровотечения [19].
При гистологическом исследовании препаратов плаценты А.Н. Рымашевский с соавт. [20] отмечали выраженную коллагенизацию стромы стволовых ворсин, склероз стенок сосудов с пролиферацией эндотелиоцитов, а также наличие участков обызвествления и отложения фибриноидов.

Примечательно, что у ВИЧ-инфицированных родильниц выявлено увеличение содержания коллагена IV типа в стенке сосудов стволовых ворсин и в составе синцитиокапиллярных мембран терминальных ворсин хориона [18], а также наличие большого количества так называемых афункциональных участков [20].
Согласно данным S. Bustamante с соавт. [21], положительная экспрессии рецепторов CCR5 и CXCR4 характерна для клеток трофобласта, стромы и эндотелия ворсин зрелой плаценты. При этом в большем количестве клеток трофобласта отмечается преимущественно внутриклеточная, а не мембранная локализация CCR5 и CXCR4 [22].
В то же время по данным литературы [23], клетки Кащенко-Гофбауэра, являющиеся плацентарными макрофагами, характеризуются более низкими уровнями экспрессии СD4 и ССR5, по сравнению с макрофагами других органов. Подобная метаболическая особенность плацентарных макрофагов лежит, по мнению А.В. Колобова [24], в основе их врожденной резистентности к ВИЧ-инфицированию.
Установлено, что более высокое содержание CCR5 в структурах плаценты увеличивает риск развития ВИЧ-инфекции [25]. А среди ВИЧ-инфицированных матерей более высокая вирусная нагрузка наблюдалась у женщин с высоким уровнем плацентарной экспрессии CCR5 [26].
Согласно проведенным нами исследованиям, у ВИЧ-инфицированных родильниц отмечается более высокий уровень иммуногистохимической экспрессии CCR5 в ткани плаценты. Причем более выраженная разница с показателями контрольной группы характерна для клеток синцитиотрофобласта ворсин, что, видимо, обусловлено их локализацией. Синцитиотрофобласт является первым барьером ворсин плаценты, соприкасающимся с циркулирующей материнской кровью. В этой связи важным механизмом антенатальной вертикальной передачи ВИЧ от беременной к плоду является, на наш взгляд, не только высокая экспрессия CCR5, но и повреждение синцитиотрофобласта, облегчающее проникновение вируса в кровоток плода.
Другим существенным звеном патогенеза диссоциированного созревания ворсин хориона и хронической плацентарной недостаточности у ВИЧ-инфицированных беременных является нарушение баланса между проангиогенными и противоангиогенными факторами в структурах плаценты. По данным Д.А. Ниаури с соавт. [27], в плацентах ВИЧ-инфицированных беременных отмечается преобладание экспрессии антиангиогенных факторов, в частности, TGF-β1. При этом дисбаланс между факторами, способствующими и препятствующими ангиогенезу, рассматривается в настоящее время в качестве ведущего механизма патогенеза преэклампсии [28, 29].
Следует также добавить, что ВИЧ-инфекция, способствующая формированию плацентарной недостаточности, вызывает также нарушения внутриутробного развития плода и снижение способности к адаптации после рождения [30].
Заключение
Таким образом, у ВИЧ-инфицированных женщин установлены более высокие уровни экспрессии CCR5 рецептора в ворсинах хориона и различной степени выраженности повреждения последа, лежащие в основе хронической плацентарной недостаточности. Клинические осложнения течения беременности и родов включали анемию (в 78,6%), плацентарную недостаточность (42,9%), угрозу преждевременных родов (35,7%), умеренную преэклампсию (28,6%), дискоординацию родовой деятельности (14,3%), указывающие на необходимость динамического наблюдения за ВИЧ-инфицированными беременными.
Во всех случаях обнаружения инфицирования у новорожденных не наблюдали каких-либо ультразвуковых маркеров внутриутробной инфекции. Данное обстоятельство требует квалифицированного консультирования с привлечением инфекциониста. Ранняя явка на учет по беременности (до 12 недель), своевременное назначение противовирусной терапии в зависимости от вирусной нагрузки, стадии ВИЧ-инфекции, а также эхографических маркеров внутриутробной инфекции и плацентарной недостаточности, начиная с ранних сроков снижает риск осложнений. Позднее начало антиретровирусной терапии в основной группе из-за поздней первой явки на учет по беременности явилось фактором, повышающим риск инфицирования ВИЧ у плода и новорожденного.



