Термин «аденомиоз» используется для обозначения формы эндометриоза, морфологическим проявлением которого является распространение компонентов железистого и стромального слоя эндометрия в миометрий [1]. Последние годы ознаменованы интересом исследователей к проблеме аденомиоза; причем этот интерес носит как исследовательский характер, а именно установление этиологии и патогенеза заболевания, так и чисто практический – определение возможного влияния аденомиоза на репродукцию женщины: бесплодие, невынашивание беременности, неудачи экстракорпорального оплодотворения (ЭКО) [2–5]. Следует заметить, что исследователи находятся только в начале пути, и четких представлений о том, что же такое аденомиоз и как он влияет на репродуктивную функцию женщины, сегодня мы не имеем [6–8].
Несмотря на достаточно длительное применение методов вспомогательных репродуктивных технологий для лечения различных форм бесплодия и несомненные успехи этого направления, частота наступления беременности на попытку ЭКО находится на одном уровне – приблизительно 30% беременностей на цикл лечения [9]. Естественно, что усилия специалистов направлены на выявление и устранение причин, которые могут негативно повлиять на эффективность программ ЭКО. В ряду этих причин немаловажное значение имеют состояние матки и ее способность имплантировать плодное яйцо и вынашивать беременность [10, 11]. Влияние аденомиоза на репродуктивную функцию женщины является неизученным вопросом, особенно если это касается начальных форм аденомиоза [12, 13]. Ряд специалистов указывают на то, что у 40–45% женщин с необъяснимым первичным бесплодием и у 50–58% – с вторичным бесплодием неясного генеза диагностируется аденомиоз. Другие связывают привычные выкидыши у 15,3% женщин с эндометриоидным поражением матки, но являются ли эти данные объективными или же следствием гипердиагностики патологии, вопрос весьма дискуссионный [2–4, 6].
Известно, что наличие аденомиоза связано с более низкими показателями успешной имплантации и повышенным риском потери беременности на ранних сроках [14–16].
Тем не менее вопросы связи аденомиоза и бесплодия являются нерешенными. Это провоцирует новые проблемы, диктующие использование различных способов лечения аденомиоза, и как самостоятельной терапии, и в плане подготовки к программам ЭКО. Но до настоящего времени не определены методы подготовки пациенток, нет сообщений о влиянии подготовительной терапии на исходы программ ЭКО [6–8].
В этой связи целью исследования явились проведение подготовительного лечения перед программами ЭКО и оценка его эффективности у пациенток при различных стадиях аденомиоза.
Материалы и методы
В отделении сохранения и восстановления репродуктивной функции были обследованы 198 пациенток с аденомиозом, согласно приказу Минздрава Российской Федерации 107н от 30 августа 2012 г. в период с марта 2018 г. по январь 2020 г. Из них были выделены 128 женщин, составивших группу исследования, которым проводилось лечение аденомиоза в течение 3 месяцев: агонисты гонадотропин-рилизинг-гормона (аГнРГ), комбинированные оральные контрацептивы (КОК) и диеногест в непрерывном режиме как подготовительная терапия перед программой ЭКО. Группу сравнения составили 70 пациенток репрезентативного возраста с наличием аденомиоза, у которых ранее проводилась программа ЭКО без предварительного подготовительного лечения.
Возраст женщин колебался от 22 до 38 лет, медиана составила 34,5 (28; 35) года. Все пациентки имели в анамнезе 3 и более неэффективные попытки ЭКО. Критерии включения в исследование: репродуктивный возраст (22–38 лет); сохраненные параметры овариального резерва; признаки аденомиоза по результатам ультразвукового исследования (УЗИ); 3 и более неэффективные попытки ЭКО в анамнезе; возможность проведения оплодотворения методом ЭКО или интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ) по результатам исследования спермограмм супругов.
Критерии исключения: регламентируемые приказом 107н Минздрава РФ от 30 августа 2012 г.; поздний репродуктивный возраст и резко сниженные показатели овариального резерва; тяжелые формы патозооспермии у супруга.
После окончания лечения оценены: переносимость препарата, клинико-лабораторные характеристики, состояние матки в зависимости от стадии эндометриоза по результатам УЗИ, частота наступления беременности.
Для диагностики стадии аденомиоза использовали эхографические признаки, представленные в работе [17], и классификацию аденомиоза тех же авторов.
Стадия I диффузного аденомиза:
- наличие в толще эндометрия тонких поперечных анэхогенных полосок, идущих от базального слоя к середине М-эхо, а также анэхогенных включений (кист) в миометрии и на границе эндометрия и миометрия;
- повышенная гиперэхогенность миометрия различной толщины; наличие анэхогенных включений в миометрии;
- неравномерность толщины базального слоя эндометрия и «изъеденность» контуров эндометрия по базальной пластинке, что выглядит как гипоэхогенный дефект эндометрия; миометрий за базальной пластинкой не изменен;
- матка обычно имеет нормальные размеры, но может обнаруживаться разная толщина передней и задней стенок матки;
- появление зон пониженной эхогенности в эндометрии и небольших гиперэхогенных образований в толще миометрия рядом с эндометрием.
Стадия II диффузного аденомиоза:
- увеличение толщины матки, превышающее верхнюю границу нормы;
- утолщение одной из стенок матки по сравнению с другой на 4 мм и более;
- появление в миометрии, расположенном ближе к полости матки, зон с участками неоднородной (повышенной и пониженной) эхогенности различной величины;
- наличие внутри зоны повышенной эхогенности небольшого округлого анэхогенного образования диаметром 2–5 мм;
- появление анэхогенных полостей различной формы и размера, содержащих мелкодисперсную взвесь (кровь), а иногда и плотные включения небольшой эхогенности (сгустки крови);
- толщина эндометрия обычно снижена и не соответствует дню менструального цикла (за счет сдавления эндометрия измененным миометрием);
- появление в месте расположения патологического образования частой поперечной исчерченности со средней и низкой эхогенностью;
- эффект ослабления ультразвуковой волны за патологическим образованием.
Стадия III диффузного аденомиоза:
- значительное увеличение матки, в основном переднезаднего размера;
- утолщение одной из стенок матки по сравнению с другой на 10 мм и более;
- наличие в миометрии зоны повышенной неоднородной эхогенности, занимающей более половины толщины стенки матки;
- выявление в области переднего фронта сканирования зоны повышенной эхогенности и анэхогенной – в области дальнего фронта.
В исследовании использовали клинические, лабораторные и инструментальные методы обследования. Программы ЭКО в «длинном» протоколе с аГнРГ и в протоколе с антагонистом ГнРГ проводили по общим правилам, определяя дозу гонадотропинов в зависимости от показателей овариального резерва. В качестве триггера финального созревания ооцитов использовали человеческий хорионический гонадотропин в дозе 10 000 ЕД.
Статистический анализ
Для статистической обработки использовали статистический пакет IBM SPSS Statistics v22 (IBM Corp., США).
Все полученные количественные параметры были проверены на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Числовые параметры, имеющие нормальное распределение, представлены в формате М (SD), где М – среднее значение, SD – стандартное отклонение среднего значения. Параметры, имеющие распределение, отличное от нормального, представлены в формате Мe (Q25%; Q75%), где Мe – медиана, а Q25% и Q75% – верхний и нижний квартили.
Качественные показатели представлены как в абсолютных, так и в относительных величинах (%). Для нахождения различий между группами пациентов для нормально распределенных числовых показателей использовали критерий ANOVA (для нескольких групп при равенстве дисперсий) и затем применяли попарное сравнение групп с помощью t-критерия Стьюдента для двух независимых выборок с поправкой Бонферрони на непрерывность. В случае неподтверждения гипотезы о нормальном распределении для сравнения количественных данных применяли непараметрические методы Краскела–Уоллиса (для нескольких групп) и затем осуществляли попарное сравнение групп с помощью U-критерия Манна–Уитни для несвязанных совокупностей. При множественных сравнениях применяли поправку Бонферрони.
Для определения различий в числовых показателях, изменявшихся в ходе лечения, применяли парный критерий Стьюдента для двух зависимых выборок, при отсутствии нормального распределения использовали непараметрический метод – Т-критерий Вилкоксона.
Для сравнения дихотомических показателей между независимыми выборками использовали метод χ2 с поправкой Йейтса на непрерывность, точный критерий Фишера для небольших выборок. При невозможности применения критерия χ2 использовался Z-критерий (аналог t-критерия Стьюдента для долей), а для 0% и 100% – с поправкой для концевых точек.
Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты и обсуждение
Многочисленными работами показано, что УЗИ является на сегодня наиболее достоверным диагностическим методом выявления аденомиоза [17, 18]. УЗИ проводилось дважды: на 5–7-й и 19–22-й день менструального цикла. Были обнаружены признаки, присущие аденомиозу у всех исследуемых пациенток.
Эти признаки были представлены следующими изменениями матки: увеличением матки в основном за счет переднезаднего размера и асимметричным утолщением одной из стенок – у 128/128 (100%) женщин; зонами повышенной эхогенности круглой или овальной формы в миометрии, анэхогенными участками или кистозными полостями, содержащими мелкодисперсную взвесь – у 108/128 (84,4%) женщин; нечетким контуром полости матки (неравномерностью толщины базального слоя эндометрия, его зазубренностью) – у 65/128 (50,8%); зонами повышенной эхогенности в миометрии, дающими линейные акустические тени – у 49/128 (38,3%); гиперэхогенными линейными структурами на границе эндометрия и миометрия – у 37/128 (28,9%).
I стадия распространения в группе исследования была зафиксирована у 50/128 (39,1%) пациенток, II стадию распространения имели 52/128 (40,6%) пациенток, III стадию – 26/128 (20,3%) пациенток. Пациенты группы исследования (128 женщин) были произвольно разделены на 3 подгруппы:
A. 38 пациенток, получивших 3 инъекции депо формы аГнРГ (трипторелин в дозе 3,75 мг);
B. 45 женщин, получивших КОК, содержащий этинилэстрадиол 30 мкг и диеногест 2 мг. Препарат назначали в непрерывном режиме в течение 3 месяцев;
C. 45 женщин, получивших диеногест 2 мг в сутки, в непрерывном режиме в течение 3 месяцев.
Группа сравнения (70 пациенток) также была распределена по стадиям распространения аденомиоза: I стадия в группе сравнения была зафиксирована у 30/70 (42,9%) пациенток, II стадию распространения имели 22/70 (31,4%) пациенток, III стадию – 18/70 (25,7%) пациенток.
Распределение больных по стадиям патологического процесса статистически значимо не различалось между группами. При этом доля женщин, имеющих I и II стадию выраженности аденомиоза, превалировала во всех группах исследования и составила 30/38 (79%) в группе А, 36/45 (80%) – в группе В и 36/45 (80%) – в группе С. Лечение было назначено без учета стадии тяжести аденомиоза и начиналось со 2–3-го дня менструального цикла; таблетки принимали по одной в день на ночь ежедневно, без перерыва в течение 3 месяцев. Первую инъекцию аГнРГ делали на 2–3-й день менструального цикла, две последующие – через 28–30 дней от предыдущей. Переносимость медикаментозной терапии анализировали на основании оценки ряда параметров, включающих наличие мажущих кровяных выделений из половых путей, наличие и характер менструальноподобных выделений, переносимость лечения, наличие нейровегетативных симптомов.
Полученные данные показали, что у пациенток группы А, получающих аГнРГ, на первый план выступали вегетативные нарушения: приливы, повышение АД, боли в костях, головные боли, депрессия; у пациенток, получающих КОК и диеногест, превалировали аномальные маточные кровотечения. При этом у пациенток группы А вегетативные и метаболические расстройства нарастали с длительностью лечения. Напротив, побочные явления, наблюдаемые при применении КОК и диеногеста, исчезали к концу 3-го месяца лечения, что дает возможность пролонгировать длительность лечения.
Через каждый месяц приема препаратов проводили контрольное УЗИ для оценки эффективности проводимого лечения. Эти данные представлены в таблицах 1 и 2, в которых приведена оценка проводимого лечения в зависимости от стадии процесса и вида терапии.


Полученные данные показывают, что терапевтический эффект при назначении аГнРГ у больных с аденомиозом I–II стадии распространения был достигнут в первый месяц лечения, когда при I стадии распространения аденомиоза толщина стенок матки уменьшилась с 4,8 (4,4;5,2) см до 3,3 (3,1;3,4) см (р=0,01), и матка достигла нормальных размеров; при этом зарегистрировано уменьшение зоны гипоэхогенности по периферии от границы эндометрия, но гипо- и анэхогенные структуры в миометрии продолжали визуализироваться. В последующие 2 месяца, несмотря на продолжающееся лечение, ультразвуковая картина не менялась.
При аденомиозе II стадии за первые 2 месяца лечения матка достигла практически нормальных размеров: толщина стенки уменьшилась с 5,7 (5,3;6,0) см до 4,3 (4,0;4,7) см (р=0,03), уменьшилась зона повышенной эхогенности базального слоя, гиперэхогенные и анэхогенные включения в миометрии сохранились. Последующее лечение не привело к выраженному терапевтическому эффекту, ультразвуковая картина матки осталась без изменения.
Следовательно, терапевтический эффект аГнРГ при аденомиозе I–II стадии осуществлялся в 1–2-й месяц лечения, последующий прием препарата не привел к существенным изменениям эхографической картины. Вместе с тем усугублялись эндокринные и метаболические нарушения. У женщин, имеющих III стадию распространения аденомиоза, терапевтический эффект был достигнут лишь на 3-м месяце лечения аГнРГ, когда матка достигла нормальных размеров, толщина гиперэхогенной зоны в миометрии сократилась в 2 раза (с 3 см до 1,4 см), однако гиперэхогенные и анэхогенные включения в миометрии оставались.
Терапевтический эффект КОК у женщин, имеющих аденомиоз I–II стадии распространения проявился лишь на 2-м месяце приема препарата. К завершению 3-го месяца лечения матка при I стадии аденомиоза достигла практически нормальных размеров, хотя при наличии II стадии процесса толщина матки оставалась больше нормы.
У пациенток, имеющих III стадию аденомиоза, терапевтический эффект КОК оказался неудовлетворительным, лишь к 3-му месяцу лечения толщина стенок матки уменьшилась с 6,9 (6,4;7,2) см до 5,5 (5,0;6,2) см, Другие признаки аденомиоза в виде гиперэхогенной зоны в миометрии, наличия гипер- и анэхогенных включений сохранялись.

Назначение диеногеста привело к уменьшению размеров матки у женщин, имеющих I–II стадию аденомиоза. При I стадии уже после первого месяца приема препарата матка достигла нормальных размеров, при II стадии после 2-го месяца лечения наблюдалось уменьшение размеров матки, после 3-го месяца приема препарата матка достигла нормальных размеров. Вместе с тем, у женщин, имеющих аденомиоз III стадии терапевтический эффект не был достигнут после 3 месяцев приема препарата. Представленные данные свидетельствуют о том, что лечение КОК и диеногест, назначаемых в непрерывном режиме терапевтически оправдано у пациенток с I–II стадией аденомиозного процесса, когда к концу 3-го месяца приема препаратов достигаются нормальные размеры матки, ликвидируются побочные эффекты в виде «мазни» и отсутствуют эндокринно-обменные нарушения.
Использование этого вида лечения у женщин с III стадией процесса не привело к улучшению ситуации через 3 месяца лечения, что может говорить о необходимости пролонгации терапии на 6 и более месяцев.
При назначении аГнРГ женщинам с I–II стадией аденомиоза уменьшение размеров матки было достигнуто через 1 месяц лечения, дальнейшее назначение препарата приводило лишь к возникновению или усугублению эндокринно-метаболических нарушений без выраженных изменений со стороны матки. При III стадии процесса лишь использование аГнРГ позволило зарегистрировать терапевтический эффект к концу 3-го месяца лечения. Полученные данные позволяют сделать вывод о необходимости дифференцированного подхода к выбору метода лечения аденомиоза в зависимости от стадии его распространения. При I–II стадии целесообразно использовать КОК или диеногест в непрерывном режиме в течение 3 месяцев. Причем, назначение диеногеста продемонстрировало более отчетливый терапевтический эффект и меньшее число осложнений. При аденомиозе III стадии указанные виды лечения, скорее всего, следует использовать не менее 6 месяцев. Терапевтический эффект к концу 3-го месяца лечения при этой стадии аденомиозного процесса был получен лишь при назначении аГнРГ.
На следующем этапе нашего исследования после окончания лечения проведена программа ЭКО, оценена частота наступления беременности.
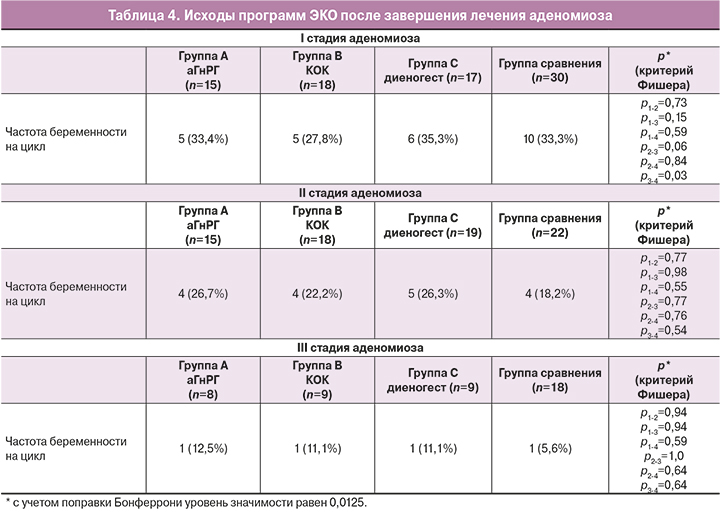
Оказалось, что частота наступления беременности при аденомиозе I стадии составила в группе А – 5/15 (33,4%); в группе В – 5/18 (27,8%); в группе С – 6/17 (35,3%), что соответствовало показателям пациенток, не проходящих предварительного лечения 10/30 (33,3%) (р>0,05). Таким образом, при аденомиозе I стадии распространения вне зависимости от вида подготовительной терапии (аГнРГ, диеногест, КОК) результаты программ ЭКО практически не различались с группой сравнения.
При аденомиозе II стадии в группе А частота наступления беременности составила 4/15 (26,7%); в группе В – 4/18 (22,2%); в группе С – 5/19 (26,3%) беременностей на попытку лечения, в группе сравнения – 4/22 (18,2%) (р>0,05). Зарегистрировано увеличение частоты наступления беременности у пациенток со II стадией аденомиоза по отношению к группе сравнения. Однако, статистически значимых различий в частоте наступления беременности в зависимости от вида подготовительной терапии зарегистрировано не было.
При аденомиозе III стадии вне зависимости от проведенной подготовительной терапии отмечается тенденция к повышению частоты наступления беременности относительно группы сравнения. Однако, эти результаты остаются низкими и не превышают 11–12%. В группе А беременность наступила у 1/8 (12,5%) женщин, в группе В – у 1/9 (11,1%); в группе С – у 1/6 (11,1%) женщин, в группе сравнения – у 1/17 (5,6%) (р>0,05).
Заключение
Совокупность полученных данных позволяет сделать следующие выводы.
При динамическом ультразвуковом исследовании у больных с I стадией аденомиоза назначение всех трех видов лечения не привело к существенному изменению состояния матки в течение 3 месяцев лечения. Частота наступления беременности на попытку ЭКО при аденомиозе I стадии распространения не зависит от проведенного лечения и его характера. В связи с этим, аденомиоз I стадии распространения не является причиной бесплодия и неудач ЭКО и не требует лечения.
При II стадии аденомиоза предварительное лечение позволяет увеличить частоту наступления беременности на 5–8% по сравнению с контрольной группой. При этом препаратом выбора для предварительного лечения является диеногест, обладающий удовлетворительным терапевтическим эффектом, минимальными побочными эффектами.
При аденомизе III стадии распространения применение предварительного лечения аГнРГ позволило повысить частоту наступления беременности с 5 до 12% на попытку ЭКО, тогда как назначение КОК и диеногеста не привели к значимому терапевтическому эффекту, т.е. состояние матки оставалось практически без изменений. Однако, частота наступления беременности остается низкой и характеризуют III стадию распространения аденомиоза, как тяжелое маточное бесплодие.



