Бесплодный брак до сих пор остается глобальной проблемой в медицинских и социальных сферах современного общества. Достигнуты успехи в диагностике и лечении здоровья супружеской пары, но тенденции к снижению числа бесплодия в браке не прослеживается. В России этот показатель неизменно растет и достиг в 2016 г. отметки 278,8 на 100 тыс. женщин в возрасте 18–49 лет, что считается критическим [1]. Доля женского бесплодия в браке достигает 60% [2]. Основная задача репродуктолога при проведении программ овариальной стимуляции (ОС) – получение достаточного числа зрелых ооцитов и эмбрионов хорошего качества. У молодых женщин со сниженным овариальным резервом (ОР) чаще всего в анамнезе отмечаются оперативные вмешательства: резекция яичника (наличие образований), тубэктомия, сальпингоовариолизис. Объем оперативного вмешательства – важный для прогноза реализации репродуктивной функции фактор [3]. Первое место в структуре заболеваний яичников занимает поражение эндометриоидными гетеротопиями, частота которых при бесплодии, по данным разных авторов, составляет от 17 до 44% и может достигать 64% [4]. Лапароскопия – золотой стандарт лечения пациенток с эндометриозом яичников [5]. Травматичное выделение капсулы эндометриоидной кисты с последующим термическим гемостазом области ворот яичника может привести к его острой ишемии и утрате части фолликулярного аппарата, причем в ряде случаев – значимой для реализации фертильности. Данные последних зарубежных метаанализов [6, 7] свидетельствуют о значимом снижении сывороточной концентрации антимюллерова гормона (АМГ), основного маркера ОР, после хирургических вмешательств на органах малого таза. Потенциально низкий уровень ОР – причина не только женского бесплодия, но и неудач экстракорпорального оплодотворения (ЭКО) [8]. В этих условиях оценка качества ооцитов становится одной из главных задач эмбриолога при проведении ЭКО. Оценить морфологию ооцитов и эмбрионов непросто, поскольку основные механизмы, оказывающие влияние на внешний вид ооцита, включают в себя множество факторов [9]. Измененные морфологические характеристики ооцитов негативно сказываются на эффективности оплодотворения и вероятности имплантации эмбрионов [10]. Данные характеристики ооцитов и эмбрионов зависят от таких факторов, как возраст, образ жизни, наличие генетических поломок, вид программы ОС, условия культивирования и др. Исследователи продолжают изучать не только эти факторы, потенциально отражающиеся на качестве гамет и эмбрионов, но и возможности влияния на эту составляющую. В частности, результаты многих последних зарубежных научных исследований продемонстрировали положительный эффект в отношении качества ооцитов и эмбрионов при применении мио-инозитола (инозита) [11].
Инозитолзависимые сигналы играют важную роль на заключительных стадиях созревания яйцеклетки в рамках подготовки к ее успешной активации в момент оплодотворения. Проспективные контролируемые рандомизированные исследования показали, что мио-инозитол улучшает качество не только женских, но и мужских гамет [12, 13]. Важно отметить, что добавление мио-инозитола к фолиевой кислоте у пациенток, которым проводилось лечение бесплодия с помощью ЭКО, позволило уменьшить дозы рекомбинантного фолликулостимулирующего гормона (ФСГ) в программах ОС. Таким образом, удалось увеличить число зрелых ооцитов, полученных в программах ЭКО. В настоящее время остается актуальным вопрос о получении достаточного количества эмбрионов хорошего качества у пациенток со сниженным ОР для повышения частоты наступления беременности (ЧНБ) в программах ЭКО.
Цель исследования pre-IVF TIDOR – оценить качество ооцитов, качество эмбрионов и исходы циклов ЭКО у пациенток со сниженным ОР, получавших инозит перед лечением бесплодия методом ЭКО.
Материалы и методы
В наблюдательное сравнительное многоцентровое исследование pre-IVF TIDOR отобраны 270 пациенток с первичным и вторичным бесплодием, обратившихся в клиники вспомогательных репродуктивных технологий России, входящие в состав саморегулируемой организации «Ассоциация клиник ВРТ» (президент – д.м.н. Э.В. Вартанян, директор ООО «Клиника вспомогательных репродуктивных технологий “Дети из пробирки”») на клинической базе кафедры акушерства и гинекологии (заведующая кафедрой – д.м.н., проф. Ю.Э. Доброхотова) лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России в период с 01.07.2015 по 31.12.2018 включительно: 1-я группа (n=158) – женщины со сниженным ОР, получавшие инозит 4000 мг + фолиевая кислота 400 мкг (Иноферт, Italfarmaco S.p.A., Италия) перед лечением бесплодия методом ЭКО; 2-я группа (n=112) – женщины со сниженным ОР, не получавшие инозит до наступления беременности в программе ЭКО. Критерии включения: возраст моложе 38 лет, отсутствие генетических и тяжелых экстрагенитальных заболеваний, оперативные вмешательства на яичниках в анамнезе, уровень АМГ <1,0 пг/мл, перенос эмбрионов (ПЭ) ≤2 в цикле ОС. Критерии исключения: возраст 38 лет и старше, наличие генетических и тяжелых экстрагенитальных заболеваний, отсутствие оперативных вмешательств на яичниках в анамнезе, АМГ ≥1,0 пг/мл, перенос размороженных эмбрионов, программы ЭКО с донацией ооцитов. Нами оценены исходы программ ЭКО: количество зрелых ооцитов, количество эмбрионов хорошего качества, ЧНБ на ПЭ.
Перед вступлением в программу ЭКО, на 2–3-й день менструального цикла, выполняли трансвагинальное ультразвуковое исследование (ТВУЗИ) согласно стандартизованной методике [14, 15]. Мониторинг роста фолликулов в цикле контролируемой ОС проводили путем фолликулометрии. Концентрации АМГ, ФСГ, лютеинизирующего гормона (ЛГ), эстрадиола в сыворотке крови определяли микроиммунофлюоресцентным методом.
На этапе прегравидарной подготовки пациентки 1-й группы получали инозит 4000 мг + фолиевая кислота 400 мкг (Иноферт, Italfarmaco S.p.A., Италия), перорально по 4 саше/сут в течение 3 месяцев и во время ОС. После получения ооцитов инозит отменяли. Пациентки 2-й группы получали только фолиевую кислоту 400 мкг + цианокобаламин 2 мкг (Фолибер, Italfarmaco S.p.A., Италия), перорально по 1 табл./сут в течение 3 месяцев и во время протокола ОС. При наступлении беременности пациентки всех групп продолжали прием данного фолатсодержащего препарата до 12 недель гестации.
Контролируемую ОС проводили по следующим схемам: 1) протокол с применением препарата, содержащего ФСГ (фоллитропин альфа 225 ME/сут, подкожно, по схеме), назначая его с 3–5-го дня менструального цикла. Продолжительность введения препарата ФСГ составила от 9 до 12 дней и зависела от размеров доминантного фолликула по данным фолликулометрии. С 5-го по 12-й день на фоне продолжающейся стимуляции суперовуляции применяли также препарат антагониста гонадотропин-рилизинг-гормона (ант-ГнРГ) (цетрореликс 0,25 мг по 1 шпр./сут, подкожно, по схеме); 2) протокол с десенситизацией гипоталамо-гипофизарно-яичниковой системы, которую проводили с применением агониста гонадотропин-рилизинг-гормона (аГнРГ) (трипторелина ацетат 0,1 мг/сут, подкожно, по схеме), начиная с 21-го дня предыдущего цикла и в течение 18 дней с непосредственным переходом к ОС препаратом, содержащим ФСГ (фоллитропин альфа 225 ME/сут, внутримышечно по схеме).
В качестве триггера овуляции во всех группах назначали рекомбинантный человеческий хорионический гонадотропин (ХГЧ) хориогонадотропин альфа 250 мкг, 6500 МЕ, подкожно, однократно («Овитрель», Merk Serono, S.p.A., Италия). Учитывая малое количество полученных ооцитов у пациенток со сниженным ОР после оперативных вмешательств на яичниках, оплодотворение зрелых ооцитов MII единичным сперматозоидом при ЭКО проводили методом интрацитоплазматической инъекции сперматозоида (ICSI – IntraCytoplasmic Sperm Injection) [16]. Качество эмбрионов оценивали по классификации D.K. Gardner и W.B. Schoolcraft (1999) [17]. В полость матки производили перенос 1 или 2 эмбрионов хорошего качества на стадии бластоцисты (эмбрионы 5-го дня развития классов А и В).
Для поддержки лютеиновой фазы цикла использовали микронизированный прогестерон 200–600 мг/сут («Ипрожин», Catalent France Beinheim SA, Capsugel Ploermel SAS France, Laboratorios Effik для Italfarmaco S.p.A., Италия) интравагинально в течение всего периода прегравидарной подготовки с 15-го по 25-й день каждого менструального цикла, в том числе в программе ЭКО до определения уровня β-ХГЧ, и далее до 12 недель гестации [18].
Всем пациенткам определяли уровень β-ХГЧ в периферической крови через 14 дней после ПЭ. При уровне β-ХГЧ >50 МЕ/л тест на наличие беременности считали положительным.
Статистический анализ: математическую обработку результатов проводили с помощью методов описательной статистики, применяя программы Excel 2007, Statistical Package for Social Sciences (IBM SPSS v.23.0), Statistica v.10.0 (StatSoft Inc.). Количественные переменные представлены с помощью N и n, где N – количество пациенток в группе, а n – количество наблюдений в группе. Описательная статистика количественных переменных, имеющих нормальное распределение, представлена в виде M (SD), где М – среднее арифметическое, SD – стандартное отклонение, и 95% доверительного интервала (ДИ); при распределении, отличающемся от нормального, – медианами (Ме) и квартилями (Q1; Q3). Для определения статистической значимости различий количественных переменных в независимых выборках применены непараметрические тесты (критерий Манна–Уитни). Сравнительный анализ количественных переменных выполняли с помощью критерия t Стьюдента. При анализе таблиц сопряженности 2×2 использовали поправку Йетса/точный критерий Фишера. Различия считали статистически значимыми при р<0,05.
Результаты
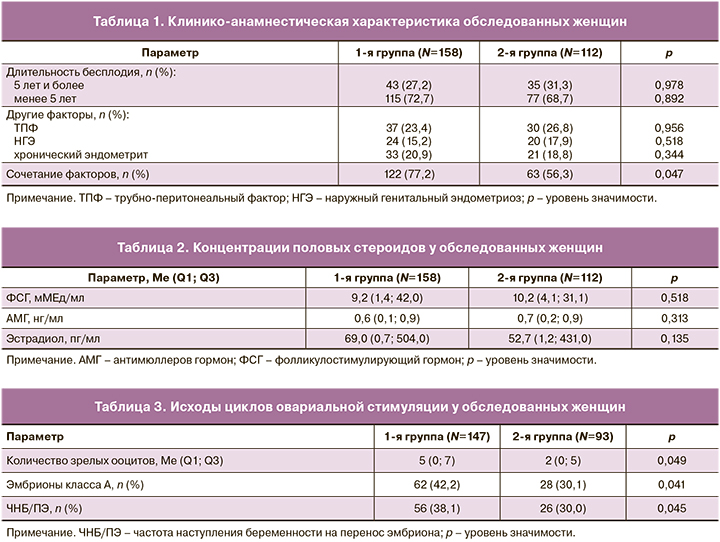
Средний возраст и индекс массы тела в группах были сопоставимы; средний возраст составил 32,2 (5,7) года, средний индекс массы тела 22,0 (6,7) кг/м2. Частота первичного и вторичного бесплодия в группах была также сопоставима. Так, первичное бесплодие зарегистрировано у 86 (54,4%) женщин 1-й и у 70 (62,5%) пациенток 2-й групп. Сочетание причин бесплодия встречалось у женщин 1-й группы значимо чаще (122 (77,2%) против 63 (56,3%); p=0,047) (табл. 1).
Перед назначением ОС всем женщинам проводили оценку гормонального статуса (табл. 2).
Во всех группах чаще применяли протокол ОС с препаратом, содержащим ФСГ. Однако протокол ОС с десенситизацией гипоталамо-гипофизарно-яичниковой системы значимо чаще использовали у пациенток 2-й группы (75 (47,5%) против 30 (27,2%); p=0,041), что объяснимо несколько более высокой частотой наружного генитального эндометриоза – у 20 (17,9%) женщин. Отмена цикла ОС произошла у 11 (7,0%) женщин 1-й группы и у 19 (12,0%) 2-й группы и была обусловлена отсутствием адекватной динамики роста фолликулов при ОС.
Исходы циклов ЭКО участвовавших в нашем исследовании пациенток представлены ниже (табл. 3). Эмбрионы хорошего качества получены у женщин 1-й группы, которым назначали инозит на этапе прегравидарной подготовки значимо чаще (62 (42,2%) против 28 (30,1%); p=0,041).
Перенос 2 эмбрионов выполнен большинству женщин – 111 (75,5%) в 1-й и 67 (72,0%) во 2-й группах, при этом многоплодная беременность бихориальной биамниотической двойней наступила только у одной пациентки из 1-й группы. Эффективность ЭКО, оцененная по ЧНБ/ПЭ, имела существенные различия в группах. Так, ЧНБ/ПЭ у женщин со сниженным ОР, не получавших инозит на этапе подготовки к лечению бесплодия методом ЭКО, была значимо ниже в сравнении с теми, кому данная терапия была назначена (20 (30,0%) против 56 (38,1%); p=0,045).
Обсуждение
Результаты научных исследований последних лет убедительно доказали связь неблагоприятного прогноза фертильности при длительности бесплодия свыше 5 лет и сочетании причинных факторов [19, 20]. По данным литературы, наиболее часто среди причин бесплодия в браке встречается мужской фактор (до 40–60%) [21], а среди женских факторов бесплодия преобладают хроническая ановуляция (до 30%) и трубный фактор (от 30 до 50%) [22, 23].
В нашем исследовании pre-IVF TIDOR бесплодие продолжительностью 5 лет и более отмечалось у 43 (27,2%) женщин 1-й группы и у 35 (31,3%) 2-й группы, что, вероятно, обусловлено их ранним обращением за медицинской помощью в сфере вспомогательных репродуктивных технологий после перенесенных ранее операций на яичниках. Среди других факторов бесплодия в обеих группах преобладал трубно-перитонеальный фактор (37 (23,4%) и 30 (26,8%); p=0,956). Обращало на себя внимание, что сочетание причин бесплодия отмечалось у подавляющего большинства пациенток 1-й группы (122 (77,2%) против 63 (56,3%); p=0,047). Таким образом, 1-я группа характеризовалась исходно большим риском неудач ЭКО по сравнению со 2-й группой, и это следует принять во внимание при сравнительном анализе результатов данного исследования.
Известно, что ЧНБ при лечении бесплодия методом ЭКО зависит от уровня АМГ [24] и ухудшается по мере прогрессивного снижения данного показателя, не превышая 12% при уровне менее 1,1 нг/мл [25–29]. Результаты некоторых исследований показали, что при сниженном ОР после оперативных вмешательств на яичниках по поводу эндометриом отмечаются не только снижение ЧНБ в программах ВРТ [30–32], но и высокая частота отмены цикла ЭКО – до 30% [24, 25].
В исследовании pre-IVF TIDOR уровень АМГ у женщин 1-й и 2-й групп составил 0,6 (0,1; 0,8) и 0,7 (0,2; 0,9) нг/мл соответственно, что, бесспорно, указывало на снижение ОР после перенесенных оперативных вмешательств на яичниках. Перед вступлением в программу ЭКО у 11 (7,0%) пациенток 1-й группы и у 19 (12,0%) 2-й группы уровень АМГ составил менее 0,5 нг/мл, в связи с чем была предложена донация ооцитов, от которой эти женщины категорически отказались. Адекватной динамики роста фолликулов при ОС у них достичь не удалось, в связи с чем произошла отмена программы ОС, что, безусловно, было связано с крайне низким уровнем АМГ.
Определение базальных концентраций эстрадиола (Е2) и фолликулостимулирующего гормона (ФСГ) – рутинный тест для оценки овариального резерва перед началом программы ЭКО. Доказано, что высокий базальный уровень Е2, даже при нормальном уровне ФСГ, – предиктор «бедного ответа» и риска отмены цикла ОС [26]. Кроме того, результаты некоторых исследований продемонстрировали связь высоких базальных значений Е2 с риском неэффективного ПЭ [27, 28].
В нашем исследовании pre-IVF TIDOR у пациенток обеих групп определялись высокие базальные концентрации Е2 (69,0 (0,7; 504,0) и 52,7 (1,2;431,0) пг/мл) и ФСГ (9,2 (1,4; 42,0) и 10,2 (4,1; 31,1) мМЕд/мл соответственно), что, бесспорно, указывало на наличие сниженного овариального резерва и высокий риск отмены цикла ОС и/или неэффективного ПЭ. В 1-ю группу вошли 43 (27,2%), а во 2-ю – 35 (31,3%) пациенток с длительностью бесплодия 5 лет и более. Отмена цикла ОС была обусловлена отсутствием адекватной динамики роста фолликулов при ОС, что имело место у 11 (7,0%) пациенток 1-й и у 19 (12,0%) пациенток 2-й группы. Детальный анализ лечебных мероприятий по коррекции уровней Е2 и ФСГ до включения в наше исследование не входил в перечень поставленных задач.
Доказано, что возраст – основной фактор, негативно влияющий на качество гамет и эмбрионов, и у пациенток в возрасте моложе 38 лет, даже при сниженном ОР, сохраняется возможность получения эмбрионов хорошего качества в программах ВРТ при условии адекватного роста фолликулов, а ЧНБ/ПЭ может достигать 26% [34].
У пациенток со сниженным ОР, не получавших инозит до вступления в программу ЭКО, достигнуто значимо меньшее количество зрелых ооцитов (2 (0–5) против 5 (0–7); p=0,049), в сравнении с теми женщинами, кому данная терапия была назначена. При сравнении количества эмбрионов хорошего качества в группах установлено, что значимо чаще эмбрионы хорошего качества получены у пациенток с назначением инозита в составе прегравидарной подготовки (62 (42,2%) против 28 (30,1%); p=0,041) перед лечением бесплодия методом ЭКО. ЧНБ/ПЭ у женщин со сниженным ОР, не получавших инозит на этапе прегравидарной подготовки, была также значимо ниже в сравнении с теми, кому данная терапия была проведена (26 (30,0%) против 56 (38,1%); p=0,045). Следует отметить, что у женщин со сниженным ОР после перенесенных оперативных вмешательств на яичниках, характеризующихся повышенным риском неудач ЭКО, после включения инозита в комплекс мероприятий по подготовке к зачатию удалось достичь ЧНБ/ПЭ, сопоставимой со средними показателями эффективности ЭКО в России и в мире [35, 36].
Заключение
Результаты нашего исследования pre-IVF TIDOR убедительно показали, что назначение инозита (Иноферт, Italfarmaco S.p.A., Италия) женщинам моложе 38 лет со сниженным ОР после операций на яичниках, которым предстоит лечение бесплодия методом ЭКО, – оправданный шаг для получения большего числа ооцитов и улучшения качества эмбрионов. Такая тактика на этапе подготовки к программам ЭКО позволит повысить ЧНБ/ПЭ у пациенток с оперативными вмешательствами на яичниках в анамнезе.



