Введение
За последние годы нарушение репродуктивной функции мужчин, состоящих в бесплодном браке, приобрело особую медицинскую и социальную значимость. Демографические показатели в России и многих странах мира свидетельствуют об увеличении частоты инфертильного состояния мужчин. Приблизительно 15 % супружеских пар бесплодны. В Европе бесплодны около 10 % супружеских пар, в США – 8–15 %, в России – от 8,0 до 17,5 %, и в настоящее время нет тенденции к снижению.
Принято считать, что 40–45 % случаев бесплодия семьи приходится на мужской фактор, 40–45 % – на женский, еще 10–15 % – на сочетание различных факторов у обоих партнеров (Кулаков В.И., 2005).
По данным некоторых авторов, за последние десятилетия во всем мире отмечено прогрессирующее снижение качества спермы и фертильности у мужчин. Так, при анализе эякулята в фиксированной мужской популяции с 1973 по 1992 г. содержание сперматозоидов в эякуляте ежегодно снижалось на 2,1 % (Auger J., 1997). За последние полвека отмечено снижение показателей спермограммы почти в 3 раза (Irvine S., 1996).
К причинам мужского бесплодия относится наличие многих заболеваний, оказывающих отрицательное воздействие на эндокринные органы и половые железы, приводящих к дистрофическим изменениям в семенных канальцах, интерстициальной ткани яичка и способствующих возникновению патоспермии. Патоспермия – нарушение выработки и созревания сперматозоидов, которое в спермограмме отражается в виде уменьшения количества, снижения подвижности сперматозоидов или появления множества патологических форм сперматозоидов, например, за счет изменения морфологии сперматозоидов. Полиэтиологичность мужского бесплодия, сложность его развития, функциональная взаимосвязь мужских половых желез со всеми системами и органами создают большие трудности в разработке адекватных методов лечения нарушений сперматогенеза. Кроме того, на фертильность мужчин оказывают влияние различные социальные и демографические факторы, загрязнение окружающей среды, стрессы, привычные интоксикации и др. (Курило Л.Ф., Гришина Е.М., 2006).
Кроме того, нельзя забывать, что каждому третьему пациенту сегодня мы ставим диагноз «идиопатическая форма бесплодия», т.е. когда явную причину установить не удается. За последние 10 лет за счет углубленного изучения таких аспектов инфертильности, как иммунологический, генетический, эндокринологический, и ряда других удалось снизить частоту встречаемости идиопатических форм мужского бесплодия с 70 до 35 % (EAU Guidelines, 2010).
Сложный многофакторный механизм формирования инфертильности способствует появлению на фармацевтическом рынке многокомпонентных биокомплексов (БАД), содержащих активные компоненты, способные влиять на различные составляющие спермограммы, обусловливающие качество эякулята. Большинство из них содержит единые компоненты, включающие ферменты, микроэлементы, витамины. Примером таких биокомплексов служат Спеман, Спермаплант, Трибестан, Верона, Селцинк, Профертил и Спермактин.
Недавно на российском рынке появился еще один препарат для коррекции патоспермий – АндроДоз®, благодаря своему составу и уникальной технологии изготовления заслуживающий пристального внимания и вызывающий интерес медицинской общественности. Комплекс зарегистрирован на территории РФ. Основные компоненты (субстанции) для изготовления АндроДоза® производятся швейцарской компанией DSM Nutritional Products и имеют высокую степень очистки (проходят молекулярную дистилляцию, которая позволяет удалять примеси тяжелых металлов).
Как известно, идиопатическое бесплодие в настоящее время связывают с нарушением антиокислительной активности спермы, вызванной недостатком аминокислот, витаминов, микронутриентов, коэнзимов и ряда других необходимых биологически активных компонентов, наряду с внешними вредными воздействиями (интоксикациями, перегреванием, плохими экологическими условиями и т.п.). Особенно перспективным для предотвращения оксидативного стресса и снижения его негативного влияния на сперматогенез считается совместное одновременное применение жиро- и водорастворимых антиоксидантов, однако при использовании обычных технологий создания лекарственных форм это представляется трудновыполнимым.
Сочетание жиро- и водорастворимых антиоксидантных компонентов оказалось возможным благодаря использованию нанотехнологии Actilease в производстве жирорастворимых субстанций АндроДоза® (коэнзима Q10, витамина Е, витамина А). Данной технологией достигается микрокапсулирование или разделение активных ингредиентов на микроскопические наночастицы, что в сочетании с наличием в АндроДозе® особой полисахаридной матрицы обеспечивает высокую биодоступность, водорастворимость и стабильность, оптимальную концентрацию компонентов состава, а также равномерное замедленное высвобождение активных веществ в организме.
В состав биокомплекса АндроДоз® входят девять действующих веществ, в той или иной степени известных влиянием на качество спермы своими отдельными свойствами: L-аргинин – биологически активный изомер условно незаменимой аминокислоты аргинина, способствующий здоровой микроциркуляции, препятствующий образованию тромбов, повышающий функцию Т-клеточного звена иммунитета, способный косвенно стимулировать выделение тестостерона у мужчин, активирует периферическую микроциркуляцию. Белки семенной жидкости на 80 % состоят из L-аргинина, в связи с чем данная аминокислота занимает важнейшее место в половой сфере мужчин, а дефицит ее может приводить к нарушению сперматогенеза и бесплодию. Регулярный прием L-аргинина благотворно влияет на здоровье предстательной железы и усиливает сперматогенез (увеличивает производство и качество спермы).
L-карнитин – природное витаминоподобное вещество (витамин В11, или витамин Т), которое обеспечивает энергией весь процесс сперматогенеза (процесс создания сперматозоидов) и напрямую влияет на способность мужчины к зачатию ребенка. L-карнитин способен подавлять развитие оксидативного стресса, развитие которого имеет ключевое значение в патогенезе идиопатического мужского бесплодия. Регулярный прием L-карнитина улучшает подвижность и увеличивает выработку сперматозоидов.
Коэнзим Q10 (убихинон) – важнейший элемент синтеза биохимических носителей энергии. Регулярный прием коэнзима Q10 эффективен при высоких физических нагрузках, повышает выносливость, способен замедлять процесс старения.
Коэнзим Q10 является мощным антиоксидантом, кроме того, он обладает уникальной способностью восстанавливать активность других антиоксидантов (имеет синергизм с L-карнитином и витамином Е). Кроме того, коэнзим Q10 обладает выраженными иммуномодулирующими свойствами. Благодаря вышеперечисленным свойствам данное вещество способствует увеличению выработки сперматозоидов и улучшает их подвижность.
L-карнозин – мощный антиоксидант широкого спектра действия. Нейтрализует тяжелые металлы, предотвращает отравление организма различными токсинами. Регулирует активность иммунной системы. При курсовом приеме защищает мужскую репродуктивную систему от вредных воздействий, улучшает подвижность сперматозоидов и усиливает способность сперматозоидов внедряться в яйцеклетку.
Cеленметионин является активированной формой селена – жизненно необходимого микроэлемента, входящего в состав ряда гормонов и ферментов, практически связанных со всеми органами и системами организма человека. Селен – мощный антиоксидант, основная роль которого – подавление процесса окисления липидов и защита клеток от разрушающего действия свободных радикалов. Способен защищать сперматогенез при острых и хронических интоксикациях. Имеет выраженный синергетический эффект с витаминами А и Е, уменьшает их распад, при этом снижая потребность их поступления в организм. Селенметионин необходим для нормального функционирования половой системы, при регулярном дополнительном приеме улучшает качество и количество сперматозоидов.
Применение селена в форме органического селенметионина обеспечивает постепенное, не зависимое от содержания витаминов всасывание в кишечнике, а также равномерное содержание в плазме крови данного микроэлемента в течение длительного времени (создается депо селена в организме), исключая возможность токсического действия его больших доз.
Пюрамекс (Puramex) ZN (лактат цинка) – активированная молочнокислая форма цинка, наиболее легкоусвояемая в пищеварительном тракте.
Цинк – жизненно важный микроэлемент, который можно обнаружить практически в любых тканях организма. Цинк абсолютно необходим для клеточного дыхания, утилизации кислорода, воспроизведения генетического материала (ДНК и РНК), поддержания целости клеточных стенок и обезвреживания свободных радикалов. Цинк – один из наиболее важных микроэлементов для нормального функционирования мужской репродуктивной системы, поскольку он запускает и поддерживает процессы производства тестостерона и активизирует сперматогенез. В организме человека цинк концентрируется в яичках, придатках яичек, в предстательной железе, но больше всего цинка содержится в сперме. Этим объясняются развитие бесплодия, замедление процессов полового созревания и снижение сексуальных способностей, возникающих при дефиците цинка.
Дефицит цинка часто развивается при повышенном выведении данного микроэлемента под влиянием стрессов, электромагнитного излучения (при работе за компьютером, длительном пребывании рядом с включенным телевизором и т.п.), а также под воздействием ядовитых веществ, тяжелых металлов, пестицидов и других загрязнений окружающей среды. Прием лактата цинка способствует улучшению большинства показателей спермограммы, приводя к увеличению концентрации сперматозоидов, их подвижности и числу морфологически нормальных форм. Достаточное поступление цинка в организм необходимо и для обеспечения процессов всасывания витамина А в кишечнике.
Глицирризиновая кислота оказывает противовирусное, противовоспалительное, противоаллергическое, тонизирующее и иммуномодулирующее действие; способствует разрушению гликопротеина семеногелина, придающего вязкость сперме, что приводит к разжижению эякулята и переводит сперматозоиды в активное состояние.
Витамин Е (токоферол) является важным элементом антиоксидантной системы: предотвращает повреждение клеточных стенок, нейтрализуя пероксид водорода и другие активные формы кислорода; необходим для роста новых клеток, нормального функционирования иммунной системы, а также замедляет процесс старения. Доказано, что прием витамина Е снижает «тяжесть» окислительного стресса в ткани яичек, повышает подвижность сперматозоидов и положительно влияет на их способность проникать в яйцеклетку. Витамин E обладает эффектом синергизма с ретинолом и селеном за счет взаимного предотвращения окисления как в кишечнике, так и в тканях.
Витамин А (ретинол) – важное звено антиоксидантной системы, защищающее клеточные мембраны от окисления, влияет на синтез белков и поддерживает репродуктивные функции. Наличие ретинола в спермоплазме также необходимо для нормального сперматогенеза и поддержания подвижности сперматозоидов. Улучшает усвоение цинка и усиливает его антиоксидантное действие.
Показано, что компоненты АндроДоза® при использовании в комбинации способны проявлять синергизм, т.е. действуют намного сильнее и достигают выраженного эффекта в гораздо более низких дозах, чем при применении этих действующих веществ по отдельности.

Удачным сочетанием компонентов и использованием новейших современных технологий при производстве АндроДоза® достигается многогранность действия, позволяющая поддерживать здоровое состояние репродуктивной системы мужчины и полноценный процесс созревания спермы при курсовом применении комплекса.
Первые результаты по изучению эффективности данного биокомплекса при нарушениях сперматогенеза были получены Г.В. Тер-Аванесовым в 2012 г. По результатам проведенного плацебо-контролируемого исследования с участием 138 пациентов с идиопатическими формами патоспермии, которые принимали АндроДоз® в течение 3 месяцев, было выявлено увеличение концентрации сперматозоидов, их подвижности, увеличение количества жизнеспособных и морфологически нормальных сперматозоидов, а также увеличение объема эякулята (Г.В. Тер-Аванесов, 2011).
Целью данного исследования стало определение возможности использования АндроДоза® при коррекции патоспермий, оценка его эффективности и безопасности.
Материал и методы
В клиническом исследовании в 9 клинических центрах России приняли участие 73 пациента в возрасте от 20 до 65 лет (в среднем 34,32 ±7,9 года) с различными вариантами патоспермии, включая идиопатические, и продолжительностью инфертильного периода от 14 месяцев до 4 лет (в среднем 22,27 ± 17,1 месяца).
В исследуемой популяции 15 (20,54 %) пациентов ранее получали терапию по поводу инфертильности, включившую такие препараты, как Спеман, Витапрост, Спермактин, Спермаплант, Аэвит, Селцинк, Ликопрофит, Эскузан и др., а 6 (8,21 %) пациентов получали одновременно с терапией инфертильности физиотерапевтическое лечение (термо-, гирудотерапию и др.).
В изучаемой группе на момент начала исследования не было выявлено инфекций, передающихся половым путем, отклонений параметров анализов крови и мочи. Уровень общего тестостерона в популяции составил 15,4 ± 8,7 нмоль/мл, уровень общего ПСА в среднем – 1,024 нг/мл, начальный уровень Ингибина Б – 219,58 ± 90,89 нг–мл, а уровень антимюллерова гормона у включенных в исследование пациентов не превысил 5,96 ± 1,16 нг–мл.
В соответствии с дизайном исследования и для оценки отдельных параметров все пациенты были разделены на две группы в зависимости от наличия специфических антиспермальных антител (АСАТ). Первую группу составил 41 пациент с выявленными антиспермальными антителами, вторую – 32 пациента, у которых антител выявлено не было. В первой группе у 30 (73,17 %) пациентов уровень АСАТ превысил 10 %, т.е. был клинически значимым, у 11 (26,83 %) концентрация АСАТ не превысила 10 %, поэтому для клинической объективности при исследовании влияния препарата на концентрацию АСАТ было проведено дополнительное разделение пациентов с АСАТ на 2 подгруппы (1А-подгруппа с клинически значимым АСАТ более 10 %, 1Б-подгруппа с АСАТ менее 10 %).
Наблюдение осуществлялось в течение 6 контрольных визитов через каждые 1,5 месяца, причем 3-й и 4-й визиты проведены во время приема терапии, а 5-й и 6-й – по завершении экспериментального курса для изучения последействия.
На каждом визите проведен физикальный осмотр, выполнены спермограммы, исследован уровень АСАТ, иммуноглобулинов А и G, на визитах 1, 4 и 6 – трансректальное УЗИ, общий и биохимический анализы крови, общий анализ мочи, исследование половых гормонов. В процессе исследования проведено наблюдение за пациентами на предмет выявления нежелательных явлений или побочных реакций.
Согласно протоколу исследования, оценка эффективности терапии выражалась числом (%) пациентов, у которых был достигнут выраженный и удовлетворительный эффект. При этом «выраженный эффект» расценивался как повышение общего количества сперматозоидов на 50 % и более, увеличение концентрации прогрессивно подвижных форм сперматозоидов – на 50 % и более, снижение концентрации АСАТ – на 50 % и более от исходного уровня; «хороший эффект» – повышение общего количества сперматозоидов на 30–49 %, увеличение концентрации прогрессивно подвижных форм сперматозоидов – на 30–49 %, снижение концентрации АСАТ – на 30–49 % от исходного уровня; «удовлетворительный эффект» – повышение общего количества сперматозоидов на 10–29 %, увеличение концентрации прогрессивно подвижных форм сперматозоидов – на 10–29 %, снижение концентрации АСАТ – на 10–29 % от исходного уровня и «неудовлетворительный эффект» – отсутствие значимой положительной динамики спермограммы или ухудшение статуса спермограммы.
Полученные данные внесены в индивидуальные регистрационные карты пациентов и обработаны программами Microsoft Office Excel 2007 и Statistica Biostat v. 6.3.
Результаты исследования
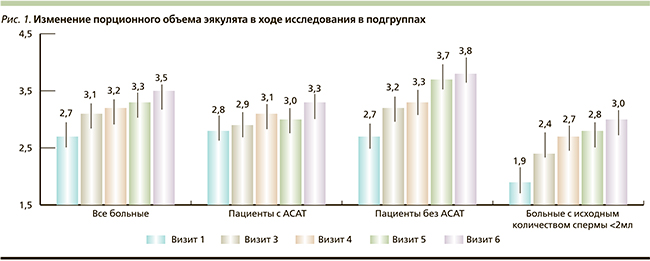
В ходе исследования были получены следующие данные: при исследовании объемных характеристик эякулята по данным спермограмм, проведенных через 1,5 месяца от начала приема АндроДоза® (визит 3), через 3 месяца от начала приема АндроДоза®, (визит 4), а также в период последующего наблюдения – через 1,5 (визит 5) и 3 месяца (визит 6) после окончания 3-месячного курса приема АндроДоза®, выявлено статистически значимое увеличение объема эякулята в обеих подгруппах, начиная с 3-го визита (1,5 месяца терапии). Данный эффект усиливался с увеличением продолжительности терапии и сохранялся в период наблюдения. Так, в группе пациентов, имевших клинически значимое снижение объема эякулята (< 2 мл) на момент включения в исследование, объем эякулята в среднем увеличился (по сравнению с исходным уровнем) на 26,31 % – через 1,5 месяца терапии, на 42,1 % – через 3 месяца терапии, в период последействия – на 47,36 % и на 57,89 % – на 5-м и 6-м визитах соответственно. Графически полученные данные представлены на рис. 1.
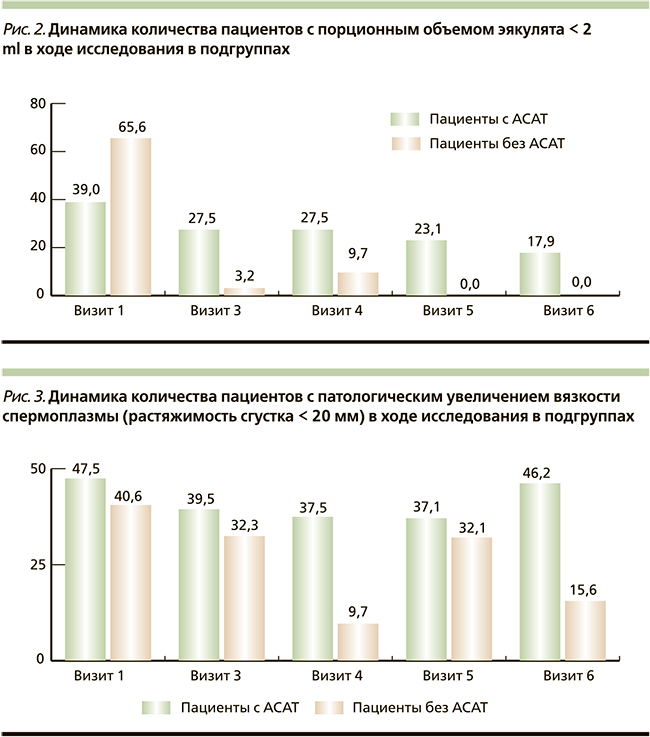
Была проанализирована динамика числа пациентов в ходе исследования, имевших клинически значимое снижение объема эякулята (< 2 мл). Выявлено, что на момент включения в исследование клинически значимое снижение объема эякулята имели 50,7 % пациентов общей группы, 39,0 и 65,6 % пациентов подгрупп с АСАТ и без АСАТ соответственно. Через 1,5 месяца терапии объем эякулята нормализовался у 66,66 % пациентов с исходно измененным показателем в общей группе, у 29,49 и 95,12 % пациентов подгрупп с АСАТ и без АСАТ соответственно. Данный эффект сохранялся через 3 месяца терапии, и в дальнейшем отмечен эффект последействия комплекса с нормализацией объема эякулята к окончанию исследования у 80,47 % пациентов с исходно измененным показателем в общей группе и у 54,1 и 100 % пациентов в подгруппах с АСАТ и без АСАТ соответственно. Графически полученные данные представлены на рис. 2. Был проведен анализ динамики числа пациентов с патологическим увеличением вязкости спермоплазмы (с растяжимостью сгустка < 20 мм) по визитам в подгруппах. Выявлено, что на момент включения в исследование патологическое увеличение вязкости спермоплазмы имели 44,4 % пациентов общей группы, 47,5 и 40,6 % пациентов подгрупп с АСАТ и без АСАТ соответственно. Под влиянием АндроДоза® через 1,5 месяца терапии вязкость спермоплазмы нормализовалась у 18,4 % пациентов с исходно измененным показателем в общей группе и у 16,8 и 20,4 % пациентов подгрупп с АСАТ и без АСАТ соответственно. Данный эффект усилился через 3 месяца терапии и был более выражен в группе пациентов без АСАТ (к окончанию терапии вязкость спермоплазмы нормализовалась у 18,4 % пациентов с исходно измененным показателем в общей группе, у 21,05 и 76,84 % пациентов подгрупп с АСАТ и без АСАТ соответственно). После окончания приема препарата вновь отмечено некоторое увеличение процента пациентов с повышенной вязкостью спермоплазмы, причем в подгруппе пациентов с АСАТ в первые 1,5 месяца после окончания приема АндроДоза® присутствовал эффект последействия с сохранением достигнутой нормальной растяжимости сгустка. Графически полученные данные представлены на рис. 3.
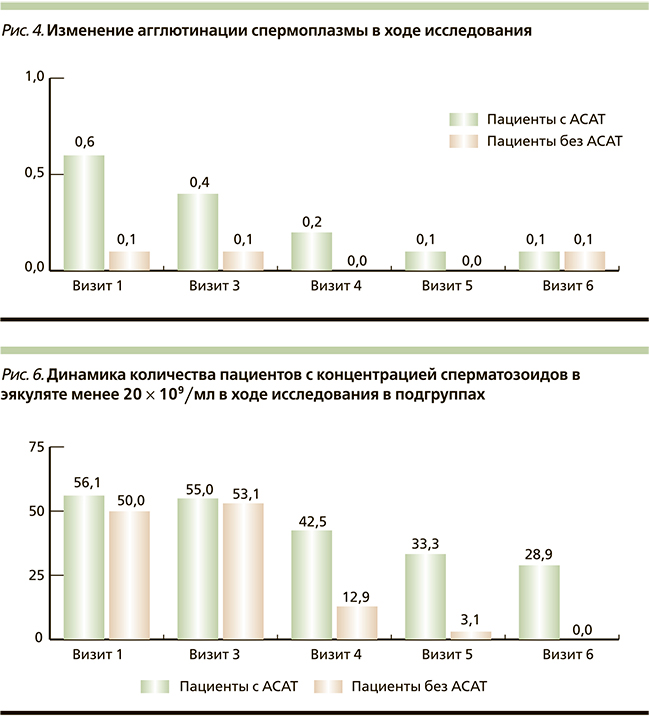
Перед началом исследования показатель агглютинации в общей популяции составил 0,4 + 0,5 балла с учетом того, что код «0» соответствовал ее отсутствию, а код «1» – слабой степени выраженности. Причем в группе пациентов с АСАТ агглютинация была на 82,4 % более выраженной, чем в группе пациентов без АСАТ. При исследовании уровня агглютинации сперматозоидов выявлено статистически значимое снижение уровня агглютинации в группе пациентов с АСАТ с 0,68 + 0,6 до 0,13 + 0,32 (р = 0,0001), т.е. на 80,1 % (р = 0,0001), причем после отмены терапии в течение 3 месяцев наблюдения эффект сохранялся – данные статистически достоверно не изменились, оставшись на том же уровне (р = 0,0001). Графически полученная информация представлена на рис. 4. В группе пациентов без АСАТ в целом агглютинация была изначально не выражена.
В ходе исследования было выявлено, что курсовой прием АндроДоза® статистически достоверно способствует повышению количества сперматозоидов в 1 мл эякулята. В наибольшей степени положительная динамика была выражена у пациентов с исходно клинически значимо сниженной концентрацией сперматозоидов (менее 20 × 109/мл). В данной популяции пациентов статистически достоверное повышение количества сперматозоидов в 1 мл эякулята (с 12,8 ± 4,2 × 109/мл до 17,7 ± 6,9 × 109/мл, p < 0,00001) состоялось уже через 1,5 месяца от начала приема препарата. Отмечено статистически достоверное увеличение выраженности эффекта с увеличением продолжительности терапии до 3 месяцев (повышение количества сперматозоидов в 1 мл эякулята до 21,6 ± 8,2 × 109/мл, p < 0,00001) с сохранением достигнутых показателей в последующем периоде наблюдения. Графически полученная информация представлена на рис. 5.
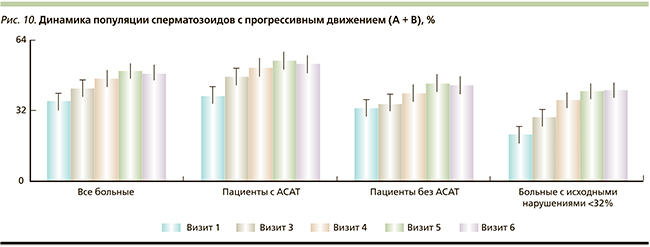
Был проведен анализ динамики числа пациентов с концентрацией сперматозоидов в эякуляте менее 20 × 109/мл по визитам в подгруппах. Выявлено, что на момент включения в исследование концентрация сперматозоидов в эякуляте составляла менее 20 ×109/мл у 53,4 % пациентов общей группы, 56,1 и 50,0 % пациентов подгрупп с АСАТ и без АСАТ соответственно. Под влиянием АндроДоза® положительная динамика была отмечена через 3 месяца терапии: концентрация сперматозоидов в эякуляте нормализовалась у 44,57 % пациентов с исходно измененным показателем в общей группе, эффект был более выражен в подгруппе пациентов без АСАТ, у 74,2 % из которых концентрация сперматозоидов в эякуляте нормализовалась к окончанию терапии, при том что в подгруппе с АСАТ данный показатель нормализовался у 24,24 %. После окончания приема АндроДоза® имел место эффект последействия с дальнейшей положительной динамикой: через 3 месяца после окончания терапии концентрация сперматозоидов в эякуляте нормализовалась у 48,48 и 100,00 % пациентов в подгруппах с АСАТ и без АСАТ соответственно. Графически полученные данные представлены на рис. 6.
По данным проведенного исследования выявлено повышение общего количества жизнеспособных сперматозоидов, статистически значимая динамика была выявлена в подгруппе пациентов с АСАТ (с 48,6 ± 14,0 % исходно, до 52,3 ± 12,6 % через 1,5 месяца терапии, p = 0,0098, и до 56 ± 3,1 % через 3 месяца терапии, p = 0,0006). В подгруппе пациентов без АСАТ отмечена тенденция к повышению общего количества жизнеспособных сперматозоидов (от 40,1 ± 19,2 до 43,1 ± 15,3 % и 45 ± 11,3 % через 1,5 и 3 месяца терапии, изменения статистически незначимы). Присутствовал эффект последействия с сохранением положительной динамики через 1,5 и 3 месяца после окончания терапии, статистически значимый в подгруппе пациентов без АСАТ и особенно выраженный в популяции пациентов с изначально сниженным количеством жизнеспособных форм (< 58 %) – в 1,36 раза.
Был проведен анализ динамики числа пациентов с исходным снижением жизнеспособности сперматозоидов (< 58 % жизнеспособных форм) по визитам в подгруппах. Выявлено, что на момент включения в исследование снижение жизнеспособности сперматозоидов наблюдалось у 70,4 и 88,9 % пациентов в подгруппах с АСАТ и без АСАТ соответственно. Под влиянием АндроДоза® произошла нормализация спермограмм по данному показателю через 1,5 месяца терапии с нарастанием эффекта через 3 месяца; эффект был более выражен в подгруппе с АСАТ и сохранялся в течение всего периода наблюдения (3 месяца после окончания приема комплекса): нормализация жизнеспособности сперматозоидов произошла через 1,5 и 3 месяца у 15,77 и 42,19 % пациентов с исходно измененным показателем в подгруппе пациентов без АСАТ и у 2,14 и 2,81 % пациентов с исходно измененным показателем в подгруппе пациентов с АСАТ.
К окончанию исследования число пациентов с нормальной жизнеспособностью сперматозоидов увеличилось в 2,29 раза (с 29,6 до 67,9 %) в подгруппе пациентов без АСАТ и в 1,95 (с 11,1 до 21,7 %) – в подгруппе пациентов с АСАТ по сравнению с изначальным числом пациентов с исходно измененным показателем. Графически полученные данные представлены на рис. 8.
При исследовании популяции активно подвижных сперматозоидов (категория А) было выявлено, что в исследуемых группах происходило статистически достоверное повышение общего количества активно подвижных сперматозоидов, причем к моменту завершения терапии суммарная прибавка в группе пациентов с АСАТ в 1,52 (с 15,3 ± 10,7 до 23,3 ± 12,4 при р < 0,00001) и в группе без АСАТ – в 1,56 раза (с 17,8 + 6,79 до 27,7 + 8,46 при р = 0,0001). Через 3 месяца после завершения терапии также было выявлено статистически достоверное увеличение общего количества сперматозоидов категории А в обеих исследуемых группах. Через 3 месяца после завершения терапии отмечено статистически достоверное сохранение эффекта в обеих исследуемых подгруппах. Графически полученные данные представлены на рис. 9.

При исследовании одного из главных критериев эффективности, популяции сперматозоидов с прогрессивным движением (категории А + В), были получены данные, свидетельствовавшие о статистически достоверном повышении популяции сперматозоидов категорий А + В в группе с АСАТ в 1,33 (с 38,87 + 18,48 до 51,7 ± 20,8 %, р < 0,00001), а в группе пациентов без АСАТ – в 1,22 раза (с 32,9 ± 12,7 до 40,0 ± 9,1, р = 0,00014). Наиболее выраженная положительная динамика была получена в популяции пациентов с исходно сниженной популяцией сперматозоидов с прогрессивным движением (< 32 %), где выявлено повышение показателя в 1,74 раза после окончания терапии по сравнению с исходным уровнем (с 21 ± 9 до 36,6 ± 12,3, р < 0,00001), причем эффект сохранялся и после окончания терапии. Графически полученные данные представлены на рис. 10.
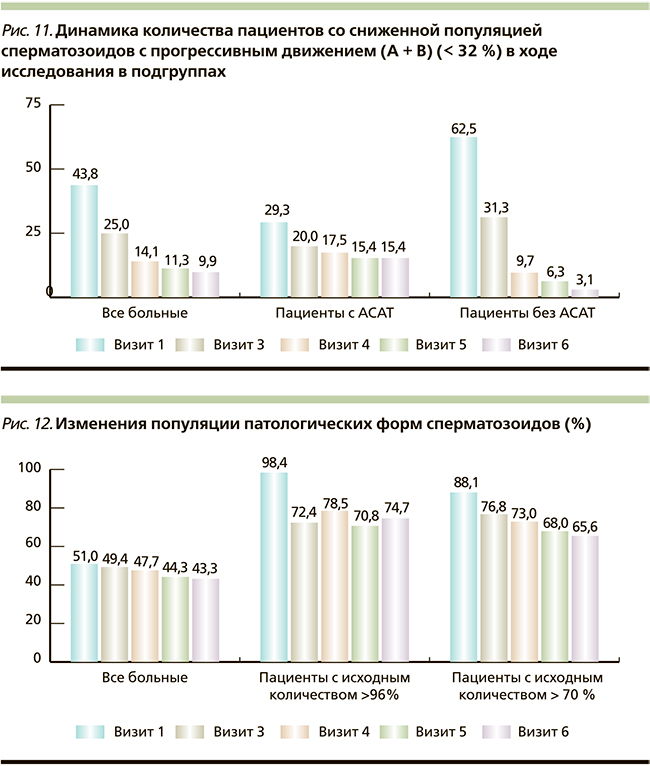
Был проведен анализ динамики числа пациентов со сниженной популяцией сперматозоидов с прогрессивным движением (А + В) (< 32 %) в ходе исследования подгрупп. Выявлено, что на момент включения в исследование нарушение по данному показателю спермограммы имели 29,3 % пациентов и 62,5 % пациентов подгрупп с АСАТ и без АСАТ соответственно. Под влиянием АндроДоза® через 1,5 месяца терапии популяция сперматозоидов с прогрессивным движением (А + В) восстановилась до нормальных показателей у 31,74 и 49,92 % пациентов в подгруппах с АСАТ и без АСАТ соответственно. Данный эффект усилился через 3 месяца терапии и был более выражен в группе пациентов без АСАТ (к окончанию терапии популяция сперматозоидов с прогрессивным движением (А + В) восстановилась до нормальных показателей у 40,27 и 84,48 % пациентов подгрупп с АСАТ и без АСАТ соответственно). После окончания приема АндроДоза® отмечен эффект последействия с дальнейшей положительной динамикой по данному показателю, наиболее выраженной в подгруппе пациентов без АСАТ (к окончанию исследования у 95,04 % пациентов выявлено восстановление популяции сперматозоидов с прогрессивным движением до уровня более 32 %).
Графически полученные данные представлены на рис. 11.
При исследовании общего количества патологических форм сперматозоидов к моменту завершения терапии АндроДозом® выявлено статистически значимое снижение количества патологических форм в обеих подгруппах, сохранившееся в период наблюдения и наиболее выраженное (на 26,32 % через 1,5 месяца терапии) в популяции пациентов с исходно повышенным содержанием патологических форм (> 96 %). Полученные данные графически представлены на рис. 12.
Выявлено, что на момент включения в исследование критическое количество патологических форм сперматозоидов (> 96 %) в эякуляте наблюдалось у 30 % пациентов в подгруппе без АСАТ. В подгруппе с АСАТ таких пациентов не было. К моменту завершения терапии у 100 % пациентов с исходным критическим количеством патологических форм имела место нормализация спермограмм по данному показателю с сохранением эффекта в течение всего периода наблюдения (рис. 13).
По данным проведенного исследования выявлено статистически достоверное повышение уровня Ингибина Б в группе пациентов без АСАТ, причем к моменту завершения терапии статистически достоверная прибавка составила 21,7 % (с 206 + 91,6 по 263 + 217 пг–мл, р = 0,04). Через 1,5 месяца после завершения терапии было выявлено дальнейшее статистически достоверное повышение уровня Ингибина Б, причем итоговая суммарная прибавка составила 27,2 % (до 283 + 225 пг/мл, р = 0,008). Через 3 месяца после завершения терапии было выявлено снижение базовой концентрации Ингибина Б в группе пациентов без АСАТ (относительно 5-го визита на 38,8 % до 173 + 56,8 пг/мл, при р = 0,01). Графически полученные данные представлены на рис. 15.
Согласно полученным данным, на фоне терапии АндроДозом® выявлено снижение уровня АСАТ в обеих группах пациентов с АСАТ (в категориях более 10 % и менее 10 % АСАТ), изменения были статистически достоверными в группе пациентов с АСАТ – более 10 % (снижение АСАТ в среднем на 26,5 %, p < 0,05) и сохранялись через 3 месяца терапии с сохранением достигнутого эффекта через 1,5 месяца наблюдения (рис. 15).
В ходе исследования через 3 месяца терапии АндроДозом® было выявлено статистически значимое повышение уровня общего тестостерона в подгруппе с АСАТ (на 22,7 %, p = 0,003) и тенденция к повышению тестостерона в общей группе и группе без АСАТ. После отмены терапии имелась тенденция к снижению данного показателя по сравнению с уровнем на фоне приема АндроДоза®, однако через 3 месяца наблюдения по-прежнему присутствовало некоторое повышение общего тестостерона относительно исходного уровня (на 15 %, p = 0,0007), рис. 16.
Изменения уровня других исследуемых гормонов (ГСПГ, ФСГ, Пролактин) были клинически и статистически незначимы.
При оценке эффективности проводимой терапии выявлено, что к моменту завершения лечебного курса у 64 пациентов был отмечен хороший и выраженный эффекты (87,6 % пациентов), при этом оценка «без перемен» была выставлена 8 (10,9 %) пациентам и у 1 пациента, по данным обследования, выявлено ухудшение на фоне проводимой терапии (1,36 %). Графически полученные данные представлены на рис. 17.
Через 3 месяца после завершения терапии было отмечено, что 89,1 % пациентов имели «выраженный» и «хороший» эффекты. Оценку «Без перемен» получили 8 (10,9 %) пациентов. Ухудшений выявлено не было.
При исследовании безопасности АндроДоза® выявлено, что на фоне приема в течение 3 месяцев в исследуемой популяции пациентов отмечены клинически незначимые статистически достоверные снижения средних уровней мочевины в биохимическом анализе крови (с 9,87 ± 13,79 до 6,02 + 0,99 ммоль/л, р = 0,019, уменьшение на 39,01 %), глюкозы (с 4,6 + 0,41 до 4,42 + 0,46 ммоль/л, р = 0,014, уменьшение на 4 %), в общем анализе мочи достоверно снизился базовый уровень белка (с 1,18 + 0,39 до 1,05 ± 0,23 балла, р = 0,015), рН (с 5,77 + 0,42 до 6,04 + 0,49, р = 0,0001) и лейкоцитов (с 1,76 + 0,62 до 1,5 + 0,55 балла, р = 0,008). Изменения остальных параметров общего анализа крови и мочи, биохимического анализа крови и уровня других исследуемых гормонов (ГСПГ, ФСГ, пролактин) были клинически и статистически незначимы.
В процессе наблюдения за пациентами ни одного нежелательного явления или побочных реакций выявлено не было. В процессе выполнения протокола исследования было выявлено 8 беременностей у партнерш пациентов обеих групп (10,9 %), 1 из которых завершилась выкидышем на сроке 6–7 недель, а 7 других прослежены до срока 5 месяцев и далее развивались благополучно. Соответственно, 8 пациентов завершили исследование по протоколу «Досрочное Завершение (ДЗ)» в связи с досрочным успешным завершением курса.
Обсуждение результатов
В клиническом исследовании участвовали 73 пациента. Согласно протоколу, все (100 %) пациенты успешно завершили исследование, из них 8 (10,95 %) завершили исследование в соответствии с протоколом досрочно в связи с наступлением беременности у партнерш.
По данным проведенного обследования выявлено статистически значимое увеличение объема эякулята в обеих подгруппах, начиная с 3-го визита (1,5 месяца терапии). Данный эффект усиливался с увеличением продолжительности терапии, сохранялся в период наблюдения и был наиболее выражен в популяции пациентов, имевших клинически значимое снижение объема эякулята (< 2 мл) на момент включения в исследование. Увеличение по сравнению с исходным уровнем произошло в среднем на 26,31 % через 1,5, на 42,1 % – через 3 месяца терапии, в период последействия – на 47,36 и на 57,89 % на 5-м и 6-м визитах соответственно. Отмечено, что через 1,5 месяца терапии объем эякулята нормализовался у 29,49 и 95,12 % пациентов с исходно измененным показателем в подгруппах с АСАТ и без АСАТ соответственно. Отмечен эффект последействия комплекса с нормализацией объема эякулята к окончанию исследования 54,1 и 100 % пациентов с исходно измененным показателем в подгруппах с АСАТ и без АСАТ соответственно.
Под влиянием АндроДоза® через 1,5 месяца терапии вязкость спермоплазмы нормализовалась у 16,8 и 20,4 % пациентов с исходно измененным показателем, через 3 месяца терапии – у 21,05 и 76,84 % пациентов с исходно измененным показателем в подгруппах с АСАТ и без АСАТ соответственно. После окончания приема препарата в подгруппе пациентов с АСАТ имел место эффект последействия первые 1,5 месяца после окончания приема АндроДоза® с сохранением достигнутой нормальной растяжимости сгустка.
На фоне проведенного курса зафиксировано статистически достоверное снижение агглютинации у пациентов с АСАТ на 80,1 % (р = 0,0001), причем после отмены терапии в течение 3 месяцев наблюдения эффект сохранялся – данные статистически достоверно не изменились, оставшись на том же уровне (р = 0,0001). У пациентов без АСАТ нарушения агглютинации изначально не были выражены.
По всей видимости, подобные изменения связаны с тем, что на фоне значимых концентраций АСАТ серьезно страдает подвижность сперматозоидов и прием АндроДоза® способствует восстановлению подвижности за счет антиоксидантной активности комплекса, уменьшая вязкость спермоплазмы и агглютинацию сперматозоидов. Кроме того, вязкость и агглютинация повышаются, если спермоплазма смешивается с воспаленным секретом простаты (Камалов А.А., Лопаткин Н.А., 2008). Несмотря на то что в наше исследование не были включены пациенты с воспалительными изменениями уровня лейкоцитов в эякуляте (одним из основных симптомов простатита) и учитывая подобные эффекты АндроДоза®, его можно рекомендовать в качестве вспомогательного средства для коррекции нарушений сперматогенеза, обусловленных простатитом.
В ходе исследования выявлено, что курсовой прием АндроДоза® статистически достоверно способствует повышению количества сперматозоидов в 1 мл эякулята. Данный эффект наиболее выражен у пациентов с исходно клинически значимо сниженной концентрацией сперматозоидов (менее 20 × 109/мл) и отмечается уже через 1,5 месяца от начала приема препарата с нарастанием выраженности эффекта при увеличении продолжительности терапии до 3 месяцев (повышение количества сперматозоидов в 1 мл эякулята в 1,68 раза, p < 0,00001) с сохранением достигнутых показателей в последующем периоде наблюдения. Под влиянием АндроДоза® в группе без АСАТ концентрация сперматозоидов в эякуляте нормализовалась у 74,2 % пациентов с исходно измененным показателем, при том что в подгруппе с АСАТ данный показатель нормализовался у 24,24 %. После окончания приема АндроДоза® отмечен эффект последействия с дальнейшей положительной динамикой: через 3 месяца после окончания терапии концентрация сперматозоидов в эякуляте нормализовалась у 48,48 и 100,00 % пациентов подгрупп с АСАТ и без АСАТ соответственно.
В исследуемых подгруппах произошло статистически достоверное повышение как общего количества активно подвижных сперматозоидов (категория А) с суммарным приростом в 1,52–1,56 раза, так и популяции сперматозоидов с прогрессивным движением (категории А + В) – в 1,22–1,33 раза, сопоставимое в обеих подгруппах, с достоверным сохранением эффекта в период наблюдения. Наиболее выраженная положительная динамика наблюдалась у пациентов с исходно сниженной популяцией сперматозоидов с прогрессивным движением (< 32 %), где выявлено повышение показателя в 1,74 раза после окончания терапии (по сравнению с исходным уровнем).
Под влиянием АндроДоза® через 1,5 месяца терапии популяция сперматозоидов с прогрессивным движением (А + В) восстановилась до нормальных показателей у 31,74 и 49,92 % пациентов подгрупп с АСАТ и без АСАТ соответственно. Данный эффект усилился через 3 месяца терапии и был более выражен в группе пациентов без АСАТ (у 40,27 и 84,48 % пациентов подгрупп с АСАТ и без АСАТ соответственно). После окончания приема АндроДоза® отмечен эффект последействия с дальнейшей положительной динамикой по данному показателю, наиболее выраженной в подгруппе пациентов без АСАТ (к окончанию исследования у 95,04 % пациентов выявлено восстановление популяции сперматозоидов с прогрессивным движением до уровня более 32 %).
Таким образом, курсовой прием АндроДоза® существенно изменяет сперматологическую картину, повышая долю сперматозоидов с прогрессивным движением. По-видимому, это связано с мощными антиоксидантными свойствами АндроДоза®, а также с восстановлением энергетических потерь сперматозоидов, существенно сказывающихся на их подвижности.
К моменту завершения терапии АндроДозом® выявлено статистически значимое снижение количества патологических форм в обеих подгруппах, сохраняющееся в период наблюдения и наиболее выраженное (на 26,32 % через 1,5 месяца терапии, р = 0,0001) в популяции пациентов с исходно повышенным содержанием патологических форм (> 96 %). К моменту завершения терапии у 100 % пациентов с исходным критическим количеством патологических форм (такие пациенты были лишь в подгруппе без АСАТ и составили 30 % от подгруппы) отмечена нормализация спермограмм по данному показателю с сохранением эффекта в течение всего периода наблюдения. Данный эффект может быть связан со способностью АндроДоза® при курсовом приеме предупреждать негативное влияние оксидативного стресса на сперматогенез.
На фоне приема АндроДоза® выявлено статистически достоверное повышение уровня Ингибина Б в группе пациентов без АСАТ (на 21,7 %, р = 0,04), что также может свидетельствовать о способности данного комплекса восстанавливать сперматогенез и способствовать нормализации структуры тестикулярной ткани.
На фоне терапии АндроДозом® снижение уровня АСАТ (в среднем на 26,5 %) было статистически достоверным в наиболее клинически значимой подгруппе пациентов с АСАТ более 10 %, эффект последействия сохранялся 1,5 месяца после отмены терапии. Полученные результаты могут свидетельствовать о возможном благоприятном влиянии АндроДоза® на исходно нарушенный иммунологический статус пациентов с патоспермией.
Отмеченное в ходе исследования статистически значимое повышение уровня общего тестостерона в подгруппе с АСАТ (на 22,7 %, p = 0,003) и тенденция к повышению данного показателя в другой подгруппе свидетельствуют о возможности данного комплекса способствовать нормализации и поддержанию выработки тестостерона. Таким образом, АндроДоз® возможно использовать в качестве средства «эмпирической терапии» первой линии при идиопатической тератозооспермии. По своему составу он в достаточной степени универсален для того, чтобы максимально обширно воздействовать на поврежденные элементы патогенеза образования сперматозоидов.
На фоне приема АндроДоза® существенных клинически и статистически значимых колебаний параметров анализов крови и мочи не выявлено, что свидетельствует о хорошем профиле безопасности препарата при проведении курсового приема в течение 3 месяцев.
Заключение
Курсовое назначение АндроДоза® при различных вариантах патоспермии у мужчин оказывает ряд положительных эффектов, за счет которых статистически достоверно улучшается качественный состав эякулята у пациентов с патоспермией, что в целом заслуживает положительной оценки терапии, которая была выявлена у 87,6 % пациентов.
Препарат показал себя эффективным и безопасным средством лечения инфертильности и патоспермий различных типов (как с наличием иммунологического фактора инфертильности, так и без него), с высокой степенью достоверности полученных результатов.



