Актуальность
Увеличение числа больных хроническими сочетанными стенозами гортани и трахеи обусловлено прежде всего ростом травматизации возвратных гортанных нервов при проведении сложных операций на органах головы и шеи, длительной искусственной вентиляции легких, транспортных происшествий с многочисленными тяжелыми черепно-мозговыми травмами и ранениями органов шеи [1, 2]. Разработка новых способов реконструктивных вмешательств при паралитических и сочетанных стенозах гортани и трахеи до настоящего времени остается актуальной задачей.
Основной целью открытых реконструктивно-восстановительных операций на гортани и трахее стало восстановление адекватного просвета респираторного пути с формированием ларинготрахеального дефекта (ЛТД) и последующим длительным стентированием гортани и трахеи. На заключительном этапе хирургической реабилитации производится пластическое закрытие ЛТД [3, 4].
Выбор метода пластического закрытия ЛТД обусловлен прежде всего его размером, площадью дыхательного просвета, а также состоянием слизистой оболочки трахеи и кожи в области дефекта. Устранение обширных дефектов гортани и трахеи путем использования кожно-мышечной пластики по классической методике без использования опорных материалов не всегда бывает достаточным. При последней – в послеоперационном периоде нередко создаются условия для западения и патологической флотации вновь сформированной передней стенки трахеи и респираторного стеноза, что диктует необходимость применения каркасных тканей для закрытия таких дефектов [5–8].
Имплантирование различных искусственных материалов не приводит к полноценной эпителизации гортани и трахеи и в последующем, как правило, сопровождается ростом грануляций в просвете последних, инфицированием, воспалительной реакцией местных тканей и отторжением имплантов [8–10].
Реберный хрящ является перспективным материалом для аутотрансплантации и используется для восстановления дефекта хряща носовой перегородки, ушной раковины, колец трахеи и др. Прочность реберного хряща, однородность его свойств, а также простота его извлечения у донора с минимальной инвазивностью и достаточно большим объемом донорского материала обусловливают возможность применения данного аутотрансплантата в современной реконструктивной хирургии органов шеи. Пластины реберного хряща толщиной от 1 до 3 мм могут применяться в ларинготрахеопластике и пластическом закрытии ЛТД [11].
Изучив литературные данные, мы пришли к выводу: для пластики стойких ЛТД предпочтительнее применение собственных тканей организма.
В зависимости от размера ЛТД предпочтение отдается реберному аутохрящу, хрящам ушной раковины и носовой перегородки, которые в отличие от аутоконсервантов лучше приживаются, реже лизируются и позволяют создавать стойкий герметичный просвет органов шеи [11–14].
Таким образом, применение собственной хрящевой ткани пациента представляется оптимальным, однако в литературе описаны случаи ее избыточного лизиса и резорбции [13, 14]. Также в большинстве случаев хрящевые импланты не могут принимать форму полых органов шеи.
В связи с этим нами было впервые проведено экспериментальное исследование, целью которого стали разработка и внедрение в практику способа пластики ЛТД с использованием моделированного эрбиевым лазером реберного аутохряща.
На основании теоретических расчетов и их экспериментальной проверки, описанных в работах российских исследователей, выбирались оптимальные параметры лазерного воздействия. При этом за основу были взяты параметры лазера, используемые в операции лазерной септохондрокоррекции [15, 16].
Методы
Исследование одобрено локальным этическим комитетом Сеченовского Университета Минздрава РФ (№ 05-17 14.06.2017).
В первой части данной работы (2014–2016) нами проведено экспериментальное исследование на 10 лабораторных кроликах породы шиншилла. В эксперименте проводился подбор оптимальных безопасных режимов воздействия на хрящевую ткань. Подобранные режимы позволяют придавать необходимую форму хрящу без нарушения ее структуры и биологических свойств.
Первым этапом производился забор ребра кролика-донора, после чего проводилось его моделирование на контакторе эрбиевого лазера. После достижения необходимой формы производилось имплантирование трансплантата к грудной клетке кролика-реципиента. Животные наблюдались 14–16 недель. Далее проводилась оценка стабильности формы полученного трансплантата и его гистологическое исследование.
Полученные морфологические результаты показали высокие регенераторные возможности хрящевой ткани при фиксации моделированного хряща к интактному, что крайне важно при дефиците собственного хряща гортани и трахеи. Впервые было экспериментально обосновано применение лазерного формообразования хрящевой ткани на животной модели [16].
Полученные данные экспериментальной работы позволили разработать новую методику пластического закрытия ЛТД [17].
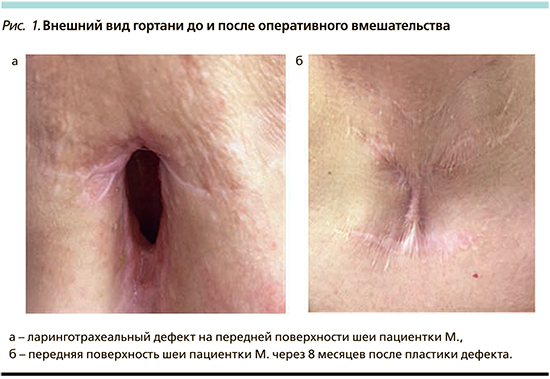
С целью решения поставленной задачи разработки методики создания прочного каркасного материала для пластического закрытия дефекта гортани и трахеи 10 пациентам c обширными ЛТД выполнено оперативное вмешательство с использованием моделированного реберного хряща (рис. 1). Клиническое исследование проводилось в период с 2017 по 2018 г.
 Первым этапом производился забор 3 хрящевых полосок реберной дуги пациента толщиной 0,5±0,1 см, длиной 3±0,5 см, шириной 1,5±0,5 см. Затем выполнялось моделирование одного из полученных хрящевых фрагментов контактором эрбиевого лазера длиной волны 1,56 мкм (излучение доставлялось оптотермомеханическим контактором в импульсном режиме с общим временем облучения каждой точки 6 секунд, мощность – 2,2 Вт) по разработанной методике до получения стабильной полукруглой формы (рис. 2). Лазерные точки были распределены по всей площади хряща, диаметр лазерного пятна составил 2,5 мм, длительность импульса – 500 мc, частота повторения импульсов – 1,4 Гц.
Первым этапом производился забор 3 хрящевых полосок реберной дуги пациента толщиной 0,5±0,1 см, длиной 3±0,5 см, шириной 1,5±0,5 см. Затем выполнялось моделирование одного из полученных хрящевых фрагментов контактором эрбиевого лазера длиной волны 1,56 мкм (излучение доставлялось оптотермомеханическим контактором в импульсном режиме с общим временем облучения каждой точки 6 секунд, мощность – 2,2 Вт) по разработанной методике до получения стабильной полукруглой формы (рис. 2). Лазерные точки были распределены по всей площади хряща, диаметр лазерного пятна составил 2,5 мм, длительность импульса – 500 мc, частота повторения импульсов – 1,4 Гц.
Облучение начиналось в центральной части хрящевого образца, после чего лазерный луч перемещался по направлению к дистальным концам. Расстояние между лазерными точками составило 2 мм, расстояние между рядами точек – 3 мм.
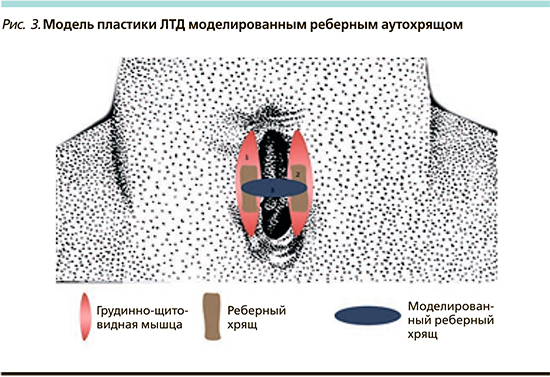
Вторым этапом выполнялся окаймляющий разрез кожи: отступ от края ЛТД – 1 см. Отсепарованный кожный лоскут укладывался, образуя переднюю стенку трахеи, и ушивался по средней линии пятью Z-образными швами нитями Викрил 3,0. В сформированные мышечные ложа грудино-щитовидной мышцы помещали два необлученных фрагмента хряща длиной 2,5±0,5 см и толщиной 0,3±0,5 см в вертикальном положении и прошивали по дистальному краю с мышцами нитями PDS 2–0. Смоделированный лазером хрящевой фрагмент длиной 2,5±0,5 см подшивали с двух сторон к медиальным краям необлученных фрагментов хряща. Кожу вокруг дефекта отсепаровывали и третьим слоем сопоставляли по средней линии над сформированным мышечным слоем; для мышечных и кожных швов применяли нити Викрил 3,0 (рис. 3).
После экстубации дыхание через естественные дыхательные пути было свободным. В послеоперационном периоде пациентам проводилась антибактериальная и противоотечная терапия, ингаляции комбинированных препаратов с антибактериальным и муколитическим действием. Послеоперационный период протекал без осложнений, на 10-е сутки удаляли кожные швы.
Всем пациентам через 6 месяцев после операции проводили фиброларинготрахеоскопию, ларингостробоскопию, мультиспиральную компьютерную томографию органов шеи, по данным которой отмечалась визуализация боковых фрагментов аутохряща и аутотрансплантата в проекции дуги перстневидного хряща и первого кольца трахеи. Форма аутотрансплантата не претерпела изменений, хрящевая ткань не лизировалась (рис. 4).
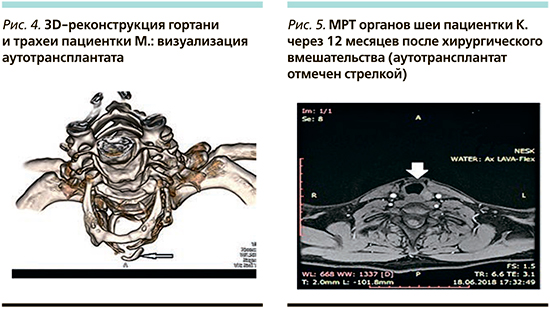
Через 12 месяцев после операции выполнялась магнитно-резонансная томография (МРТ) органов шеи, по результатам которой отторжения или резорбции моделированного эрбиевым лазером хрящевого импланта не выявлено, плотность аутотрансплантата идентична плотности щитовидного хряща вне очагов кальцинации (рис. 5).
В раннем послеоперационном периоде (в течение 14 дней после операции) у 4 пациентов отмечались местные воспалительные явления, у 1 – подкожная эмфизема. В отдаленном послеоперационном периоде ни у одного из пациентов не было выявлено патологических реакций местных тканей на имплантацию, западения и флотирования передней стенки гортани и трахеи с рестенозированием просвета последних.
При проведении фиброларинготрахеоскопии и ларингостробоскопии просвет дыхательной щели составлял 7−8 мм и соответствовал стадии компенсации стеноза гортани.
Таким образом, разработанный способ пластики стойкого дефекта гортани и трахеи с использованием моделированного эрбиевым лазером реберного аутохряща [17] был клинически применен к 10 пациентам и внедрен в практику отоларингологического отделения Сеченовского Университета.
Обсуждение
Существующие многочисленные способы пластики дефектов передней стенки гортани и трахеи с применением биологических ауто- и аллотрансплантатов (хрящи, мышцы, кожные лоскуты) и искусственных материалов (никелид титана, марлекс, силикон, танталовые и капроновые сетки и др.) не всегда отвечают необходимым требованиям к пластике по своим биоинертным свойствам и неспособности восстанавливать форму полых органов шеи [6, 7].
Собственная хрящевая ткань пациента наиболее оптимальна при пластике ЛТД, несмотря на описанные случаи ее резорбции [13, 14]. Однако хрящевые импланты далеко не всегда принимают необходимую форму дыхательного просвета. Предложенный нами способ позволяет устранять обширные дефекты гортани и трахеи одноэтапно за счет моделирования реберного аутохряща эрбиевым лазером (λ=1,56 мкм),
который фиксируется к двум необлученным реберным фрагментам, имплантированным в грудинощитовидную мышцу. Методика позволяет обеспечивать аутотрансплантату необходимую стойкую форму полукольца и избегать его резорбции, а также снижать риск развития рестеноза и послеоперационных осложнений у больных хроническими стенозами гортани и трахеи после заключительного этапа хирургической реабилитации.
Заключение
Таким образом, разработанная и экспериментально обоснованная методика пластики ЛТД дает возможность восстанавливать анатомическую целостность дыхательных путей, обеспечивать функциональную состоятельность и анатомическую форму просвета гортани и трахеи, предотвращать лизис хрящевого аутотрансплантата и патологическую флотацию вновь сформированной передней стенки гортани и трахеи в отдаленном послеоперационном периоде.



