Миома матки является одной из наиболее распространенных доброкачественных опухолей женских половых органов, состоящей из гладкомышечных клеток миометрия [1]. Частота встречаемости у женщин репродуктивного возраста составляет 20–40%. Обращает на себя внимание тот факт, что в возрасте моложе 30 лет данное заболевание отмечается у 3,3–7,8% случаев [1, 2].
Несмотря на длительную историю изучения, вопрос о тактике ведения больных с миомой матки, находящихся в репродуктивном возрасте, продолжает оставаться в центре внимания отечественных и зарубежных исследователей [3–6].
Установлено, что миома матки встречается у каждой четвертой пациентки (23,5%) с бесплодием, при этом первичное бесплодие выявляется в 18–24% случаев, вторичное – в 25–56%. Это влечет за собой ежегодный рост числа органосохраняющих пластических операций на матке [3–5].
Спаечная болезнь брюшной полости и органов малого таза занимает одно из ведущих мест в структуре осложнений абдоминальной хирургии и гинекологии [7–10]. Формирование спаек брюшной полости и малого таза часто отмечается в послеоперационном периоде. Известным является тот факт, что проблема спаечного процесса в практике врача акушера-гинеколога является особенно актуальной, так как его развитие приводит не только к ухудшению качества жизни пациенток, но и к возникновению трубно-перитонеального бесплодия у женщин репродуктивного возраста в 15–20% случаев [4, 5, 8, 10].
По данным отечественной и зарубежной литературы, лапароскопическая хирургия, в сравнении с открытыми операциями, практически не снижает частоту и распространенность спаечного процесса [7, 11, 12].
Это диктует необходимость проведения профилактики спайкообразования как этапа реабилитации репродуктивной функции после миомэктомии. Учитывая современные тенденции в хирургии, наиболее перспективным направлением в этой области является применение специальных противоспаечных средств, основной принцип действия которых заключается во временном разобщении раневых поверхностей на период наиболее интенсивного заживления тканей (первые 5–7 дней после оперативного вмешательства) [3, 5].
Среди барьерных противоспаечных средств выделяют противоспаечные гели и противоспаечные мембраны, которые отличаются по своему составу и способу применения [7]. Следует отметить, что мембраны имеют ограниченный размер, в связи с этим часто требуется несколько таких мембран для покрытия желаемой зоны операционного поля [7, 8]. При этом их сложно фиксировать к желаемому месту, особенно при сложной конфигурации поверхностей. Использование гелевых форм противоспаечных средств является наиболее предпочтительным в хирургии органов брюшной полости и малого таза, так как гель равномерно распределяется по поверхности, заполняя собой все конгруэнтные области. Кроме того, гели просты в использовании. Их введение приводит к образованию тонкой невидимой пленки на поверхности органа, которая выполняет функцию противоспаечного барьера на время интенсивного заживления тканей [7, 8].
В настоящее время особого внимания в профилактике спайкообразования в гинекологической практике заслуживает противоспаечный барьер Антиадгезин (АО «Нижфарм») .
Антиадгезин – противоспаечный гель с уникальным составом, основными действующими веществами которого являются натриевая соль гиалуроновой кислоты и натрия карбоксиметилцеллюлоза [7]. Противоспаечное действие гиалуроновой кислоты реализуется на ранней стадии спайкообразования (первые 3–4 дня) – путем подавления адгезии фибробластов и тромбоцитов, активности макрофагов, а также посредством ингибирования образования фибрина и создания защитного барьера в виде биологической пленки на поврежденном участке ткани. Период полураспада гиалуроновой кислоты в организме составляет около 1–3 дней. Она полностью расщепляется в организме ферментом гуалуронидазой в течение четырех суток [7]. Добавление к гиалуроновой кислоте карбоксиметилцеллюлозы, которая также обладает барьерным противоспаечным действием и имеет стабилилизирующее, смягчающее, пленкообразующие свойства, способствует образованию вязкого геля, отделяющего серозные поверхности в течение периода наиболее интенсивной регенерации тканей. Механизм действия карбоксиметилцеллюлозы также реализуется за счет подавления активности фибробластов и предотвращения депонирования фибрина на поврежденной серозной поверхности, происходит замедление движения активированных клеток, направляющихся в очаг воспаления. Важным является тот факт, что карбоксиметилцеллюлоза служит в качестве субстрата для закрепления и пролонгирования действия гиалуроновой кислоты на поверхности ткани, так как в организме человека отсутствуют специальные ферменты, расщепляющие карбоксиметилцеллюлозу. Последняя, элиминируется из организма путем постепенного лизиса и поглощения фрагментов макрофагами [7]. Кроме того, она не токсична, не канцерогенна и не дает эмбриотоксического эффекта.
Цель исследования: оценка эффективности раннего этапа реабилитации репродуктивной функции у пациенток после миомэктомии.
Материалы и методы исследования
Проведено обследование 84 пациенток в возрасте от 18 до 45 лет с миомой матки, поступивших на плановое оперативное лечение в гинекологическое отделение ГБУЗ «Волгоградский областной клинический перинатальный центр №2» г. Волгограда за период с 2015 по 2018 гг.
Критериями включения в исследование явились: возраст от 18 до 45 лет; наличие показаний к выполнению миомэктомии; заинтересованность женщины в выполнении репродуктивной функции; наличие информированного согласия на проведение диагностических и лечебных мероприятий. Критериями исключения явились: возраст младше 18 лет и старше 45 лет; наличие миомы матки, не требующей проведение оперативного лечения; миома матки, подлежащая удалению путем гистерорезектоскопии.
Изучали жалобы обследуемых пациенток, данные анамнеза, особенности менструальной и репродуктивной функции, обращали внимание на перенесенные экстрагенитальные и гинекологические заболевания.
Согласно протоколу исследования всем пациенткам исходно, через 3, 6 и 12 месяцев после оперативного лечения было выполнено трансвагинальное ультразвуковое сканирование (определяли топографию органов малого таза; размеры и особенности структуры тела матки и яичников; подвижность матки и яичников; а также петель кишечника относительно органов малого таза и париетальной брюшины; обращали внимание на косвенные признаки спаечного процесса органов малого таза: хронические воспалительные изменения, линейные гиперэхогенные структуры неправильной формы, наличие свободной жидкости в малом тазу и брюшной полости); пайпель биопсия эндометрия с последующим гистологическим исследованием. При подозрении на патологию эндометрия или наличие узлов, деформирующих полость матки (субмукозных или интрамуральных с центрипетальным ростом) по данным эхографического исследования, выполняли гистероскопию. Метросальпингографию проводили все обследуемым пациенткам через 6 месяцев после операции.
Кроме того, наряду с общепринятыми методами исследования, перед миомэктомией и через шесть месяцев после хирургического вмешательства, изучали состояния аутоиммунитета методом твердофазного иммуноферментного анализа с использованием специальных наборов реагентов (ЭЛИ-П-Комплекс, производство Медицинского иммунологического центра «Иммункулус», г. Москва). Данный набор применяется для полуколичественного определения регуляторных аутоантител (АутоАТ) класса IgG в сыворотке крови обследуемых пациенток. Особое внимание обращали на уровень аутоАТ к Коллагену, являющимся маркером рубцово-спаечных процессов в брюшной полости и органах малого таза [13].
В настоящее время изучение уровня аутоАТ у пациенток со спаечной болезнью в гинекологической практике является предметом научного поиска. Так, согласно результатам исследования Колесник Н.А. (2012), спаечная болезнь органов малого таза у женщин с бесплодием трубно-перитонеального генеза сопровождается дисбалансом показателей аутоиммунитета. Автором выявлена прямая зависимость между типом иммунореактивности и выраженностью спаечного процесса в полости малого таза. У нормореактивных пациенток отмечена незначительная степень спаечного процесса и наибольший процент наступления беременности. В то время как снижение в сыворотке крови уровня регуляторных аутоАТ, коррелирует с умеренной и выраженной степенью спаечного процесса, что является неблагоприятным фактором для восстановления репродуктивного здоровья. Данные Мананниковой Н.Н, Попова А.А. и соавт. (2012) свидетельствуют о том, что применение противоспаечных препаратов как этап хирургического лечения пациенток с трубно-перитонеальным бесплодием минимизирует спаечный процесс и улучшает результаты восстановления естественной фертильности [14].
Оценка результатов, полученных в ходе настоящего исследования, выполнялась в соответствии с алгоритмом, предоставленным производителем набора реагентов производства Медицинского иммунологического центра «Иммункулус», г. Москва). Границы физиологического уровня аутоАТ к используемым антигенам находятся в диапазоне от -20% до +10% от уровня средней индивидуальной иммунореактивности; пограничные (умеренные) отклонения уровня аутоантител: от +11% до + 20% и от -21% до -30%. Достоверными принято считать отклонения, которые находятся в диапазоне: более +20% и менее -30% [13]. Результаты, полученные в ходе настоящего исследования, сравнивались с уровнем аутоантител у 30 здоровых женщин репродуктивного возраста, которые составили контрольную группу.
В ходе миомэктомии использовали лапароскопический или лапаротомный доступ. Миомэктомию лапароскопическим доступом выполняли при наличии единичных или множественных субсерозных узлов, а также в случае выявления единичных интерстициальных узлов, расположенных в дне матки. От лапароскопического доступа отказывались при выявлении низкого расположении узлов или шеечно-перешеечных узлов, расположенных по передней или задней стенки матки, при интрамуральных узлах с центрипетальным ростом, деформирующих полость матки, а также при наличии выраженной спаечной болезни брюшной полости и малого таза.
Лапаротомическую миомэктомию выполняли у пациенток с множественными миоматозными узлами, при наличии больших размеров узлов, при интерстициальных узлах с центрипетальным ростом, субмукозных узлах 0 и 1 типа, размерами более 5 см. Следует отметить, что при выборе направления разрезов на матке, мы обращали внимание на их локализацию, количество, глубину расположения, архитектонику миометрия и сосудов. В ходе энуклеации миоматозых узлов отдавали предпочтение поперечным разрезам на матке. Ложе узлов ушивали двумя рядами рассасывающихся швов.
На заключительном этапе как лапароскопической, так и лапаротомической операции после миомэктомии, на область послеоперационного рубца наносили противоспаечный рассасывающийся гель Антиадгезин (5 г).
После проведенной миомэктомии всем пациенткам назначали агонист ГнРГ в течение 4–6 месяцев (с учетом индивидуальной переносимости препарата). Согласно данным литературы, большинство авторов высказывается в пользу назначения в послеоперационном периоде после миомэктомии данной группы препаратов. Известно, что лечебный эффект агонистов ГнРГ реализуется посредством воздействия не только на эндокринную, но также и на аутокринную / паракринную систему. Доказано влияние агонистов ГнРГ на факторы роста, пролиферативный потенциал, апоптоз и ангиогенез, следствием чего является снижение риска рецидивирования миомы матки [15].
С целью оценки степени выраженности спаечного процесса, состояния маточных труб, а также репродуктивного прогноза когорты пациенток, у которых в течение года после операции беременность не наступила, проводилась повторная диагностическая или лечебная лапароскопия (Second look). Кроме того, эффективность применения противоспаечного рассасывающегося геля с оценкой степени выраженности спаечного процесса проводилась в ходе операции кесарева сечения. Степень спаечного процесса оценивали по классификации J. Hulka (1998 г.) и Американского общества фертильности (AFS, 1988).
Статистическая обработка полученных данных проводилась методом вариационной статистики и выполнялась с помощью программы Microsoft Excel, а также статистического пакета Statgraphics. Для количественных параметров были определены: среднее значение (М), среднеквадратичное отклонение (σ), ошибка среднего по выборке (m), медиана (Ме), 95% доверительный интервал; для качественных данных – частота (%). При изучении различий в значениях количественного признака по нескольким группам, образованных на основе качественного фактора, использовались инструменты дисперсионного анализа. Достоверность различий сопоставляемых средних величин определялась по параметрическому критерию Стьюдента. Статистически значимыми считались отличия при p<0,05 (95% уровень значимости) и при p<0,01 (99% уровень значимости). Для изучения связи между показателями проводился корреляционный анализ с вычислением коэффициента корреляции Пирсона с последующим установлением его значимости по t-критерию Стьюдента.
Результаты исследования и их обсуждение
В ходе исследования установлено, что в возрасте от 18 до 25 лет находилось 12 (14,3%) пациенток; в 37,5% случаев возраст пациенток колебался от 26 до 35 лет, при этом каждая вторая пациентка (50%) была в возрасте от 36 до 45 лет. Средний возраст обследуемых составил 34,21±0,81 года.
Результаты проведенного исследования свидетельствую о том, что в подавляющем большинстве случаев пациентки предъявляли жалобы на различные нарушения менструального цикла. Установлено, что аномальные маточные кровотечения по типу обильных менструальных кровотечений (ОМК) диагностированы у 71 (84,5%) больных, при этом, у 31 (36,9%) из них менструации были длительными. Межменструальные кровотечения выявлены в 57,1% случаев. Дисменорея наблюдалась у 60 (71,4%) пациенток. Выявлено, что каждая вторая обследуемая (52,4%) отмечала тянущие боли внизу живота; нарушения функции соседних органов диагностированы у 17 (20,2%) больных. Следует отметить, что у каждой второй обследуемой (52,4%) выявлено сочетание двух и более жалоб, при этом отсутствие жалоб диагностировано лишь у 14,3% больных.
Из данных анамнеза установлено, что длительность течения заболевания составила от 1 года до 12 лет.
В ходе исследования установлено, что только у 25 (29,8%) больных менструация наступала от 12 до 14 лет, в то время как практически у половины обследуемых с миомой матки (48,8%) выявлено раннее менархе. Обращает на себя внимание тот факт, что у каждой пятой пациентки (21,4%) наступление первой менструации запаздывало, и менархе начиналось после 14 лет
Выявлено, что 29 (34,5%) пациенток с миомой матки страдали бесплодием, при этом первичное бесплодие выявлено у 11 (13,1%) женщин, а вторичное бесплодие – у 18 (21,4%) больных.
По данным анамнеза установлено, что в когорте обследуемых пациенток только в 63,1% случаев ранее была назначена гормональная терапия (агонистами ГнРГ, КОК, антагонистами прогестерона, Улипристал ацетатом). У каждой третьей пациентки (29,8%) несмотря на проводимое терапию отмечено прогрессирование симптомов миомы матки (рост миоматозных узлов, усиление болевого синдрома, рецидивирующие кровотечения и нарушение функции соседних органов). Из 84 обследованных больных 31 (36,9%) пациентка ранее не получала гормональной терапии ввиду наличия сопутствующей экстрагенитальной патологии или при впервые выявленной симптомной миоме матки, диктующей необходимость проведения планового оперативного вмешательства. Установлено, что миомэктомия в анамнезе была проведена у 9 (10,7%) пациенток: лапароскопическим доступом – у 3 больных и в 7,1% случаев – лапаротомически.
Таким образом, нами установлено, что пациентки с миомой матки имели большую длительность заболевания и выраженность клинических симптомов, что определило тяжесть течения данной патологии.
В структуре экстрагенитальной заболеваемости у пациенток с миомой матки лидирующее положение занимала патология органов желудочно-кишечного тракта, которая была представлена хроническими воспалительными заболеваниями желудка и двенадцатиперстной кишки (28,6%) и патологией гепатобилиарной системы, диагностируемой у 12 (14,3%) больных. Заболевания органов сердечно-сосудистой системы встречались у каждой третьей пациентки (38,1%). Особое место в структуре экстрагенитальной заболеваемости занимала патология эндокринной системы, которая была выявлена в 31% случаев. Практически каждая пятая пациентка страдала ожирением (19%), патология щитовидной железы встречалась у 8,3% женщин.
В ходе проведенного исследования у всех пациенток с миомой матки установлено выраженное иммунодепрессивное состояние аутоиммунитета в сравнении с женщинами контрольной группы (p˂0,05), характеризующееся дисбалансом его показателей, что могло служить одним из пусковых механизмов развития данной патологии, а также фактором риска развития спаечной болезни органов малого таза в послеоперационном периоде.
В ходе исследования выявлены достоверные различия (p˂0,05) уровней аутоантител к Коллагену в когорте пациенток, которым ранее была проведена миомэктомия (12,08±3,24%) и больными, получавшими медикаментозную терапии миомы матки (1,35±0,24%). Полученные данные свидетельствуют о том, что определение содержания уровней аутоантител к Коллагену методом ЭЛИ-П тест, может быть использовано в качестве биомолекулярного маркера рубцово-спаечного процесса у пациенток после миомэктомии.
По данным ультразвукового исследования, у обследуемых пациенток преобладало наличие множественной миомы матки с узлами, имеющими интрамуральную и интрамурально-субсерозную локализацией, при этом у каждой третьей больной диагностированы интрамуральные узлы с центрипетальным ростом или субмукозные миоматозные узлы (38,1%). Размер доминирующего узла варьировал от 5 до 18 см.
При гистероскопическом исследовании эндометрий в фазе пролиферации диагностирован у 46 (54,8%); гиперпластические процессы эндометрия выявлены в 36,9% случаев; аденомиоз установлен в 32,1 % наблюдений; деформация полости матки миоматозными узлами наблюдалась у 32 (38,1%) пациенток.
В результате гистологического исследования из 84 пациенток у 23 (27,4%) была диагностирована простая гиперплазия эндометрия без атипии, у 8 (9,5%) – комплексная гиперплазия эндометрия без атипии; эндометрий в фазе пролиферации – в 54,8% случаев, а у 7 (8,3%) обследуемых наблюдалась индуцированная атрофия эндометрия.
Всем пациенткам в плановом порядке выполнена миомэктомия лапаротомическим (67,9%) или лапароскопическим (32,1%) доступом. С целью профилактики развития спаечного процесса на завершающем этапе операции на область послеоперационного рубца наносили противоспаечный рассасывающийся гель Антиадгезин.
Через 6 месяцев после проведенного хирургического лечения отсутствие жалоб отмечено у 73 (86,9%) пациенток. И лишь в 13,1% наблюдений установлены незначительные тянущие боли внизу живота.
Гистологическое исследование эндометрия в динамике через 6 месяцев выявило индуцированную атрофию эндометрия у 29 (93,5%) из 31 пациентки, и лишь у 2 обследуемых сохранялись изменения в эндометрии, верифицированные как простая гиперплазия эндометрия без атипии.
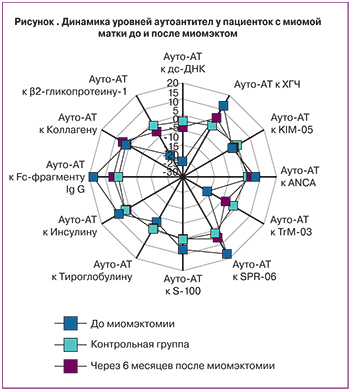 Спустя 6 месяцев после миомэктомии нормализация содержания уровней аутоАТ отмечена в 65,5% случаев, статистически значимое улучшение показателей аутоАТ – у 24 (28,6%) пациенток (p˂0,05). Полученные данные свидетельствовали об устранении исходного дисбаланса показателей иммунореактивности до значений, сопоставимых с показателями контрольной группы (рисунок). И лишь в 5,9% случаев в динамике после окончания терапии не выявлено достоверных изменений иммунореактивности (p>0,05). Обращает на себя внимание тот факт, что уровень аутоАТ к Коллагену в обследуемой когорте пациенток после проведенного хирургического вмешательства статистически значимо не изменялся (p>0,05), и составил в среднем (3,40±0,32%), что свидетельствовало об эффективности проводимой противоспаечной терапии (рисунок).
Спустя 6 месяцев после миомэктомии нормализация содержания уровней аутоАТ отмечена в 65,5% случаев, статистически значимое улучшение показателей аутоАТ – у 24 (28,6%) пациенток (p˂0,05). Полученные данные свидетельствовали об устранении исходного дисбаланса показателей иммунореактивности до значений, сопоставимых с показателями контрольной группы (рисунок). И лишь в 5,9% случаев в динамике после окончания терапии не выявлено достоверных изменений иммунореактивности (p>0,05). Обращает на себя внимание тот факт, что уровень аутоАТ к Коллагену в обследуемой когорте пациенток после проведенного хирургического вмешательства статистически значимо не изменялся (p>0,05), и составил в среднем (3,40±0,32%), что свидетельствовало об эффективности проводимой противоспаечной терапии (рисунок).
При ультразвуковом сканировании органов малого таза через 3 и через 6 месяцев после миомэктомии признаков несостоятельности рубцов ни у одной пациентки выявлено не было. Через 12 месяцев после операции косвенные признаки спаечного процесса в органах малого таза (хронические воспалительные изменения, линейные гиперэхогенные структуры неправильной формы (спайки), наличие свободной жидкости в полости малого таза и/или брюшной полости) диагностированы лишь у 7 (8,3%) больных.
В ходе метросальпингографии, проведенной через 6 месяцев после операции, у 6 (7,1%) пациенток выявлена невыраженная деформация полости матки. У всех обследуемых маточные трубы контрастировались с обеих сторон на всем протяжении, рентгеноконтраст свободно изливался в брюшную полость, что свидетельствовало об отсутствии перитубарных спаек.
В течение одного года после окончания терапии из 84 пациенток беременность наступила у 60 (71,4%) обследуемых: спонтанно – у 48 (57,1%) женщин; в программе экстракорпорального оплодотворения и переноса эмбриона – в 14,3% случаев с благополучным исходом у 39 (46,4%).
Диагностическая или лечебно-диагностическая лапароскопия была выполнена 36 пациенткам в интервале от 6 месяцев до 1 года после отмены агонистов ГнРГ в виду отсутствия у них беременности. Отсутствие спаечного процесса диагностировано у 29 (80,6%) больных, I степень – в 13,9% случаев, в то время как II степень – лишь у 2 (5,5%) пациенток.
Родоразрешение путем операции кесарева сечения проведено 44 (73,3%) из 60 пациенток. При этом спаечный процесс I степени обнаружен у 3 (6,8%) больных, в то время как в подавляющем большинстве случаев признаки спаечного процесса отсутствовали. Втяжение рубцов выявлено у 13,6% женщин. Признаков несостоятельности рубцов ни у одной пациентки диагностировано не было.
Заключение
Таким образом, результаты проведенного исследования позволяют считать научно-обоснованным проведение раннего этапа реабилитации репродуктивной функции женщин после миомэктомии с использованием инновационного средства для профилактики спайкообразования – рассасывающегося геля Антиадгезин.



