Введение
Известно, что акромегалия представляет собой синдром, объединяющий различные гистологические подтипы соматотрофных аденом (по новой терминологии – нейроэндокринных опухолей), которые, несмотря на принадлежность к единой ацидофильной линии, различаются по патоморфологическому строению, клиническому течению и чувствительности к лекарственным препаратам. В табл. 1 представлен фрагмент 4-й редакции классификации аденом гипофиза Всемирной организации здравоохранения (ВОЗ) от 2017 г., посвященный соматотрофным опухолям. Напомним, что в отличие от предыдущих редакций в новом (иммуногистохимическом) варианте предлагается первичное использование экспрессии факторов транскрипции для классификации опухолей аденогипофизарных клеток с выделением трех типовых клеточных линий: ацидофильная, гонадотрофная и кортикотрофная. Соматотрофные аденомы идентифицируются, как аденомы, которые экспрессируют преимущественно гормон роста (ГР) и образованы из PIT-1-зависимой (ацидофильной) клеточной линии. Иммунологические фенотипы различаются особенностями гормональной экспрессии, а также знаковым расположением низкомолекулярного цитокератина НКЦ (табл. 1, 2) [1, 2].
Соматотрофные аденомы составляют 10–15% от всех гипофизарных нейроэндокринных опухолей. Их различные фенотипы были впервые дифференцированы методом электронной микроскопии на густо и редко гранулированные опухоли. Теперь эти клеточные подтипы можно распознать с помощью иммуногистохимического анализа (ИГА) с использованием антител, направленных против НЦК. Морфологи определяют перинуклеарную экспрессию НЦК в густо гранулированных опухолях и характерные фиброзные тела в редко гранулированных опухолях. Помимо основных опухолевых подтипов также условно выделяют переходную форму с перекрывающимися распределениями цитокератина, которая классифицируется как промежуточный тип, но клинически является сходной с густо гранулированными опухолями [3].
Соматотрофные редко гранулированные опухоли чаще встречаются у молодых пациентов, являются более крупным по размеру (86 против 58% случаев) и инвазивными (65 против 38% случаев) образованиями. Большинство из этих опухолей спорадические, однако примерно в 5% случаев наблюдаются клинические симптомокомплексы, обусловленные врожденными генетическими нарушениями, включая синдромы МЭН 1-го и 4-го типов, комплекс Карнье, синдром Мак-Кьюна-Олбрайта, семейную изолированную гипофизарную аденому, Х-сцепленный акрогигантизм. Как правило, опухоли у лиц с наследственной предрасположенностью манифестируют в детском возрасте, клинически проявляются гигантизмом, отличаются агрессивным течением и резистентностью к лечению [4].
С акромегалией чаще коррелируют густо гранулированные аденомы, тогда как маммосоматотрофные аденомы имеют раннюю манифестацию и чаще проявляются гигантизмом. Большинство соматотрофных опухолей относится к макроаденомам. Густо гранулированные аденомы, как правило, выглядят гипоинтенсивными на Т2-взвешенных МР-изображениях и чувствительны к АС, в то время как редко гранулированные аденомы менее чувствительны к АС, отличаются большими размерами, инвазивным распространением и характеризуются наличием гиперинтенсивного сигнала на Т2-изображениях.
Гистологически густо гранулированные аденомы преимущественно состоят из сильно эозинофильных клеток, проявляющих диффузную позитивность для ГР и α-субъединицы. НЦК располагается перинуклеарно. Редко гранулированные аденомы состоят из слегка эозинофильных или хромофобных клеток, которые редко или фокально позитивны на ГР и негативны к α-субъединице. НЦК определяется в форме юкстануклеарных фиброзных тел и выявляется в более 70% опухолевых клетках [3].
Все подтипы соматотрофных аденом экспрессируют ГР, PIT-1, 2-й и 5-й подтипы соматостатиновых рецепторов (ССР). В редко гранулированных аденомах экспрессия ГР и 2-го подтипа ССР, как правило, ниже, чем в густо гранулированных опухолях. Следует отметить, что в настоящее время имеются моноклональные антитела против ССР, позволяющие получать достоверные доказательства характера и выраженности их экспрессии на клеточной мембране, что позволяет прогнозировать чувствительность остаточной опухолевой ткани к АС [5, 6].
Маммосоматотрофные аденомы состоят из единой клеточной популяции, экспрессирующей ГР и ПРЛ, а также α-субъединицу. В отличие от чистых соматотрофных опухолей эти опухоли экспрессируют ФТ ERα. Смешанный соматотрофный-лактотрофный подтип, в котором ГР и ПРЛ экспрессируются разными клетками, классифицируется как соматотрофная аденома, состоящая из двух клеточных популяций, позитивных для PIT-1. При этом соматотрофный компонент бицеллюлярной опухоли может состоять как из густо, так и редко гранулированных клеток. Наличие позитивности для ПРЛ и ERα и негативности по α-субъединице отличает данную аденому от маммосоматотрофной опухоли [1, 2].
Несмотря на то что к настоящему времени в целом обозначена и закреплена в консенсусных соглашениях общая методология диагностического поиска и лечебного пособия акромегалии, с учетом имеющегося многообразия патоморфологических вариантов ГР-секретирующих аденом сохраняются проблемы по обеспечению персонализированного лечения пациентов с учетом особенностей рецепторного фенотипа и пролиферативной активности опухолевой ткани. Использование унифицированного схематичного подхода, замедленное внедрение в широкую клиническую практику методов ИГА оперативно удаленного материала, новых возможностей лучевой и функциональной диагностики, к сожалению, увеличивают длительность активной стадии, снижают эффективность лечебных мероприятий и повышают риск инвалидизации пациентов. Последнее обстоятельство особенно важно, поскольку, согласно экспертным заключениям, редко гранулированные соматотрофные опухоли, равно как и лактотрофные опухоли у мужчин, аденомы из клеток Crooke, молчащая кортикотрофная опухоль и плюригормональная PIT-1-позитивная аденома определяются как инвазивные аденомы, или аденомы высокого риска малигнизации. Эти гистологические типы аденом отличаются ускоренным ростом, тенденцией к рецидивированию и прогрессированию, а также резистентностью к медикаментозному и/или радиологическому лечению [8–10].
Несмотря на то что медикаментозная терапия (МТ) не является приоритетным методом лечения, ее вклад в достижение и поддержание стойкой биохимической ремиссии весьма существен. Особенно наглядно это проявляется при соответствии между фармакологическими возможностями препарата и характером рецепторной экспрессии аденоматозных клеток.
Независимо от того, идет ли речь о первичной или вторичной МТ, перед врачом-эндокринологом стоит решение по крайней мере двух главных клинических задач: во-первых, определить перспективу эффективного длительного лечения АС1 с селективным подбором пациентов, во-вторых, своевременно выявить пациентов с агрессивным течением заболевания, требующего оперативной коррекции лечебного пособия и пристального динамического контроля.
Безусловно, реализации этих задач может помочь дополнительная информация относительно интенсивности сигнала на Т2-взвешенных МР-изображениях, а также данные ИГА, свидетельствующие о гистологическом строении, рецепторном фенотипе и пролиферативном потенциале конкретной опухоли [11, 12]. К сожалению, эти сведения на сегодняшний день не всегда доступны для практических врачей. Поэтому в данной работе авторы постарались несколько облегчить ситуацию и косвенно разрешить изначально существующую диагностическую неопределенность. При этом в качестве диагностического механизма выбран феномен избирательной чувствительности ГР-секретирующих аденом к АС1.
Среди средств, используемых при фармакотерапии акромегалии, АС по праву занимают ведущее место как по эффективности антисекреторного и антипролиферативного действий, так и по переносимости и доступности лекарственных препаратов. Наиболее распространенные препараты этого класса (октреотид и ланреотид), входящие в группу АС1, преимущественно воздействуют на 2-й подтип ССР. Другой задействованный в клинической практике полилигандный препарат – пасиреотид – относится к АС 2-й генерации и преимущественно связывается с 5-м подтипом ССР. Фармакологическое подавление 2-го и/или 5-го подтипов ССР блокирует секреторную и пролиферативную активность опухолевых клеток, предотвращая прогрессирование масс-эффекта [13, 14].
Как показали проспективные наблюдения, эффективность использования АС непосредственно зависит от рецепторного фенотипа опухолевых клеток различных ГР-секретирующих аденом гипофиза. Наибольшая чувствительность к АС1 наблюдается в опухолях, состоящих из густо гранулированных эозинофильных клеток с доминирующим наличием 2-го подтипа ССР. Меньшая представленность ССР 2-го типа и, соответственно, меньшая чувствительность к АС1 регистрируется при промежуточном морфологическом типе, при котором стойкая нормализация гормональной секреции требует повышенных доз АС1. Напротив, опухоли, состоящие из слабо гранулированных хромофобных клеток, а также смешанные опухоли отличаются резистентностью к АС1, поскольку преимущественно экспрессируют 5-й подтип ССР и в силу особенности рецепторного фенотипа проявляют чувствительность к АС2. При использовании АС1 в качестве первичной или вторичной фармакотерапии биохимический контроль достигается в среднем в 30–60% случаев. Значимое уменьшение объема опухоли (>20%) наблюдается у 63–79% больных, в большей степени при первичной МТ. Описана прямая корреляция между биохимической чувствительностью к АС1 и уменьшением объема опухолевой ткани. Исходное высокое содержание ГР и ИРФ-1, а также большие размеры опухоли указывают на низкую чувствительность к АС1.
В связи с этим предварительная субтотальная хирургическая резекция может считаться дополнительной мерой для повышения чувствительности к препаратам. Как показали сравнительные исследования, эффективность использования АС существенно повышается после хирургической резекции, что проявляется в увеличении доли пациентов с безопасным уровнем ИРФ-1 с 42 до 89%. Успешное комбинирование хирургического и медикаментозного пособий способствовало существенному повышению продолжительности жизни пациентов [15, 16].
Анализируя результативность клинического использования АС1 нельзя обойти тему частичной или полной резистентности к препаратам. Следует отметить, что клиническая эффективность при применении АС1 в немалой степени зависит от особенностей рецепторного фенотипа опухолевых клеток. Как показали лабораторные исследования, АС1 преимущественно связываются со 2-м и в меньшей степени с 5-м подтипами ССР, контролирующими секрецию ГР. Клетки ГР-секретирующих аденом гипофиза также преимущественно экспрессируют 2-й и 5-й подтипы ССР, аффинность к которым может отличаться в различных морфологических типах опухолей. Так, в клетках густо гранулированных аденом выше относительная экспрессия 2-го подтипа ССР, тогда как в слабо гранулированных аденомах больше представленность 5-го подтипа ССР. Установлено, что ССР кодируются генами, расположенными на различных хромосомах: ген рецептора 1-го подтипа локализуется на 14-й хромосоме, 2-го подтипа – на 17-й, 3-го подтипа, – на 22-й, 4-го подтипа – на 20-й и 5-го подтипа – на 16-й хромосоме. Это указывает на то, что точечные генные мутации способны изменять видовую структуру рецепторного аппарата клеток и, соответственно, их чувствительность как к нативному, так и к ятрогенному соматостатину [17, 18]. Наблюдаемая большая вариабельность экспрессии отдельных подтипов ССР свидетельствует прежде всего о том, что соматотропиномы представляют собой разнородную группу гипофизарных опухолей с различной рецепторной архитектоникой. Поэтому представляется важным попытаться предварительно определить индивидуальный рецепторный профиль для каждой опухоли, чтобы выработать адекватную лечебную стратегию [19–21].
В представленной работе был проведен ретроспективный анализ результатов длительной МТ с учетом избирательной чувствительности к АС1 среди больных акромегалией, включенных в Московский регистр.
В настоящее время на учете в Московском регистре больных акромегалией и гипофизарным гигантизмом состоят 719 больных (196 мужчин, 523 женщины) от 18 до 90 лет, средний возраст – 59±14 лет. Доминирующий возраст диагноза – 48±14 лет. Соотношение женщины/мужчины равняется 2,68. Макроаденомы были выявлены у 74% больных. Средняя длительность заболевания составляет 10±8 лет (с максимальным размахом до 49 лет), длительность амбулаторного наблюдения – от 3 месяцев до 15 лет. С учетом численности населения на 2020 г., равной 12,7 млн человек, распространенность акромегалии по обращаемости в Москве составила 56,6 случая на 1 млн жителей (в среднем по России – 36,5 случаев/млн), заболеваемость – 3,9 случая/млн в год.
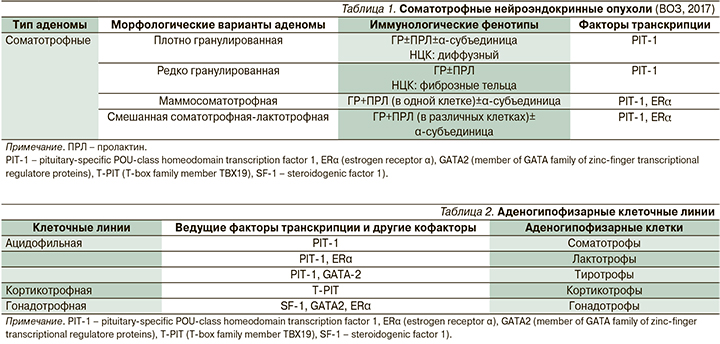
За время деятельности регистра прооперированы 452 (64%) пациента, лучевую терапию получили 111 (16%) больных, первичную или вторичную МТ получают 545 (77%) больных. По результатам лечения, 60% больных пребывают в стадии полного или медикаментозного контроля, тогда как у 40% пациентов имеется активная стадия заболевания. Последнее обусловлено в первую очередь агрессивным течением акромегалии, а также техническими интервалами, связанными с длительностью первичного и послеоперационного обследования. Суммарный показатель ИРФ-1 индекса (определяется как частное от деления величины ИРФ-1 на верхнее значение возрастной нормы) у больных снизился в сторону более безопасных для здоровья пациентов значений – с 2,6±1,2 до 1,1±0,7 (р=0,0000). Если до начала терапии доминирующие значения ИРФ-1 индекса были в промежутке 2–4, то к настоящему времени этот показатель сместился в сторону 1–1,2 (рис. 1).
Тем не менее следует признать, что, несмотря на активное лечебное пособие, есть определенная группа пациентов с сохраняющейся активностью заболевания, что требует дополнительного клинического анализа.
Методы
В работе проведен ретроспективный анализ данных больных акромегалией, длительное время получавших опухоль-опосредованные лекарственные препараты с целью клинического выявления особенностей рецепторной экспрессии аденоматозных клеток исходя из результатов кратковременного (3-месячного) использования пролонгированных форм АС. На основании контрольных замеров предполагалось выделение отдельных групп больных, характеризующихся доброкачественным или агрессивным сценарием опухолевого развития, предположительно обусловленным наличием различных патогистологических подтипов соматотрофных опухолей. Своевременное выявление пациентов с высоким риском агрессивного течения позволит оперативно предпринять необходимые меры для контроля акромегалии и предупреждения малигнизации гипофизарной нейроэндокринной опухоли.
Представлены результаты 545 пациентов (162 мужчины, 383 женщины), включенных в Московский регистр больных акромегалией, в среднем возрасте 61±14 лет. Средний возраст диагноза составил 49±14 лет (у мужчин 45±14, у женщин 50±13 лет; p=0,0000). Средняя длительность заболевания составила 12+8 лет (с максимумом до 43 лет). Макроаденомы были выявлены у 74% больных. Объем опухоли у мужчин был выше, чем у женщин, составив 6,8±10 против 3,0±6,7 см3 соответственно (p=0,0010).
Также отмечались гендерные различия и в секреторной активности. Уровень ИРФ-1 составлял 726±303 против 643±276 нг/мл у мужчин и женщин соответственно (p=0,0176). Независимо от наличия или отсутствия предшествовавшего лечения все больные изначально пребывали в активной стадии заболевания. Средние величины ИРФ-1 и ИРФ-1 индекса составляли 650±291 и 2,6±1,2 нг/мл соответственно.
В качестве фармакотерапии применялись АС1 (продленные формы ланреотида и октреотида (252 и 191 пациент соответственно), а также селективный агонист дофамина каберголин в качестве первичной или комбинированной МТ (в 46 и 163 случаях соответственно), 70% больных получали максимальные дозы АС1 и каберголина (Соматулин Аутожель 120 мг/28 дней, п/к), пролонгированные формы октреотида (Сандостатин ЛАР, Октреотид-Депо, Октреотид-Лонг 30–40 мг/28 дней, в/м, Каберголин 3–3,5 мг/нед. перорально). Средняя длительность МТ составила 68 (48) месяцев [М (s) с максимумом до 187 месяцев (16 лет)].
Адекватность фармакотерапии оценивалась по величине снижения уровня ИРФ-1 на фоне проводимого лечения, сроку наступления биохимической ремиссии (стойкого снижения уровня ИРФ-1 ниже верхней возрастной нормы, ИРФ-1, индекс<1), а также длительности эффективного и неэффективного лечения. Коэффициент адекватности (КА) многолетней фармакотерапии оценивался по соотношению между длительностью эффективного лечения и общей длительностью МТ в процентах. Контрольными точками оценки чувствительности к АС1 являлись величина и процент снижения ИРФ-1 от исходного уровня через 3 месяца лечения АС1, а также содержание ИРФ-1 через 12 месяцев от начала лечения. Разделение на группы проводили согласно величине снижения уровня ИРФ-1 через 3 месяца от начала лечения АС1: <10% (1-я группа), <30% (2-я группа), 31–59% (3-я группа) и >60% (4-я группа)]. Оценивалась корреляция между величиной снижения уровня ИРФ-1 через 3 месяца лечения, а также содержанием ИРФ-1 через 12 месяцев от начала лечения, показаниями оценочной пробы с октреотидом, а также результатами долговременного использования АС1 [22].
Кроме того, в работе сравнивались данные эффективности долговременной первичной или вторичной МТ в неселективной и селективной подгруппах. Первичную МТ получали 236 пациентов (48 мужчин, 188 женщин), вторичную МТ – 309 (114 мужчин, 188 женщин) больных. Вторичная МТ назначалась в среднем через 4±6 лет после проведенного оперативного вмешательства. На основании полученных данных был проведен ретроспективный анализ исходных клинических, лабораторных и функциональных признаков с целью выявления валидных маркеров, позволяющих прогнозировать эффективность МТ.
Статистический анализ проводился с использованием пакета статиcтических программ «Statistica-8.0» (StatSoft, 2001). Нормальность распределения проверялась с помощью критерия Шапиро–Уилка. Меры центральной тенденции и дисперсии количественных признаков представлены в виде среднего арифметического (М) и среднего квадратического отклонений (s). При сравнении двух связанных групп использовался критерий Вилкоксона. Анализ зависимостей проводился с использованием коэффициента ранговой корреляции Спирмена. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
Среди общей когорты больных, получающих фармакотерапию АС1, было выделено 4 группы пациентов согласно величине снижения уровня ИРФ-1 через 3 месяца от начала лечения. В 1-ю (резистентную) группу со снижением ИРФ-1<10% вошли 83 пациента, из них 56 (67%) мужчин, во 2-ю группу со снижением ИРФ-1<30% включены 175 пациентов, из них 64 (37%) мужчины. Следует отметить, 1-я группа искусственно выделена из обобщенной 2-й группы для наибольшей иллюстрации проблемы. В 3-ю группу с величиной снижения ИРФ-1 от 31 до 59% были включены 177 больных, их них 51 (29%) мужчина, и в 4-ю (чувствительную) группу с величиной снижения ИРФ-1>60% вошли 111 пациентов, из них 17 (15%) мужчин. Ниже в табл. 3 изложены сравнительные анамнестические, лабораторные и клинические данные по выделенным группам.
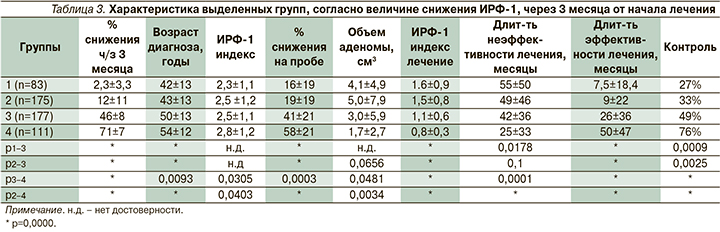
Как следует из табл. 3, несмотря на изначальное практическое сходство величины ИРФ-1 индекса, 1-я и 2-я группы отличались от 4-й (чувствительной) группы относительно ранним возрастом диагноза, большими размерами аденомы гипофиза, существенно большей длительностью неэффективной фармакотерапии и гораздо меньшей продолжительностью срока эффективной МТ. В 3-й группе отмечались промежуточные результаты. Число больных, достигших на фоне лечения биохимической ремиссии, в 1–4-й группах составило 27, 33, 49 и 76% соответственно. Длительность периода эффективного медикаментозного лечения в 1–4-й группах составила 7,5 из 61, 9 из 62, 26 из 72 и 50 из 76 месяцев МТ. Коэффициент адекватности равнялся соответственно 12, 15, 36 и 66% (р1, 2–3, 4<0,001). Таким образом, наблюдаемое различие в итоговых результатах при сходстве методов лечения и используемых препаратов можно объяснить только отличием в рецепторных фенотипах соматотрофных аденом, определяющих восприимчивость к лечению (рис. 2).
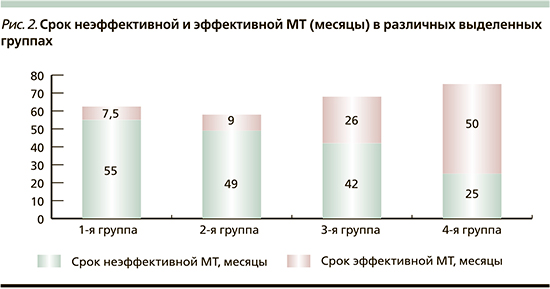
Следует также отметить, что наблюдаемая низкая эффективность МТ в 1-й и 2-й группах регистрировалась на фоне ранее проведенных наиболее активных способах радикального лечения. В 1-й группе хирургическое лечение (ХЛ) предпринято в отношении 64 (77%) больных (у 8 повторное), во 2-й – 126 (72%) (у 18 – повторное); в 3-й – 93 (53%) больных (у 5 повторное) и в 4-й – 46 (41%) (повторное у 2), (p1, 2–3, 4<0,001, р3–4=0,0483). Лучевая терапия (ЛТ) была произведена соответственно 22 (27%) из 83, 50 (29%) из 175, 28 (16%) из 177 и 9 (8%) из 111 больных, (р2–3=0,0037, р2–4=0,0498, р1, 2–4=0,0000). При этом сочетанная радикальная терапия (ХЛ+вторичная ЛТ) в 1–4-й группах наблюдалась в 27%, 23, 10 и 3% случаев (р1, 2–3, 4=0,0000, р3–4=0,0203, рис. 3).
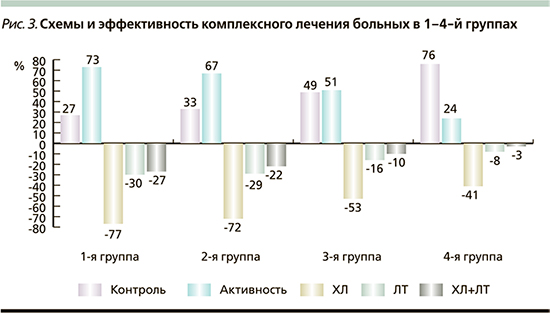
Таким образом, специально выделенная авторами 1-я группа (резистентная к АС1), помимо отсутствия (низкой) экспрессии 2-го подтипа ССР отличается ранним возрастом диагноза, большими размерами аденомы и стойкой резистентностью к предъявляемому лечению. Несмотря на высокую хирургическую и лучевую активность (77 и 30% соответственно), а также длительную МТ – 61 месяц (5 лет) в максимальных дозах, биохимическая ремиссия была достигнута только 27% больных, тогда как срок эффективного лечения составил всего 7,5 месяца с коэффициентом адекватности, равным 12%. По итогам лечения величина ИРФ-1 индекса в данной группе составила 1,6±0,9, тогда как в чувствительной к АС1 4-й группе величина ИРФ-1 индекса равнялась 0,8±0,3.
Несмотря на отсутствие морфологических данных, можно предположить, что представленные клинические характеристики соответствуют картине редко гранулированной соматотрофной опухоли, отличающейся агрессивным течением и риском малигнизации. Как уже отмечалось, данный патогистологический подтип требует особого внимания и более активного лечения. И лучше для больного, если этот вывод будет сделан на ранних этапах лечения, когда проблему можно решать с помощью фармакологического маневра без подключения органодеструктивных методов лечения (повторного хирургического вмешательства, стереотаксической радиохирургии или ХТ). По нашим данным, парциальный или тотальный гипопитуитаризм как исход хирургического и лучевого лечения в 1–4-й группах наблюдался у 17 (20%), 43 (25%), 27 (15%) и 10 (9%) больных соответственно (р1–3=0,3, р1–4=0,0287, р2–3=0,0195, р3–4=0,13, р2–4=0,0008). В табл. 5 представлена корреляция между величиной снижения уровня ИРФ-1 через 3 месяца от начала лечения АС1 и другими независимыми признаками.
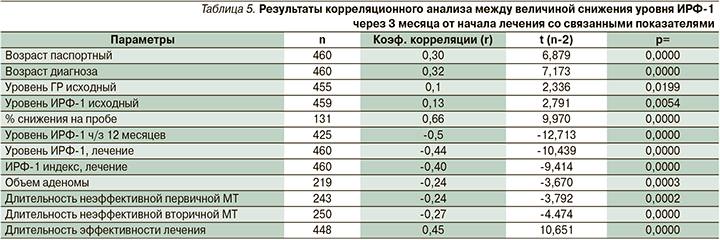
Как следует из результатов корреляционного анализа, высокая чувствительность к АС, проявляемая повышенным процентом снижения уровня ИРФ-1 через 3 месяца от начала лечения, имеет хорошую корреляцию с клинической эффективностью МТ (содержанием ИРФ-1 через 12 месяцев лечения и при последнем визите, а также с длительностью неэффективного и эффективного лечения). При этом отмечается отрицательная корреляция между чувствительностью к АС1 и объемом аденомы гипофиза. Следует также указать на существование прямой корреляции умеренной силы между рассматриваемым показателем и процентом снижения уровня ИРФ-1 при проведении оценочной пробы с октреотидом (r=0,66, p=0,0000), что подтверждает прогностическую силу последней.
Представленная тенденция имела свое отражение при раздельном анализе эффективности первичной и вторичной МТ. В селективных группах, в которые были включены пациенты с величиной снижения уровня ИРФ-1 через 3 месяца >60%, контроль акромегалии был более представительным и наблюдался у 72 и 80% больных, против 47 и 54% в общих группах соответственно (p1–2=0,0002).
Обсуждение
При обсуждении результатов МТ основной акцент обычно ставится на определении ее эффективности, что, безусловно, важно с учетом предполагаемого длительного периода лечения. Однако не менее актуально своевременное вычленение тех агрессивно развивающихся опухолевых подтипов, при которых традиционное лечение способом «ex juvantibus» с длительным периодом титрации (эскалации) дозы в условиях абсолютной резистентности к АС1 чревато развитием угрозы не только для здоровья, но и для жизни пациентов.
В данной работе авторы попытались использовать итоги непродолжительного использования АС1 в качестве оценочного теста на наличие (или отсутствие) в аденоматозных клетках 2-го подтипа ССР. И в этом случае особый интерес представляют не только случаи с хорошей чувствительностью к препарату, но и группа больных, лишенных этой чувствительности. Сочетание низкой эффективности лечения, несмотря на активную комбинированную лечебную интенвенцию, характерно для больных, имеющих редко гранулированные соматотрофные аденомы с высоким риском малигнизации. Такие пациенты, как правило, молодого возраста с инвазивной макроаденомой, уже перенесшие неуспешные хирургическое и медикаментозное пособия, требуют интенсивного, разнопланового лечения и неусыпного врачебного контроля. Это подчеркивает необходимость своевременного определения рекомендуемых опухоль-ориентированных маркеров (результатов иммуногистохимического анализа удаленного материала, а также показателя интенсивности опухолевого сигнала на Т2-взвешенных МР-изображениях), чтобы не упустить возможность радикальной лечебной коррекции.
На прогностическое значение результатов 3-месячного лечения указывают и другие авторы. Согласно данным A.M. Colao et al., уровни ГР, ИРФ-1 и степень уменьшения объема аденомы через 3 месяца лечения октреотидом ЛАР могут служить предиктором дальнейшего снижения опухолевого объема через 12 месяцев. Аналогичные данные были получены M. Mercado et al., изучавших эффективность октреотида ЛАР в течение 48 недель. Авторы отметили, что большинство пациентов показали биохимическую чувствительность со снижением уровней ГР и ИРФ-1 на 12-й неделе. По данным W. Liu et al., наличие высокой экспрессии 2-го подтипа ССР коррелирует с эффективностью действия АС1 [23–25]. Таким образом, можно сделать вывод, согласно которому показатели секреторной активности соматотропиномы через 12 недель супрессивного лечения имеют пороговое значение для долговременного прогноза контроля акромегалии.
О том же свидетельствуют результаты проведенного исследования PRIMARYS, в котором изучалась эффективность применения Ланреотид Аутожеля у 90 вновь выявленных пациентов с акромегалией и с макроаденомами. Статистический анализ показал, что содержание гормонов через 12 недель лечения (ГР<1,2 мкг/л и ИРФ-1<110% от верхней возрастной нормы) служит маркером эффективности 12-месячного лечения. Как показало исследование, старший возраст, женский пол и небольшое превышение уровня ИРФ-1 ассоциируются с повышенной вероятностью достижения гормонального контроля (ГР<2,5 и нормализация уровня ИРФ-1). Авторы полагают, что данные маркеры могут быть предиктором эффективного лечения Ланреотид Аутожелем. Снижение уровня ИРФ-1 менее 110 и 125% от верхней возрастной нормы через 12 недель являлось предиктором хорошего и строгого гормонального контроля. Таким образом, ранняя эффективность может служить предиктором отдаленной успешности лечения. Представленные результаты могут иметь большое значение как для клиницистов, так и для пациента, поскольку позволяют на раннем этапе лечения прогнозировать эффективность длительного использования ланреотида [26, 27].
В 2017 г. был опубликован отчет американских ученых о результатах 2-летнего использования Ланреотида Депо 241 пациентом, включенным в SODA (Somatuline® Depot for Acromegaly)-регистр. В итоге многоцентрового наблюдательного исследования было показано, что на фоне лечения Ланреотидом Депо нормализация уровня ИРФ-I через 12 месяцев лечения была достигнута в 71%, через 24 месяца – в 74% случаев. Снижение уровня ГР менее 2,5 нг/мл наблюдалось у 83 и 80% через 12 и 24 месяцев лечения соответственно. Нормализация обоих биохимических показателей зарегистрирована у 51,7 и 42,9% больных соответственно. Авторами отмечены клиническая эффективность, хорошая толерантность и переносимость препарата [26]. Эти отзывы согласуются с результатами проведенного в Польше открытого проспективного многоцентрового исследования, посвященного оценке предпочтительности для пациентов использования препарата Ланреотид Аутожель по сравнению с другими АС. Было отмечено, что клиническое использование Ланреотид Аутожеля имело «полную или частичную» предпочтительность для 95,1% больных по критериям клинической эффективности, простоты и безопасности введения [28].
В работе S. Khairi et al. также было отмечено, что продолжительное 8-летнее лечение больных акромегалией препаратом Соматулин Аутожель обеспечивало стойкое поддержание биохимической ремиссии, уменьшение объема опухоли, снижение выраженности осложнений и повышение качества жизни [29].
Потенциальная возможность препарата сокращать частоту проводимых инъекций была изучена в клиническом исследовании LEAD, в ходе которого была предпринята попытка оценить возможность перевода больных акромегалией с препарата октреотид ЛАР (в дозе 10–20 мг/28 дней) на Ланреотид Аутожель 120 мг с увеличенными межинъекционными интервалами. Как показали результаты, из 107 включенных в исследование пациентов, ранее получавших октреотид ЛАР в ежемесячной дозе 10–20 мг/28 дней и переведенных на Ланреотид Аутожель, у 88,7% сохранялся нормальный уровень ИРФ-I через 24 недели лечения с 6- и 8-недельными интервалами.
У 90% больных уровень ГР через 24 и 48 недель был менее 2,5 нг/мл. По итогам исследования, большинство пациентов предпочли в дальнейшем использовать Ланреотид Аутожель 120 мг каждые 6 или 8 недель вместо приема октреотида ЛАР каждые 4 недели. Соматулин® Аутожель® обеспечивает стабильный контроль гормональных показателей (ИФР-1 и ГР) и размера опухоли без отрицательного влияния на гликемический профиль в отличие от других АС [30].
В 2021 г. D. Cella et al. опубликовали результаты проведенного мета-анализа научных работ, посвященных клиническому использованию пролонгированных форм октреотида и ланреотида с целью выяснения того, какие характеристики помимо эффективности наиболее важные для приверженности пациентов лечению.
Анализировались технические и психологические проблемы, связанные с инъекциями (время и удобство введения, независимость, боль от инъекций, эмоциональное напряжение, тревожность).
Результаты показали, что использование Ланреотида Аутожель вызывает большее предпочтение среди пациентов, медицинских сестер и врачей, причем факторы, связанные с введением инъекций, возможностью самостоятельного введения препарата, наличием расширенных межинъекционных интервалов оказывали наибольшее влияние на приверженность длительному лечению. Этому заключению способствовала новая инновационная конструкция шприца для инъекций, созданная с учетом пожеланий пациентов и медицинских сестер [31].
Заключение
На основании клинической картины заболевания, возрастно-половых и морфологических особенностей, а также результатов непродолжительного лечебного использования АС1 можно не только прогнозировать эффективность дальнейшего медикаментозного лечения, но и предположительно судить о патогистологическом подтипе соматотрофной опухоли. При этом полное отсутствие чувствительности к АС1, выявляемое с помощью оценочной пробы или результатов непродолжительного лечения (3–12 месяцев), может служить признаком наличия опухоли высокого риска, требующей использования радикальных методов лечения. Напротив, изначальное наличие высокой чувствительности к препарату дает основание предполагать его высокую антисекреторную и антипролиферативную эффективность при длительном применении без опасения продолженного роста опухоли. С учетом многолетнего (подчас пожизненного) характера парентеральной МТ АС приверженность пациентов лечению зависит от эффективности лечения, доступности препарата, минимизации побочных эффектов, переносимости и низкой травматичности инъекций.



