Высокая распространенность инфекции мочевой системы (ИМС) на фоне пузырно-мочеточникового рефлюкса (ПМР) в детской популяции, а также склонность к рецидивирующему течению и развитию необратимых повреждений паренхимы почек c развитием артериальной гипертензии и хронической почечной недостаточности (ХПН) обосновывают необходимость дальнейшего изучения этой проблемы [1, 2]. По данным European Renal Association-European Dialysis Transplant Association (2010), частота тубулоинтерстициальных заболеваний, в том числе рефлюкс-нефропатии (РН) c развитием ХПН у детей с ПМР составляет до 22%, по данным различных авторов, от 6 до 27,5% [3–6]. Трудность диагностики определения степени тяжести ренального повреждения на фоне ПМР без проведения реносцинтиграфии с ДМСА (2,3-димеркаптосукциновая кислота) затруднительна [7]. В изучении данной проблемы актуально и следующее: до настоящего времени нет достаточно достоверных маркеров, прогнозирующих ранее прогрессирующее течение РН [8]. Поиск т.н. маркеров хронического почечного повреждения, позволяющих проводить раннее выявление и характер патологических изменений в почках, дифференцировать поражение разных отделов нефрона, точно установить стадию процесса, оценить выраженность воспаления и интенсивность фиброгенеза, наиболее важен [8–10].
Проведенное исследование Е.М. Чичуги и соавт. (2015), целью которого стало выявление маркеров на ранних стадиях почечного повреждения, показало, что у детей с обструкцией мочевых путей или с ПМР маркерами стали протеинурия, артериальная гипертензия, снижение функционального почечного резерва и нарушение кортикального кровотока, по данным цветного допплеровского картирования. Авторами также была подтверждена их значимость как ранних маркеров прогрессирования хронической болезни почек (ХБП) [11]. Однако, по данным других авторов, эти маркеры информативны при длительно текущем почечном поражении, когда развились основные осложнения почечного процесса, поэтому не могут быть ранними и использоваться в качестве прогностических маркеров [12, 13]. В настоящее время активно изучаются трансформирующий фактор роста (TФР-β1), интерлейкины-6 (ИЛ-6), ИЛ-8, -10, KIM-1 (kidney injury molecule-1), VEGF-А (vascular endothelial growth factor-A), L-FABP (liver type fatty-acid binding protein), NGAL (neutrophil gelatinase-associated lipocalin) и другие в качестве маркеров для раннего выявления почечного повреждения при ПМР [14].
TФР-β1 – мультифункциональный цитокин, регулирующий нормальный рост клеток и их дифференциацию во время эмбриогенеза, а также играющий ведущую роль в развитии фиброза ткани после ее повреждения. Источником служат макрофаги, тромбоциты, фибробласты, активированные Т-лимфоциты, клетки эндотелия сосудов и канальцев. В ответ на повреждение почечной ткани TФР-β1 вызывает трансформацию тубулярных эпителиальных клеток в миофибробласты, действуя как мощный стимулятор пролиферации фибробластов, стимулирует продукцию экстрацеллюлярных матричных белков (фибронектина, протеингликанов), активирует продукцию и накопление в интерстиции и в базальной мембране коллагенов I, III, IV типов [15].
 Ангиотензин II (АngII) – вазоактивный белок, а также истинный цитокин, который регулирует рост клетки, пролиферацию и дифференциацию моноцитов в макрофаги, а также синтез нескольких провоспалительных медиаторов и факторов роста, таких как TФР-β1, что способствует поддержанию воспаления и формированию фиброза. При заболеваниях почек и ХПН усиливается внутрипочечная продукция АngII [16].
Ангиотензин II (АngII) – вазоактивный белок, а также истинный цитокин, который регулирует рост клетки, пролиферацию и дифференциацию моноцитов в макрофаги, а также синтез нескольких провоспалительных медиаторов и факторов роста, таких как TФР-β1, что способствует поддержанию воспаления и формированию фиброза. При заболеваниях почек и ХПН усиливается внутрипочечная продукция АngII [16].
β2-микроглобулин (β2-МГ) – среднемолекулярный белок с массой 11,8 КД, присутствующий на поверхности всех ядросодержащих клеток и содержащийся во всех жидкостях организма. У здоровых людей скорость продукции этого белка и элиминация постоянны. β2-МГ выводится из организма почками на уровне клубочков, а в проксимальных канальцах проходят его реабсорбция и катаболизм. При нарушении процессов клубочковой фильтрации и канальцевых дисфункциях содержание β2-МГ увеличивается в крови и он появляется в моче [17, 18].
Таким образом, в литературе недостаточно освещен вопрос о роли АngII в патогенезе развития РН и не определена его роль в прогнозировании прогрессирования почечного повреждения. Известно, что, являясь основным профиброгенным фактором, инициирующим и поддерживающим процессы фибриллогенеза, Аng II повышает синтез TФР-β1, который стимулирует пролиферацию клеток и образование соединительной ткани [19–22]. Поскольку мочевой уровень β2-МГ отражает степень повреждения проксимальных канальцев можно предположить, что его повышенный уровень в моче будет отражать тяжесть повреждения тубулоинтерстициальной ткани, что характерно для РН [23, 24].
Целью исследования было определение клинического значения мочевой экскреции ТФР-β1, AngII и β2-МГ у детей с ПМР для раннего выявления и прогнозирования прогрессирования РН.
Материал и методы
В исследование были включены 79 пациентов с различной степенью ПМР в возрасте от года до 14 лет (средний возраст – 5,69±0,44 года), из них 58 (73,4%) девочек, которые находились на обследовании в отделениях нефрологии и урологии Института матери и ребенка (Кишинев).
Критерии включения в исследование:
- дети с фебрильной лейкоцитурией различной степени выраженности и подтвержденный ПМР;
- проведение реносцинтиграфии с ДМСА через 6±3 месяца после стихания воспалительного процесса в почечной ткани, повторное исследование через 12 месяцев;
- консервативное лечение ПМР;
- отсутствие нейрогенной дисфункции мочевого пузыря.
При анализе клинического материала были выделены пациенты с прогрессирующим течением РН (появление новых очагов склероза по данным контрольной ДМСА-сцинтиграфии через 12 месяцев). У пациентов без прогрессирования РН при контрольной ДМСА-сцинтиграфии новые очаги склероза не выявлены.
В зависимости от наличия и выраженности РН пациенты были разделены на 4 группы:
1-я группа (группа сравнения) – больные различной степенью ПМР без РН (n=12, средний возраст – 1,65±0,31 года), 8 девочек (66,7%);
2-я группа – пациенты с РН I–II степеней (n=27, средний возраст – 5,88±0,54 года), 19 (70,4%) девочек. В зависимости от характера прогрессирования РН в этой группе были выделены 2 подгруппы: 2А – без прогрессирования РН (n=16, средний возраст – 5,34±0,23 года), 11 девочек (68,8%) и 2Б – с прогрессированием РН (n=11, средний возраст – 6,43±0,86 года), 8 (72,7%) девочек.
3 группа – пациенты с РН III-IV степеней (n=40, средний возраст – 5,41±0,5 года) 31 (77,5%) девочка. В зависимости от характера прогрессирования в этой группе были выделены 2 подгруппы: 3А – без прогрессирования РН (n=18, средний возраст – 6,17±0,55 года), 14 (77,8%) девочек, и 3Б – с прогрессированием (n=22, средний возраст – 4,65±0,45 года), 17 (72,3%) девочек.
4 группа (контрольная) – 20 практически здоровых детей (6,24±0,31 года), 12 (60%) девочек.
Изучаемые группы больных достоверно не различались по полу и возрасту.
Всем больным было проведено комплексное обследование, которое включило ультразвуковое исследования (УЗИ) органов мочевой системы, УЗИ-допплер почек, микционную цистографию, экскреторную урографию и динамическую нефросцинтиграфию, клинические анализы крови и мочи: определяли уровни мочевины и креатинина в крови, рассчитывали СКФ по формуле Шварца, изучали концентрационную функцию почек в пробе Зимницкого и проводили бактериологическое исследование мочи.
Степень ПМР оценивали по результатам микционной цистографии согласно принятой в 1985 г. Международной классификации ПМР [25].
Для выявления РН и определения ее степени всем детям с ПМР была проведена статическая нефросцинтиграфия с ДМСА в отделении ядерной медицины Республиканской клинической больницы (Кишинев), но не ранее чем через 3 месяца после последнего эпизода инфекции мочевой системы. Степень РН определена согласно классификации A. Piepsz et al. (2001): I ст. – 1–2 рубца, II ст. – 2–3 рубца с сохранной почечной паренхимой, III ст. – очагово-диффузное распространение склеротических очагов с сохраненным почечным контуром, IV ст. – «маленькая» или атрофированная почка [26]. Повторная ДМСА-сцинтиграфия проведена через 12 месяцев после первого исследования.
В утренней моче определены уровни AngII, ТФР-β1 и β2-МГ на биохимическом анализаторе «Униплан» (США) методом иммуноферментного анализа ELISА с использованием наборов фирмы «Human TGF-beta-1 Quantikine ELISA Kit» и «Human Angiotensin II Quantikine ELISA Kit» (Великобритания), «Tina-quant a beta 2-microglobulin» (фирма Boehring Mannhaim). Уровни изучаемых маркеров в моче пересчитаны на содержание креатинина в данной порции мочи (нг/ммоль креатинина – Cr). Все дети на момент исследования находились в клинико-лабораторной ремиссии инфекции мочевой системы (пиелонефрита).
Статистическая обработка полученных результатов проведена c использованием программы Statistica for Windows 6.0. с определением χ²-критерия, дисперсионный анализ проводился индивидуально по каждому изучаемому маркеру, достигаемые при этом уровни значимости корректировались процедурой Беньямини – Йекутили; корреляционного анализа, непараметрических методов; значимость различий для независимых выборок по одному признаку оценивали по критерию Манна–Уитни, индекс Джини, при сравнительном анализе трех и более групп использовали ранговый анализ вариаций по Краскелу–Уоллису. Достоверными считали различия показателей при p<0,05.
Результаты
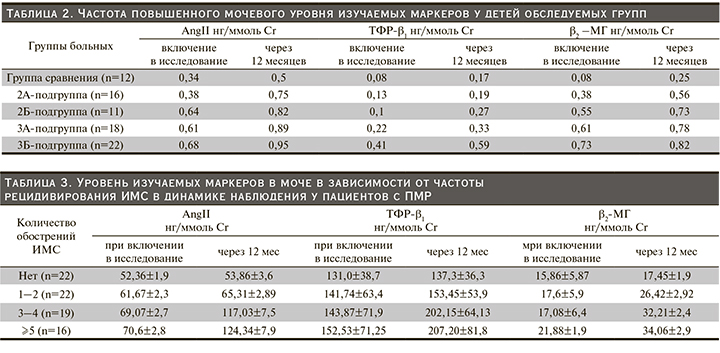
По данным обследования, у детей достоверно чаще встречался ПМР IV степени – у 29 (36,7%) детей (p<0,05), ПМР I степени зарегистрирован у 19 (24,05%) пациентов, ПМР II степени – у 16 (18,25%), ПМР III степени – у 15 (18,9%) детей соответственно. Односторонний ПМР был установлен в половине случаев – у 39 детей (49,4%), у 50,6% пациентов выявлен двусторонний ПМР (χ²=1,97; p>0,05).
Артериальная гипертензия при разовых измерениях была выявлена у 2 (8%) мальчиков с высокой степенью ПМР.
По данным ДМСА-сцинтиграфии РН была выявлена у 67 (84,8%) пациентов, детей без очагов склерозирования было 12 (15,2%; p<0,05). Тяжелая степень РН определена в 50,6% случаев, причем в 80% случаев при III–IV степенях ПМР (χ²=13,34; p<0,05). Мальчики с тяжелой степенью РН преобладали (52,4%, χ²=10,2; p<0,05).
При анализе функционального состояния почек нами определена зависимость СКФ от степени тяжести РН (r=-0,73, р<0,001). Снижение СКФ и развитие ХПБ II степени выявлено у 11 больных (13,9%) с прогрессирующим течением РН.
Рецидивирующее течение ИМС вывлено у 72,2% больных (p<0,05), причем 3 и более эпизодов в год были типичны как для пациентов с прогрессирующим течением РН, так и для больных 3А подгруппы.
Установлена связь между мочевым уровнем TФР-β1, AngII, β2-МГ и степенью тяжести РН. На момент включения в исследование выявлены повышенные мочевые уровни TФР-β1, AngII, β2-МГ в среднем в 2,1–3 раза у детей 3А- и 3Б-подгрупп по сравнению с 2А- и 2Б-подгруппами (p<0,001) и группой больных без признаков РН (p<0,05).
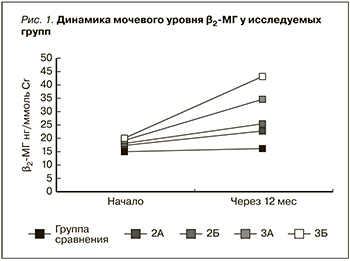
При динамическом наблюдении (через 12 месяцев) выявлена достоверная связь между уровнем изучаемых маркеров и прогрессированием заболевания. Высокий уровень β2-МГ в моче и его рост в динамике наблюдения установлен в подгруппах с прогрессирующим течением РН и является отражением тяжелого повреждения нефротелия проксимальных канальцев (во 2Б и 3Б подгруппах, p<0,05). В группе сравнения уровень β2-МГ в моче в динамике наблюдения сохранялся стабильно на низком уровне (рис.1).
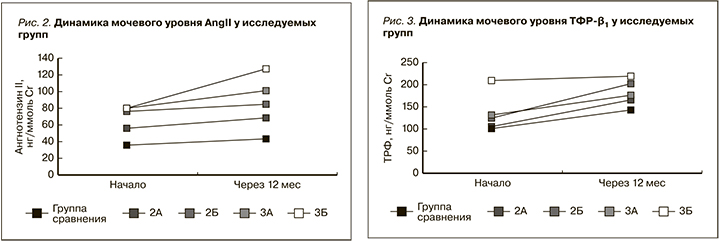
Проведенные исследования показали, что уровень AngII в моче как в начале, так и к концу исследования в 3А и 3Б подгруппах (III-VI степени РН) был значительно выше, чем во 2А и 2Б группах (I-II степени РН) – в среднем на 40% и 46%, соответственно (p<0,05, рис.2).
На момент включения в исследование в группе пациентов без РН (группа сравнения) уровень AngII составил 35,9±4,41 нг/ммоль Cr, однако при динамическом наблюдении через 12 месяцев отмечено его повышение на 13% (рис. 2).
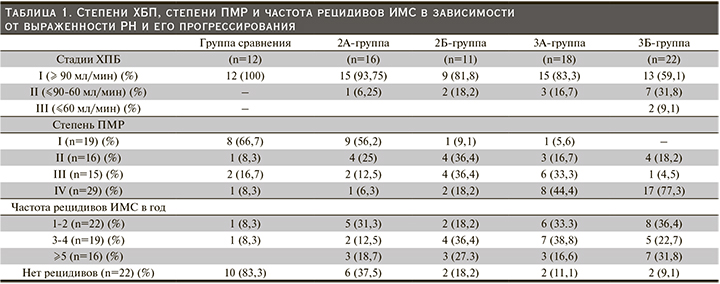
Мочевой уровень TФР-β1 был выше у всех детей с РН по сравнению с группой детей без РН (р<0,05, рис. 3). Отмечены достоверно более высокие показатели TФР-β1 у детей 3Б-подгруппы по сравнению с 3А-подгруппой и группой сравнения, а также с 2А- и 2Б-подгруппами как в начале исследования, так и в конце (р<0,05). Установлено, что у детей 2Б-подгруппы в динамике наблюдения значительно повысился мочевой уровень TФР-β1, что косвенно указывает на значимое усиление склеротических процессов в почечной ткани (рис. 3). В контрольной группе 20 детям проведено исследование мочевого уровня изучаемых маркеров (AngII, TФР-β1, β2-МГ) с пересчетом на уровень креатинина. Были определены верхние показатели нормальных значений данных маркеров (М+1δ), представленных в табл. 1.
На основании полученных данных определена частота повышенного мочевого уровня исследуемых маркеров в группе сравнения и изучаемых подгруппах при включении в исследование и через 12 месяцев наблюдения (табл. 2).
При включении в исследование в группе сравнения частота повышенного уровня AngII в моче составила q=0,34, во 2А- и 2Б-подгруппах – q=0,38 и q=0,64; в 3А- и 3Б-подгруппах – q=0,61 и q=0,68 соответственно (р<0,05). Частота повышенного мочевого уровня TФР-β1 была достоверно ниже в группе детей без РН (q=0,08) по сравнению с 3А- и 3Б-подгруппах – q=0,23 и q=0,41 (p<0,05), достоверной разницы с 2А- и 2Б-подгруппами не было (q=0,13 vs q=0,1; p>0,05). Повышенный мочевой уровень β2-МГ чаще всего наблюдался в 3А- и 3Б-подгруппах (q=0,62 и q=0,73 соответственно), реже в группе сравнения (q=0,08; р<0,05) и в подгруппах 2А и 2Б (q=0,38 и q=0,55 соответственно; p<0,05).
Через год наблюдения частота повышенного мочевого уровня изучаемых маркеров увеличилась во всех изучаемых группах, особенно значимо при прогрессирующем течении РН. Так, высокий мочевой уровень всех маркеров достоверно чаще встречался у детей 3А- и 3Б-подгрупп по сравнению с группой сравнения (р<0,05), особенно β2-МГ в 2Б- и 3Б-подгруппах (р<0,05). В 3А- и 3Б-подгруппах установлен наибольший рост частоты случаев повышенного мочевого уровня АngII (q=0,89 и q=0,95) и TФР-β1 (q=0,33 и q=0,59; p<0,05) по сравнению с группой без РН (q=0,17, табл. 2).
Установлена зависимость уровня изучаемых маркеров в моче от частоты рецидивирования мочевой инфекции у 79 детей с ПМР в динамике наблюдения. У больных ПМР без рецидивирования ИМС (n=22, 27,8%) через 12 месяцев наблюдения уровни TФР-β1, AngII и β2-МГ достоверно не отличались от уровня при включении детей в исследование (p>0,05; табл. 3).
В динамике наблюдения через 12 месяцев уровень TФР-β1 в моче был достоверно выше у детей с частыми рецидивами (5 и более в год) по сравнению с пациентами с редкими рецидивами инфекции, а также у детей без рецидивов (p<0,05). Уровень TФР-β1 в моче не отличался в группах детей с 3–4 рецидивами и 5 и более рецидивами (p>0,05). Уровень AngII в моче также зависел от частоты обострений: наиболее низкий уровень AngII в моче был выявлен у детей без рецидивирования инфекции мочевой системы и достоверно высокий – в группе детей с 3–4 и более рецидивами (p<0,05).
В группе детей с редкими рецидивами (1–2 рецидива в год) уровень β2-МГ в моче не отличался от такового у детей с частыми рецидивами (26,42±2,92 vs 32,21±2,4; p>0,05). У детей без рецидивирования ИМС уровень β2-МГ в моче был в пределах нормальных значений и достоверно ниже, чем у детей с 5 рецидивами (17,45±1,9 vs 34,06±2,9; p<0,05).
Таким образом, часто рецидивирующая ИМС способствует развитию склеротических процессов в почечной ткани, что косвенно отражает высокий мочевой уровень профиброгенных маркеров. В то же время не отмечено существенного влияния частоты рецидивирования ИМС на мочевой уровень β2-МГ, что, вероятно, обусловлено тем, что при ИМС в первую очередь поражается дистальный каналец и, в меньшей степени, проксимальный [18].
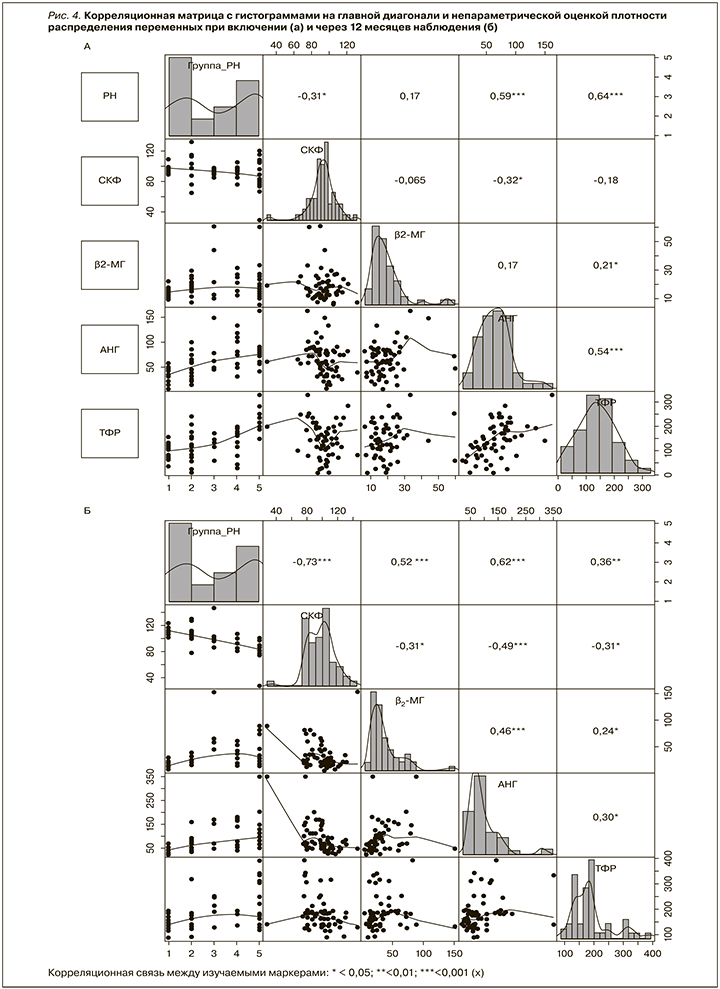
Корреляционный анализ между изучаемыми маркерами и развитием РН при включении пациентов в исследование установил наличие прямой средней силы связь между АngII (r=0,59, р<0,001) и TФР-β1 (r=0,64, р<0,001) с одной стороны и наличием РН, с другой стороны, что отражает их роль в процессах склерозирования в почечной ткани. Также отмечена прямая средней силы связь между мочевыми уровнями AngII и TФР-β1 (r=0,54; р<0,001) и отрицательная слабая связь между СКФ и РН (r=-0,31; р<0,05, рис. 4а).
Через 12 месяцев наблюдения имели место сильная отрицательная корреляционная связь между СКФ и РН (r=-0,73; р<0,001) и средней силы отрицательная связь между мочевым уровнем АngII и СКФ (r=-0,49; р<0,001), средней силы положительная связь между мочевым уровнем β2-МГ и РН (r=0,52; р<0,001) и слабая положительная связь между мочевым уровнем TФР-β1 и РН (r=0,36; р<0,01), мочевыми уровнями AngII и β2-МГ (r=0,46; р<0,001) и TФР-β1 (r=0,3; р<0,05). Слабые отрицательные корреляционные связи отмечены между СКФ и мочевыми уровнями β2-МГ (r=-0,31; р<0,05) и TФР-β1 (r=- 0,31; р<0,05) (рис. 4б).
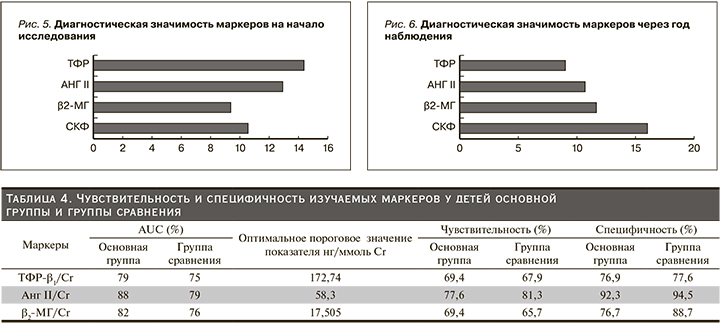
При определении среднего значения индекса Джини для отдельных маркеров РН при включении детей в исследование и через 12 месяцев наблюдения было установлено, что к значимым маркерам развития РН относятся TФР-β1 и AngII (рис. 5). Через 12 месяцев наблюдения снизилась значимость TФР-β1 и АngII по индексу Джини и увеличилась для СКФ и уровня β2-МГ, что свидетельствует о большей значимости этих маркеров для прогнозирования прогрессирования РН (рис. 6).
Таким образом, наиболее значимыми маркерами, позволяющими прогнозировать развитие РН уже на ранних стадиях у пациентов с ПМР, служат мочевые уровни АngII и TФР-β1 (рис. 5). Прогрессирующий характер РН в большей степени прогнозируют СКФ и мочевой уровень β2-МГ (рис. 6).
С целью определения информативности метода оценки склеротических изменений в почке мы рассчитали специфичность и чувствительность изучаемых маркеров в зависимости от наличия РН (табл. 4).
Экскреция АngII с мочой была значительно выше у больных основной группы (чувствительность 77,6% и специфичность 92,3%), и в меньшей степени TФР-β1 (69,4% и 76,9%), что соответствовало тяжести склеротических изменений. В группе сравнения высокий уровень AngII в моче (чувствительность 81,3% и специфичность 94,5%) свидетельствует о ранних склеротических изменениях и о непосредственном участии AngII в развитии склеротических процессов в почечной ткани у детей с ПМР (табл. 4).
Обсуждение
Изучение диагностических маркеров раннего формирования и прогрессирования тубулоинтерстициального фиброза, среди которых важное место отводят профиброгенным факторам, остается перспективным направлением в детской нефрологии [27]. Интерес поиска диагностических маркеров возрос с появлением доступных методов определения уровня цитокинов не только в крови, но и в моче, позволяющих оценить активность и характер течения фиброзирующих процессов в почечной ткани [27, 28]. Поскольку проксимальные канальцы, поврежденные ишемией, служат основным источником факторов роста, значительное повышение содержания TФР-β1 и АngII в моче по мере возрастания тяжести тубулоинтерстициального повреждения указывает на гиперпродукцию данных цитокинов и усиленную пролиферацию фибробластов с разрастанием соединительной ткани, что подтверждается данными литературы [16, 22, 29].
Нами выявлена зависимость уровней изучаемых маркеров от частоты рецидивов ИМС: мочевой уровень профиброгенных маркеров достоверно увеличивался при частом рецидивировании инфекции. В отсутствие рецидивирования экскреция изучаемых маркеров с мочой не увеличивалась в динамике наблюдения. Мочевой уровень β2-МГ не зависел от частоты рецидивирования ИМС.
Уровень профиброгенных маркеров в моче большинства больных ПМР, осложнившейся РН, был повышен и выявлена прямая корреляционная связь между мочевыми показателями TФР-β1 и АngII, что, вероятно, отражает их взаимное участие в фиброзирующем процессе. Повышение уровней АngII и TФР-β1 у части детей с ПМР без признаков РН по статической нефросцинтиграфии, возможно, обусловлено инфильтрацией макрофагов и лимфоцитов в почечный интерстиции в очаге воспаления, что можно расценить как пресклеротическую стадию развития РН у этих детей.
Аналогичные результаты были получены и другими исследователями. Так, A. Sabasinsca et al. (2008) обнаружили сильную прямую корреляционную связь между мочевой экскрецией TФР-β1 у детей с ПМР и тяжестью самого рефлюкса и почечным повреждением [30]. Ряд авторов отметили наличие тесной связи между уровнем TФР-β1 в моче и степенью тяжести повреждения почечной ткани у детей с ПМР, осложненным РН [31, 32].
О значении β2-МГ как одного из маркеров повреждения тубулоинтерстициальной ткани свидетельствуют выявленные нами корреляционные связи средней силы между мочевым уровнем β2-МГ и СКФ, а также β2-МГ и АngII у пациентов с РН, что отражает тяжесть повреждения эпителия проксимальных канальцев, прежде всего за счет деструкции и нарушения процессов реабсорбции в них при прогрессировании процесса. При наличии латентно-текущего интерстициального воспаления наблюдаются повреждение тубулярных клеток, нарушение сосудистой микроциркуляции и развитие гипоксии с последующим формированием атрофии и разрушением лизосом в канальцевых клетках [33]. Указанные механизмы поражения канальцевых клеток, по-видимому, имеют место как в начале развития тубулоинтерстициального процесса, так и в последующем, усугубляясь по мере формирования склероза [10, 25–28].
У пациентов с ПМР, осложненным РН, повышенная мочевая экскреция β2-МГ выявлялась чаще, чем в группе детей с ПМР без РН, что позволяет предложить его в качестве маркера прогрессирования РН. Полученные данные согласуются с результатами, полученными А. Kaminska et al. (2000), которые показали, что повышенный уровень микроглобулинов в моче отражает степень интерстициального повреждения у детей с ПМР [18].
ЗАКЛЮЧЕНИЕ
Таким образом, значимыми маркерами раннего выявления РН служат AngII и TФР-β1; уровни СКФ и β2-МГ – маркерами прогрессирования РН. Снижение СКФ – неблагоприятный признак и более характерный для тяжелой степени РН, особенно при ее прогрессирующем течении. С увеличением длительности заболевания усугубляются склеротические процессы в почках, что доказано увеличением уровней AngII и TФ Р-β1 в моче при любых степенях РН и их прямой корреляционной связью со склеротическими изменениями по данным ДМСА-сцинтиграфии в динамике наблюдения. Следовательно, повышенная мочевая экскреция AngII и TФР-β1 может использоваться в качестве маркеров развития склеротических изменений (РН) в почечной ткани у детей с ПМР, а повышенный мочевой уровень β2-МГ свидетельствует о прогрессировании нефросклероза. Установленная прямая корреляционная связь между уровнем мочевой экскреции изучаемых маркеров и степенью тяжести РН у больных ПМР свидетельствует о целесообразности и перспективности их включения в качестве диагностических маркеров раннего выявления и прогнозирования прогрессирования РН.



