Детский церебральный паралич (ДЦП) – одно из самых распространенных заболеваний нервной системы, которое приводит к нарушению формирования физиологического паттерна движений и развитию двигательного дефицита [1]. Несвоевременная коррекция двигательных нарушений при ДЦП всегда связана с развитием вторичных ортопедических нарушений [2]. Ботулинотерапия при ДЦП успешно применяется уже около 25 лет [3]. Основным показанием к применению этого метода лечения служит локальная или регионарная спастичность, которая значимо изменяет движения ребенка и приводит к формированию устойчивого патологического двигательного стереотипа, закрепление которого образует порочный круг: спастичность–изменение паттерна движений–ограничение объема движений–формирование контрактур–еще большее изменение паттерна движений–усиление слабости мышц-антагонистов и усугубление проявлений спастичности агонистов. Использование инъекций препаратов ботулинического токсина типа А (БТА) позволяет значимо снижать спастичность мышц, наиболее вовлеченных в патологический двигательный стереотип, и открывает возможности для эффективного применения физических методов восстановительного лечения для коррекции двигательных нарушений, позволяет сохранять необходимый объем движений в суставах и тем самым препятствует развитию контрактур суставов [4, 5]. Наиболее ярким и демонстративным обычно считается эффект инъекций препаратов БТА при лечении эквинусной установки стоп при ДЦП [6, 7]. Однако изолированная спастичность только икроножных мышц при ДЦП отмечается преимущественно у детей с I и II уровнями развития больших моторных функций по системе GMFCS (Gross Motor Function Classification System). Большинство пациентов с ДЦП имеют спастичность одновременно в разных группах мышц ног и рук. Введение БТА одновременно в несколько мышечных групп, выполняющих разные функции, повышает эффективность лечения [8]. Этот подход широко обсуждался в международном медицинском сообществе и был признан наиболее оправданным [9, 10]. Однако распространение многоуровневых инъекций при ДЦП было ограничено в связи с тем, что в официальные показания к применению препаратов БТА в отношении детей в Российской Федерации до недавнего времени была включена только одна патологическая спастическая установка – эквинусное положение стопы. В 2017 г. для препарата Abobotulinumtoxin A (Диспорт®) в России получены расширенные показания к лечению ДЦП. Эти было связано с завершением и публикацией результатов самого большого международного многоцентрового исследования Abobotulinumtoxin A при ДЦП [11–13]. Сегодня именно многоуровневые инъекции препаратов БТА при ДЦП используются наиболее часто в ежедневной клинической практике.
Что изменилось в официальной инструкции по применению препарата Abobotulinumtoxin A и как это можно наиболее эффективно использовать? Во-первых, изменилась сама формулировка официальных показаний: «Фокальная спастичность нижних конечностей у детей в возрасте 2 лет и старше», что подразумевает возможность применения инъекций препарата Abobotulinumtoxin A в отношении детей не только вследствие ДЦП, но и при спастичности после черепно-мозговой или спинномозговой травмы, рассеянного склероза, нейроинфекций и инсульта.
Во-вторых, увеличилось число зарегистрированных мышц нижней конечности для введения Abobotulinumtoxin A. Если есть клиническая необходимость, т.е. имеется спастичность, мешающая активности ребенка и приводящая к ограничению объема движений, рекомендовано проводить инъекции Abobotulinumtoxin A не только в икроножные, камбаловидную и заднюю большеберцовую мышцы, но и в мышцы – сгибатели голени: полусухожильную (m. semitendinosus) и полуперепончатую (m. semimembranosus) мышцы – для коррекции сгибательной установки коленных суставов. Также разрешено выполнять инъекции в приводящие мышцы бедра (длинную – m. adductor longus, короткую – m. adductor brevis и большую – m. adductor magnus) при приводящей установке бедер.
В-третьих, расширен диапазон доз Abobotulinumtoxin A (от минимального необходимого до максимального безопасного) и определено оптимальное число точек инъекций для каждой рекомендованной мышцы (см. таблицу).
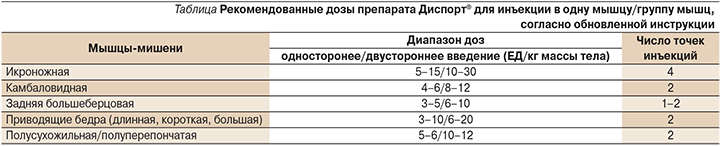
Для инъекций в полусухожильную и полуперепончатую мышцы указан диапазон доз, рекомендованный сразу для двух мышц, а не для каждой из них в отдельности, т.е. в этом случае доза рассчитывается как на функциональный сегмент конечности (т.е. для мышц, расположенных на одном анатомическом уровне и выполняющих одинаковую функцию), а уже врач, выполняющий инъекцию, распределяет дозу между этими мышцами. При введении препарата в приводящие мышцы бедра также работает правило расчета дозы на функциональный сегмент конечности, т.е. выбранная доза Abobotulinumtoxin A может вводиться в одну мышцу (наиболее часто в длинную приводящую мышцу), а при более выраженной спастичности могут быть инъецированы две или даже все три приводящие мышцы бедра.
Не менее важное изменение в обновленной официальной инструкции к Abobotulinumtoxin A относится к многоуровневым инъекциям, когда во время процедуры возможно введение Abobotulinumtoxin A одновременно в икроножные мышцы, полусухожильную и полуперепончатую мышцы, приводящие мышцы бедра одной ноги, но при этом доза препарата не должна превышать 15 ЕД/кг массы тела для одной конечности и, соответственно, 30 ЕД/кг массы тела (или суммарно 1000 ЕД) для всех мышц обеих ног. Данное ограничение особенно актуально для пациентов ДЦП с более тяжелым уровнем поражения (спастическая диплегия или спастический тетрапарез).
Также уточнен максимальный объем введения препарата в одну точку – он не должен превышать 0,5 мл раствора (при стандартном разведении флакона по 500 ЕД 2,5 мл 0,9%-ного раствора NaCl или флакона по 300 ЕД – 1,5 мл), т.е. не более 100 ЕД. При необходимости введения более 0,5 мл раствора в одну мышцу общий объем препарата распределяют на несколько инъекционных точек.
Еще одна важная рекомендация в обновленной официальной инструкции касается изменения в продолжительности действия Abobotulinumtoxin A. Так, большинству пациентов в недавних клинических исследованиях повторные инъекции проводились по мере необходимости в интервале между 16-й и 22-й неделями, а некоторые пациенты имели еще более длительный эффект и повторное введение Abobotulinumtoxin A было выполнено через 28 недель [12, 13]. Применяя этот подход на практике, можно проводить повторные инъекции препарата Abobotulinumtoxin A не схематически, а по мере клинической необходимости, т.е. после начала снижения эффекта от предыдущей инъекции. Таким образом, большинству пациентов будет необходимо проводить инъекции только 2 раза в год, что позволит значительно увеличить длительность терапевтического окна и возможность эффективного применения консервативного лечения. Кроме того, коррекция интервалов между инъекциями с учетом индивидуальных потребностей пациента имеет и значимые экономические преимущества (снижение затраты на сам препарат, уменьшение нагрузки на врачей и пропусков рабочих дней родителями и т.д.), а также уменьшает психологический дистресс ребенка от выполнения инвазивной процедуры. Пациенты, которым требуется более частое применение препарата БТА, могут получать инъекции 3–4 раза в год, но не ранее чем через 12 недель после предыдущей процедуры.
Таким образом, сегодня, применяя препарат Abobotulinumtoxin A, мы можем в рамках официальных показаний использовать стратегию многоуровневых инъекций в мышцы нижних конечностей и проводить безопасное и более эффективное лечение пациентов с ДЦП.
Обсуждая многоуровневые инъекции препаратов БТА, нужно отметить, что впервые эффективность и безопасность высоких доз препарата Abobotulinumtoxin A при ДЦП была оценена в специальном исследовании немецких авторов в 2006 г. при лечении спастичности проксимальных мышц бедра [14]. В исследование были включены дети в возрасте от 2,4 до 10,9 года с двусторонними формами ДЦП. Инъекции выполнялись только в мышцы бедра – приводящие, полусухожильную и полуперепончатую. Общая доза не превышала 30 ЕД/кг массы тела. Результаты показали высокую эффективность в коррекции спастичности и безопасность примененных доз. Особая ценность этого исследования не только в двухуровневом применении препа-рата БТА, а еще и в том, что было показано: инъекции в икроножные мышцы не являются обязательным пунктом в протоколе ботулинотерапии.
Проведение лечения с использованием препаратов БТА предполагает выполнение повторных инъекций в течение достаточно длительного периода времени. Это связано с необходимостью поддержания антиспастического эффекта. Длительность интервалов между повторными инъекциями препаратов БТА обычно регулируется двумя основными факторами – возможностью получения препарата и клинической необходимостью, т.е. наступлением того времени, когда миорелаксирующее действие начинает угасать и спастичность мышц вновь постепенно увеличивается. Клиническая необходимость в применении препаратов БТА при ДЦП также не является постоянной величиной, т.к. степень спастичности разных мышц может с возрастом меняться [15].
К тому же длительность антиспастического действия конкретного препаратов БТА также зависит от нескольких факторов: дозы введенного препарата, степени спастичности мышцы, ее величины, индивидуальной чувствительности ребенка и др., но влияние большей дозы препарата на увеличение длительности действия остается определяющим. Поэтому при планировании проведения ботулинотерапии выбор применяемой дозы препарата определяется не только возможностью достижения эффекта миорелаксации конкретных мышц, но и предполагаемой длительностью действия.
Пациенты с GMFCS-III и -IV, как правило, нуждаются в применении самых высоких общих доз препаратов БТА. В первую очередь это связано с высокой степенью спастичности и большим числом мышц-мишеней, а также необходимостью проводить инъекции в обе нижние конечности, т.к. в большинстве случаев это дети с тяжелыми двусторонними формами ДЦП (со спастической диплегией и спастическим тетрапарезом). Общее число инъецированных мышц ног у таких пациентов может достигать 8–10.
В связи с этим общая доза на процедуру введения Abobotulinumtoxin A может значительно увеличиваться и достигать 30 ЕД/кг массы тела или даже более. Чтобы не превышать рекомендованную общую дозу (30 ЕД/кг массы тела, согласно инструкции, к препарату Abobotulinumtoxin A и рекомендациям Европейского консенсуса по ботулинотерапии ДЦП) пациентам с GMFCS-III и -IV может быть рекомендовано несколько подходов.
Первый состоит в проведении инъекций БТА только в самые ключевые спастичные мышцы, определяющие патологический двигательный стереотип. Как правило, чтобы добиться выраженного длительного эффекта миорелаксации, инъекции выполняют в две, максимум – в три мышцы-мишени с двух сторон в высоких дозах для каждой мышцы. Общая доза на процедуру также будет высокой. При этом подходе интервалы между процедурами инъекций будут достаточно большими – 5–7 месяцев. Недостатком такого подхода считается постепенное повышение мышечного тонуса в других спастичных мышцах конечностей с изменением двигательного стереотипа и угрозой формирования вторичных ортопедических осложнений в зонах без антиспастического лечения.
Второй возможный сценарий связан с использованием средних доз препарата БТА для каждой мышцы, нуждающейся в антиспастическом лечении, при этом общая доза будет всегда высокой, максимально разрешенной при расчете на массу тела ребенка. Интервалы между процедурами, определяемыми по клинической необходимости, как правило, будут небольшими, а частота инъекций будет достаточно высокой – 3–4 раза в год.
Третий вариант применения инъекций БТА основан на чередовании мышц-мишеней при повторных процедурах.
В этом случае в одну процедуру выполняют инъекции в 2–3 группы мышц в высокой дозе, в следующую процедуру производят введение препарата в другие группы мышц также в высокой дозе. Интервалы между процедурами максимально короткие – 3 месяца. При таком подходе ко второй процедуре антиспастический эффект в мышцах, инъецированных в первую процедуру, еще сохраняется и нет необходимости выполнять в них инъекции. Затем лечение при необходимости повторяется. Эта схема лечения позволяет с высокой эффективностью купировать спастичность практически во всех мышцах-мишенях и проводить профилактику формирования вторичных ортопедических осложнений во всех сегментах конечности.
К недостаткам подобного подхода можно отнести частое выполнение болезненной процедуры (4 раза в год) с применением высоких доз (30 ЕД/кг массы тела), что при длительном применении может увеличивать риск выработки нейтрализующих антител с последующим формированием вторичной иммунологической резистентности к препарату.
Ниже приводим несколько клинических случаев пациентов со спастическими формами ДЦП с описанием выбора мышц-мишеней и расчета доз для проведения многоуровневых инъекций препарата Abobotulinumtoxin A.
Клинический случай 1
Пациент Ш. 7 лет. Находится под нашим наблюдением в течение 2 лет. Жалобы на момент обращения: самостоятельно не ходит, выраженная эмоциональная лабильность, повышенная тревожность.
Aнамнез: ребенок от 2-й беременности (двойня), протекавшей на фоне угрозы прерывания. Роды вторые, преждевременные, на 32-й неделе беременности было выполнено экстренное кесарево сечение. Мальчик первый из двойни. Масса тела при рождении – 1420 г, длина – 41 см. Оценка по шкале Апгар – 6/8 баллов. Ребенок из-за дыхательных нарушений сразу был переведен в отделение реанимации, в течение 7 суток проводилась искусственная вентиляция легких (ИВЛ), после перевода на самостоятельное дыхание однократно наблюдался эпизод апноэ. Через 2 недели мальчик был переведен в отделение патологии недоношенных детей ГКБ № 7 Москвы с диагнозом «внутриутробная пневмония. Дыхательная недостаточность 1-й степени. Трахеобронхит. Гипоксическое поражение центральной нервной системы (ЦНС), синдром вегетативной дисфункции. Перивентрикулярная лейкомаляция (кистозная форма)». На первом году жизни наблюдался неврологом с диагнозом «последствия перинатального поражения ЦНС, задержка формирования двигательных навыков». В возрасте 1 года установлен диагноз «ДЦП, спастическая диплегия». Получал регулярные курсы реабилитационного лечения, медикаментозную терапию (пероральные антиспастические препараты, ноотропное и нейротрофическое лечение). По данным магнитно-резонансной томографии головного мозга, выполненной в возрасте 5 лет, выявлены признаки постгипоксической лейкопатии в перивентрикулярных областях с двух сторон, расширение задних рогов боковых желудочков, в большей степени слева.
Осмотр в возрасте 5 лет: ребенок на осмотр реагирует беспокойством, очень тревожен. Астенического телосложения, масса тела – 14,2 кг. Голова долихоцефалической формы. Менингеальных знаков и общемозговых симптомов нет. Со стороны черепных нервов патологии не отмечается. Самостоятельно переворачивается, встает на четвереньки и ползает на четвереньках, садится, встает у опоры и ходит у опоры. С поддержкой за руки или в ходунках может ходить на небольшие расстояния. При вертикализации отмечается сгибание и приведение бедер, сгибание в коленных суставах, опора на передний отдел стоп, хуже справа. Выявлено значимое повышение мышечного тонуса в мышцах ног с двух сторон: тонкая мышца (2 балла по шкале Эшворта), полусухожильная и полуперепончатая (3 балла по шкале Эшворта), икроножные (2 балла по шкале Эшворта). Трицепс-тест с оценкой по Сильвершельду: справа 78о/95о, слева 75о/90о. Проба Тардье положительная при тестировании отведения с прямыми ногами (тонкая мышца), при разгибании в коленном суставе (полусухожильная и полуперепончатая), при тыльном сгибании стопы с разогнутым коленом (икроножные мышцы) с обеих сторон – разница между углами при медленном и быстром движениях в каждом суставе составила более 15 градусов. При вертикализации усиливалась внутренняя ротация бедер и сгибательная установка коленных суставов, а также отмечалось вальгусное положение стоп. Сила мышц достоверно не снижена. Манипулятивная функция рук развита удовлетворительно, ребенок хорошо рисует. Сухожильные рефлексы резко оживлены, что больше отмечается в ногах, зоны вызывания рефлексов расширены. Тазовые функции контролирует. Значимых нарушений чувствительности нет. Говорит развернутыми фразами. Психическое развитие опережает возрастную норму.
Диагноз ребенка: ДЦП, спастическая диплегия. Сгибательно-приводящая установка обоих бедер, сгибательная установка коленных суставов, эквино-плоско-вальгусная установка стоп. GMFCS-III.
Было принято решение о проведении ботулинотерапии в общей дозе 430 ЕД препарата Abobotulinumtoxin A: икроножные мышцы по 130 ЕД справа и слева, длинная приводящая мышца по 35 ЕД справа и слева, полусухожильная/полуперепончатая мышцы по 50 ЕД справа и слева.
На контрольном осмотре ребенка через 1 месяц было выявлено значимое снижение мышечного тонуса (на 1 балл по шкале Эшворта) в икроножных мышцах, однако в тонких и полусухожильной/полуперепончатой мышцах отмечено меньшее снижение мышечного тонуса. Побочных эффектов от проведенного лечения не наблюдалось. Ребенок прошел курс интенсивного восстановительного лечения в рамках дневного стационара. Было принято решение о повышении дозы препарата БТА при повторном ведении в тонкие и полусухожильные/полуперепончатые мышцы.
С интервалом в 4 месяца от первого введения была проведена ботулинотерапия в общей дозе 570 ЕД препарата Abobotulinumtoxin A: икроножные мышцы по 135 ЕД справа и слева, длинная приводящая мышца по 70 ЕД справа и слева, полусухожильная/полуперепончатая мышцы по 80 ЕД справа и слева.
На контрольном осмотре ребенка через 1 месяц после повторного проведения ботулинотерапии выявлено значимое снижение мышечного тонуса (на 1 балл по шкале Эшворта) во всех инъецированных группах мышц (икроножных, тонкой, полусухожильной/полуперепончатой) с обеих сторон. Развития слабости или других побочных эффектов не наблюдалось. Ребенок прошел курс интенсивного восстановительного лечения в рамках дневного стационара. Через 3 месяца после повторного лечения сохранялся эффект миорелаксации, поэтому инъекции Abobotulinumtoxin A были отложены до следующего контрольного осмотра еще через 1,5 месяца. Через 4,5 месяца были проведены инъекции по предыдущему протоколу, т.к. лечение было эффективным и хорошо переносилось, а ребенок не набрал вес.
В дальнейшем инъекции БТА ему выполнялись регулярно с интервалом 4,5–5,0 месяцев, доза корректировалась с учетом массы тела ребенка.
Клинический случай 2
Пациент Г. 3,5 лет. Находится под нашим наблюдением в течение 1 года 2 месяцев. Жалобы: самостоятельно не ходит, ходьба на носках с использованием дополнительной опоры.
Aнамнез: ребенок родился недоношенным на 33-й неделе беременности с легкой асфиксией: оценка по Апгар – 6/7 баллов. Масса тела при рождении – 1820 г. Из родового зала переведен в ОРИТ, находился на ИВЛ в течение 3 суток, затем 3 недели в отделении для недоношенных детей. С раннего возраста наблюдался неврологом, но лечения практически не получал, т.к. рассматривался как неврологически здоровый недоношенный ребенок. Развитие на первом году с задержкой формирования двигательных навыков. На магнитно-резонансной томографии головного мозга в возрасте 1 года обнаружены признаки постгипоксической лейкопатии в перивентрикулярных областях с двух сторон.
Осмотр в возрасте 2 лет 4 месяцев: ребенок осмотру и контакту доступен. Нормостенического телосложения. Масса тела – 11, 5 кг. Менингеальных знаков и общемозговых симптомов нет. Судорог при осмотре не было. Со стороны черепных нервов патологии не выявлено, за исключением расходящегося альтернирующего косоглазия слева.
Отмечается значимое повышение мышечного тонуса в приводящих и полусухожильной/полуперепончатой мышцах (2 балла по шкале Эшворта) и икроножных мышцах с двух сторон (2 балла по шкале Эшворта). Трицепс-тест с оценкой по Сильвершельду: справа 70о/85о, слева 75о/90о. При вертикализации определяется эквино-вальгусная установка стоп. При длительном стоянии может опуститься на полную стопу. Ползает на четвереньках реципрокно, быстро. Самостоятельно садится, уверенно без поддержки сидит, встает у опоры, стоит и ходит у опоры. Манипулятивная функция рук удовлетворительная. Сила мышц значимо не снижена. Сухожильные рефлексы резко оживлены, D=S. Клоноид стоп. Речь фразовая, психическое развитие не отстает от возрастной нормы.
Диагноз: ДЦП, спастическая диплегия. Приводящая установка бедер, сгибательная установка коленных суставов, эквино-вальгусная установка стоп, D<S. GMFCS-II.
В соответствии с осмотром протокол инъекций включал следующие мышцы: длинная приводящая бедра по 50 ЕД справа и слева, полусухожильная/полуперепончатая мышцы – 45 ЕД справа и 55 ЕД слева, икроножные мышцы – 120 ЕД справа и 140 ЕД слева. Сум-марная доза препарата Диспорт® составила 360 ЕД.
При катамнестическом наблюдении антиспастический эффект после выполнения инъекций сохранялся в течение 5,5 месяцев. В дальнейшем повторные инъекции выполнялись с интервалом 5–5,5 месяца с учетом увеличения массы тела ребенка в общей дозе 30 ЕД/кг массы тела. Мышцы-мишени и распределение дозы препарата оставались стабильными.
Проведение регулярной ботулинотерапии позволило хорошо контролировать спастичность, и ребенок смог освоить самостоятельную ходьбу после второго курса инъекций Abobotulinumtoxin A. Повторные инъекции БТА были направлены на поддержание достигнутого антиспастического эффекта, оптимизацию двигательного паттерна и профилактику контрактур в голеностопном и коленных суставах.
Заключение
Таким образом, с помощью регулярных многоуровневых инъекций Abobotulinumtoxin A для купирования спастичности мышц нижних конечностей у детей с ДЦП можно достичь не только адекватного снижения мышечного тонуса, но и значимо улучшить двигательные возможности пациентов, а также осуществить профилактику развития вторичных ортопедических осложнений.



