Обзор литературы
Согласно определению Российской гастроэнтерологической ассоциации и Российского консенсуса по диагностике и лечению хронического панкреатита, хронический панкреатит (ХП) представляет собой группу хронических заболеваний поджелудочной железы (ПЖ) различной этиологии воспалительной природы, характеризующихся болью в животе, развитием необратимых структурных изменений паренхимы и протоков, замещением их соединительной (фиброзной) тканью и развитием вследствие этого экзокринной и эндокринной панкреатической недостаточности [1].
ХП является заболеванием, которое может оказывать существенное влияние на качество жизни и ассоциироваться с опасными для жизни долгосрочными осложнениями, такими как сахарный диабет, рак ПЖ, трофологическая недостаточность [2, 3]. Патоморфологической основой большинства этиологических форм ХП является сочетание деструкции ацинарного аппарата с прогрессирующим воспалительным процессом, приводящее к атрофии, фиброзу (циррозу) и нарушениям в протоковой системе ПЖ, преимущественно за счет развития микро- и макролитиаза.
У большинства больных ХП развивается в результате комплексного воздействия множества факторов, к которым относят:
- Употребление алкоголя. Алкоголь признан доказанной причиной развития ХП [4]. Он увеличивает склонность к преципитации секрета ПЖ и образованию белковых пробок внутри панкреатических протоков. Белковые пробки способствуют формированию и увеличению конкрементов, вызывая изъязвление прилегающего эпителия протоков, рубцевание, дальнейшую обструкцию, ацинарную атрофию и фиброз [5]. Вместе с тем принципиальную роль могут играть иные факторы: пол, наследственные и др., поэтому диагноз «алкогольный панкреатит» не обязательно подразумевает хронический алкоголизм или последствия злоупотребления алкоголем.
- Табакокурение. Является независимым фактором риска развития ХП, кальцификации ПЖ, ускоряющим прогрессирование заболевания и увеличивающим смертность от ХП [6].
- Особенности питания. В развитии ХП важную роль играет пищевой рацион с большим содержанием жиров и белков. Роль пищевых факторов в развитии ХП подтверждается связью гиперлипидемии (в первую очередь гипертриглицеридемии) с рецидивами острого панкреатита, в отдельных случаях – с формированием ХП [7, 8].
- Факторы, влияющие на диаметр панкреатических протоков и отток секрета ПЖ. Заболевания билиарной системы (желчнокаменная болезнь, особенно в форме холедохолитиаза, дисфункция сфинктера Одди и др.), pancreas divisum, кольцевидная ПЖ и прочие аномалии ПЖ, посттравматические рубцовые стенозы протоков ПЖ, блокада протоков ПЖ (например, опухолью). При наличии таких факторов ХП считают обструктивным.
- Наследственные факторы. Опреде-лены мутации в генах катионного трипсиногена (PRSS1), панкреатического секреторного ингибитора трипсина (PSTI), ингибитора сериновой протеазы – фактора Казаля-1 (SPINK1) и карбоксипептидазы A1 (CPA1). В гене трансмембранного регулятора кистозного фиброза (CFTR) выявлены мутации, лежащие в основе развития наследственного ХП. Наследственный панкреатит – это панкреатит, не имеющий других этиологических факторов, кроме указанных мутаций. Панкреатит развивается у тех членов семьи, которые наследуют генные мутации. Семейный панкреатит – это панкреатит любой этиологии, который в данной семье возникает с более высокой частотой, чем в популяции. Семейный панкреатит с высокой вероятностью, но не обязательно вызван генетическим дефектом. Кроме того, выделяют идиопатический панкреатит – изолированные случаи панкреатита, при которых исключены все возможные причины заболевания. В рубрику наследственных факторов внесен также тропический панкреатит, т.к. идентифицированы генетические факторы риска его развития (45–60% вероятности ассоциации с мутациями гена панкреатического ингибитора трипсина) [9].
- Иммунологические факторы. Аутоиммунный панкреатит, ассоциированный с синдромом Гужеро–Шегрена; с воспалительными заболеваниями кишечника; с аутоиммунными заболеваниями (например, с первичным склерозирующим холангитом, первичным билиарным циррозом печени) или протекающий в виде изолированной формы (очаговой или диффузной).
- Различные редкие и метаболические факторы: гиперкальциемия и гиперпаратиреоз; хроническая почечная недостаточность; лекарственный панкреатит; токсический панкреатит.
В данной статье мы хотели бы осветить такую редкую причину ХП, как первичный гиперпаратиреоз (ПГПТ).
ПГПТ представляет собой состояние, характеризующееся повышенной секрецией паратиреоидного гормона (ПТГ) [10].
Повышение продукции ПТГ происходит вследствие различных причин: наличие объемного образования, гиперплазия одной либо нескольких паращитовидных желез (ПЩЖ). При этом уровень кальция крови может быть как повышенным [11], так и сниженным либо нормальным [12]. Первый документально подтвержденный случай сочетания ХП и гиперпаратиреоза был выявлен Эрдгеймом в 1903 г. в результате аутопсии. В 1940 г. Смит и Кук описали пациента, который умер от острого панкреатита, коррелирующего с гиперпаратиреозом. Только в 1957 г. Cope опубликовали 2 случая сочетания ХП с ПГПТ. После того как Cope et al. обратили внимание на связь панкреатита и гиперпаратиреоза, стали появляться публикации на эту тему [13]. В 1962 г. Mixter et al. сообщили о 62 случаях панкреатита, возникших в связи с ПГПТ. В последующих докладах основное внимание уделялось развитию панкреатита у пациентов, оперированных по поводу гиперпаратиреоидизма [14]. Основываясь на данных анализа 1435 пациентов, была выявлена корреляционная зависимость между гиперкальциемией, вызванной гиперпаратиреозом, и ХП. Согласно этому исследованию, гиперкальциемия – ведущий фактор развития панкреатита у пациентов с гиперпаратиреоидизмом [15].
Эпидемиология ПГПТ
ПГПТ – довольно редкое заболевание. По данным И.И. Дедова и соавт., его частота составляет примерно 20 случаев на 100 тыс. населения в год, но в связи с улучшением диагностики она в последние годы увеличивается [16]. Эпидемиологические исследования, проведенные в странах Западной Европы и Северной Америки, показали, что ПГПТ занимает 3-е место по распространенности среди эндокринных заболеваний после сахарного диабета и патологии щитовидной железы, а в индустриально высокоразвитых странах – 1–2-е места среди патологий эндокринной системы [17]. При этом отмечено, что женщины в 2 раза чаще, чем мужчины, подвержены заболеванию ПГПТ. У большинства пациентов с ПГПТ заболевание диагностируется в возрасте от 50 до 60 лет [18]. Однако S. Ghosh, A. Collier, D. Clark et al. считают, что ПГПТ может развиваться в любом возрасте и его распространенность в популяции составляет примерно 1%, но чаще болеют лица старше 55 лет (2%). Большинство пациентов составляют женщины в постменопаузе с манифестацией заболевания в течение первых 10 лет после наступления менопаузы. Соотношение мужчин и женщин – 1:2, при этом распространенность среди женщин в постменопаузе достигает 3–4%. Ежегодная заболеваемость может варьироваться от 0,4 до 18,8 случая на 10 тыс. населения в зависимости от уровня и качества диспансерного обследования [19]. N. Yu, P.T. Donnan, M.J. Murphy et al. подтверждают, что частота ПГПТ у женщин выше, чем у мужчин, и увеличивается с возрастом [20].
Этиология
K. Ouchi et al. считают, что в 85% случаев причиной ПГПТ служит аденома ПЩЖ. Другие причины: в 3–5% – множественные аденомы, в 10–12% – гиперплазия ПЩЖ, в 1–2% – карцинома ПЩЖ, также ПГПТ может быть составной частью синдрома множественной эндокринной неоплазии (МЭН) 1-го или 2-го типа. Самыми редкими причинами являются синдром семейной доброкачественной гипокальциурической гиперкальциемии и длительная терапия препаратами лития [21, 22].
Патогенез
При ПГПТ под действием ПТГ увеличивается реабсорбция кальция почками, что приводит к повышению его уровня в крови [23]. Помимо увеличения поглощения кальция в дистальных канальцах происходят увеличение синтеза 1α-гидроксилазы в проксимальных почечных канальцах и синтез активной формы витамина D – кальцитриола. Следствием этого является усиление всасывания кальция в кишечнике. Кроме того, ПТГ стимулирует превращение моноцитарных стволовых клеток в остеокласты, что приводит к мобилизации кальция из костной ткани [24]. Одним из последствий гиперкальциемии являются отложение кальция в протоке ПЖ и его обструкция. Гиперкальциемия может приводить к преждевременной активации трипсиногена, следствием чего является аутолиз структур паренхимы ПЖ [25].
Диагностика и лечение
У многих пациентов ПГПТ диагностируется случайно, когда при обследовании выявляется гиперкальциемия [21]. Большинством авторов признается, что «золотым» стандартом постановки диагноза ПГПТ является повышенный уровень интактного ПТГ более чем на 50% от нормы в сочетании с одновременным увеличением показателя ионизированного кальция сыворотки [26, 27]. Основным методом инструментальной диагностики паратиреоидной патологии признана сцинтиграфия с Tc-Sestamibi. Этот метод наиболее достоверен при обнаружении одиночных паратиреоидных аденом (его чувствительность составляет более 90%). Для повышения эффективности диагностики патологии ПЩЖ используется комбинация сцинтиграфии с Tc-Sestamibi и однофотонной эмиссионной компьютерной томографией (КТ), что особенно важно при атипичной локализации желез, а также их множественном поражении [28, 29, 30].Чувствительность КТ в диагностике измененных ПЩЖ составляет 76–83%, а при сочетании КТ со сцинтиграфией чувствительность приближается к 100% [31, 32]. По мнению большинства авторов, единственным методом лечения ПГПТ, позволяющим добиваться нормализации биохимических показателей крови, является резекция патологически измененных ПЩЖ [21, 33, 34]. Подавляющее большинство хирургов считают, что операция достаточно хорошо переносится, имеет благоприятный отдаленный прогноз, предотвращая такие осложнения, как остеопороз, развитие гиперкальциемического криза, и устраняет психоневрологические расстройства [26, 35, 36]. По данным многочисленных публикаций, эффективность оперативного лечения достигает 98%, рецидивы заболевания более характерны для семейной наследственной формы ПГПТ и синдрома МЭН [36, 37, 38].
Клинический случай
Больная Е. 53 лет в ноябре 2018 г. была госпитализирована в отделение патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова с обострением ХП.
При поступлении пациентка предъявляла жалобы на ноющие боли в эпигастрии и левом подреберье, вздутие, урчание в животе, на кашицеобразный стул до 2 раз в сутки.
Из анамнеза известно, что заболевание дебютировало в 2007 г. впервые выявленным сахарным диабетом 2 типа, инсулинопотребным. Позже,в том же году больная отметила появление болей в верхних отделах живота. При обследовании: по данным ультразвукового исследования (УЗИ) органов брюшной полости, выявлено расширение Вирсунгова протока с кальцинатами поджелудочной железы и был выставлен диагноз: хронический кальцифицирующий панкреатит. Следует отметить, что основными причинами кальцифицирующего панкреатита считаются злоупотребление алкоголем и курение, однако больная этих вредных привычек не имела. Пациентка принимала спазмолитики, таблетированные ферментные препараты с кратковременным положительным эффектом. Болевые приступы беспокоили раз в 2–3 месяца, а в 2017 г. боли приобрели постоянный характер, в связи с чем в ноябре 2017 г. пациентка была госпитализирована в МКНЦ им. А.С. Логинова. При поступлении больная отметила снижение веса на 10 кг за год и кашицеобразный стул после каждого приема пищи, По данным УЗИ и магнитно-резонансной холангиопанкреатографии (МРХПГ) выявлена картина хронического кальцифицирующего панкреатита с блоком на уровне головки и выраженной панкреатической гипертензией, вирсунголитиаз, признаки диффузных изменений печени, билиарного сладжа в желчном пузыре. В биохимическом анализе крови отмечен умеренный цитолиз и холестаз (табл. 1). Диагностированы внешнесекреторная недостаточность ПЖ тяжелой степени (панкреатическая эластаза кала – 16,33 мкг/г) и повышение уровня паратгормона (7,45 пмоль/л при верхней границе нормы 6,8 пмоль/л, что для диагностики гиперпаратиреоза незначимо – превышение менее 50%). Пациентке была назначена терапия препаратами урсодезоксихолевой кислоты (УДХК), подобрана адекватная доза заместительной ферментной терапии (минимикросферы панкреатина). При выписке рекомендована повторная госпитализация через 3 месяца для динамического наблюдения. Однако повторно больная была госпитализирована в МКНЦ им А.С. Логинова лишь через год, в ноябре 2018 г. Больная продолжала прием УДХК.
При осмотре общее состояние удовлетворительное. Кожные покровы и видимые слизистые оболочки обычной окраски и влажности, тургор кожи снижен, удовлетворительного питания (индекс массы тела=19,81 кг/м2). В легких дыхание везикулярное, хрипов нет. Частота дыхания – 16 в минуту, частота сердечных сокращений – 68 в минуту, артериальное давление – 120/80 мм рт.ст. Живот не вздут. При пальпации живот мягкий, болезненный в эпигастрии и левом подреберье. Печень у края реберной дуги. Селезенка не пальпируется.
При поступлении в биохимическом анализе крови отмечено умеренное повышение уровня γ-глутамилтрансферазы (ГГТП), АСТ и АЛТ в пределах референсных значений. (табл. 1).
Выявлено диагностически значимое повышение уровня ПТГ (13,2 пмоль/л) и умеренное повышение уровня общего кальция (табл. 2).
В клиническом анализе крови отклонений не выявлено.
При обследовании
По данным УЗИ: признаки диффузных изменений ПЖ (хронический кальцифицирующий панкреатит: в паренхиме лоцировано множество кальцинатов до 12 мм с эхо-тенями), панкреатическая гипертензия (Вирсунгов проток расширен, диаметр – 7 мм, в просвете конкременты – 5–6 мм), вирсунголитиаз, билиарный сладж в желчном пузыре, диффузные изменения печени.
МРТ в режиме МРХПГ: картина хронического кальцифицирующего панкреатита с блоком на уровне головки ПЖ и выраженной панкреатической гипертензией (Вирсунгов проток расширен до 10 мм). Вирсунголитиаз в просвете главного панкреатического протока (ГПП) на уровне тела определяются крупные конкременты размером до 8×9 мм, диаметром до 5 и 3,5 мм.
 В просвете ГПП на уровне хвоста также определяются конкременты диаметром до 2–3 мм). МР-признаки диффузных изменений печени, билиарного сладжа в желчном пузыре (сигнал от желчи несколько снижен, по задней стенке определяется взвесь).
В просвете ГПП на уровне хвоста также определяются конкременты диаметром до 2–3 мм). МР-признаки диффузных изменений печени, билиарного сладжа в желчном пузыре (сигнал от желчи несколько снижен, по задней стенке определяется взвесь).
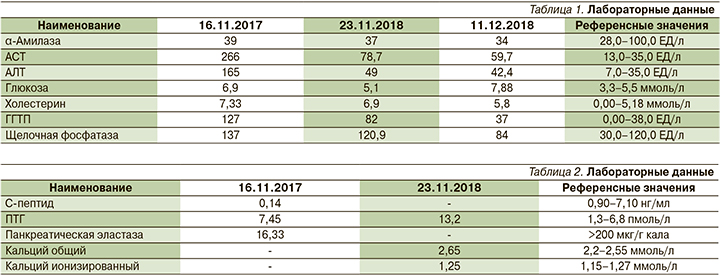
Мультиспиральная КТ органов брюшной полости с внутривенным контрастированием (рис. 1): признаки хронического кальцифицирующего панкреатита (в области головки крупные конкременты до 22×10 мм), конкрементов ГПП (наиболее крупный из которых определяется в шейке (10×7 мм), в области тела (10×16 мм), панкреатической гипертензии (ГПП расширен до 10 мм).
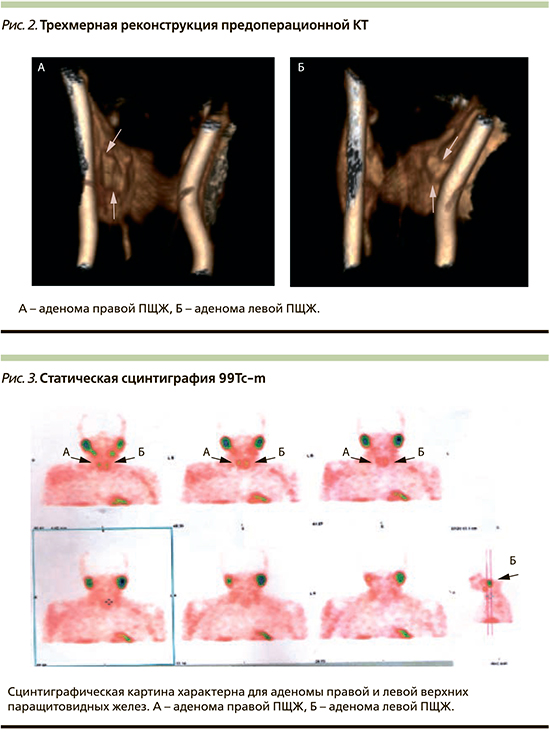
Лабораторные изменения: повышение уровня ПТГ до 13,2 пмоль/л, что составило более чем на 50% выше нормы, повышение уровня общего кальция до 2,65 ммоль/л, наличие кальцифицирующего панкреатита, билиарного сладжа и конкрементов в почках позволили нам предположить наличие аденомы ПЩЖ у пациентки. В связи с чем кроме рутинных исследований (УЗИ органов брюшной полости и эзофагогастродуоденоскопия) пациентке выполнены МСКТ шеи с внутривенным контрастированием и сцинтиграфия 99Тс-m, а также остеоденситометрия для уточнения степени остеопении.
МСКТ шеи с внутривенным контрастированием: шея симметрична, все анатомические структуры дифференцированы. Слюнные железы расположены обычно, структура и размеры их не нарушены. Магистральные сосуды симметричны, не расширены. Надгортанник не изменен. Грушевидные синусы свободны. Подскладочные пространства и передняя комиссура свободны. Голосовая щель не деформирована. Голосовые связки симметричны. Хрящи гортани расположены правильно, структура их не нарушена, травматических изменений не выявлено. Щитовидная железа расположена типично: правая доля размером 13×18×36 мм (88 ед. Н), образований не выявлено; левая доля размером 22×14×38 мм (83 ед. Н), визуализируется гиподенсное образование овальной формы с четкими и ровными контурами размером 10 мм и плотностью до 67 ед. Н (накапливает препарат до 100 ед. Н, гиподенсно во все фазы контрастирования). По заднему контуру образования определяется структура по денситометрическим показателям, аналогичная ткани железы размером 5×6 мм; толщина перешейка до 3 мм.
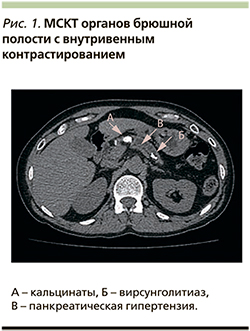
Заключение. КТ-признаков шейной лимфаденопатии нет (поднижнечелюстные узлы до 9 мм по ходу сонных артерий и яремных вен толщиной до 8 мм). Структуры верхнего средостения дифференцированы, признаков верхнемедиастинальной лимфаденопатии нет (верхние паратрахеальные лимфатические узлы до 5 мм). КТ-картина образований левой доли щитовидной железы (узловой зоб?). Образование (?) левой ПЩЖ (рис. 2).
Остеоденситометрия: минеральная плотность костной ткани соответствует остеопении.
На основании вышепредставленных данных пациентке был выставлен заключительный клинический диагноз: первичный гиперпаратиреоз, висцеральная форма (хронический кальцифицирующий панкреатит, мочекаменная болезнь, остеопения), аденомы верхних околощитовидных желез. Хронический кальцифицирующий панкреатит 3-й ст., M-ANNHEIM С, средняя степень тяжести (13 баллов). Внешнесекреторная недостаточность поджелудочной железы тяжелой степени. Вирсунголитиаз. Панкреати-ческая гипертензия. Панкреатогенный сахарный диабет (целевой уровень гликированного гемоглобина менее 7,0%).
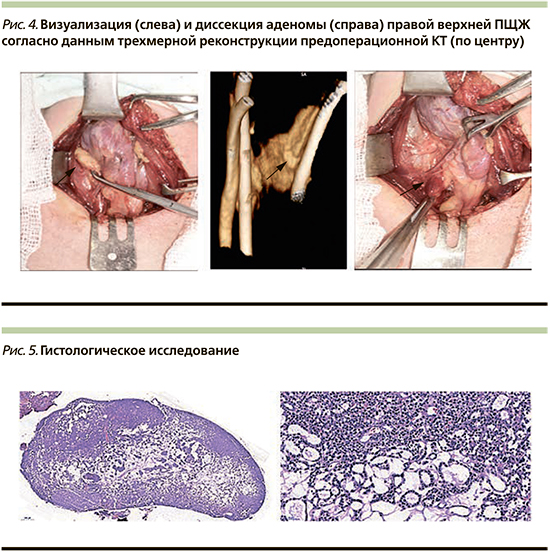
11.12.2018 пациентке выполнена селективная паратиреоидэктомия, ревизия ПЩЖ (рис. 4).
На следующий день после проведенного оперативного лечения у пациентки по данным лабораторных исследований отмечена нормализация уровней ПТГ, общего и ионизированного кальция (табл. 3).
По данным гистологического исследования операционного материала (рис. 5) подтвержден диагноз: аденома ПЩЖ.
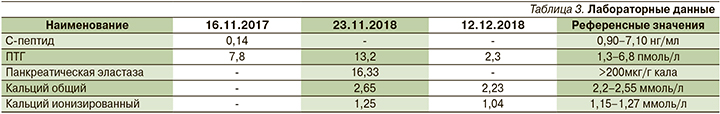
Через год после проведенного оперативного лечения пациентка чувствует себя удовлетворительно, жалоб не предъявляет, отмечается прибавка массы тела, уровни ПЩГ, общего и ионизированного кальция крови сохраняются в пределах референсных значений.
Обсуждение
В структуре множества этиологических факторов панкреатита ПГПТ встречается довольно редко. Однако причинно-следственная связь между этими двумя заболеваниями все еще вызывает споры. Остается нерешенным вопрос: является ли развитие кальцифицирующего панкреатита следствием ПГПТ или же это сочетание двух независимо текущих заболеваний? Большинство исследователей считают, что ПГПТ является предиктором развития панкреатита. Однако М.А. Bess et al. в своем исследовании опровергают связь между ПГПТ и панкреатитом. В 1980 г. они провели исследование, которое показало, что из 1153 больных только у 1,5% пациентов был выявлен ПГПТ, что сопоставимо с заболеваемостью в контрольной группе. Эти исследователи предположили, что связь может быть случайной, а не причинно-следственной [39]. По данным А.К. Arya et al., частота развития панкреатита у больных ПГПТ достигает 16% [40].
В Северной Индии проведено ретроспективное одноцентровое исследование, в котором оценивались данные пациентов, госпитализированных в стационар с июня 2015 г. по май 2016 г. В исследование были включены все больные панкреатитом, поступившие в клинику, – 70 пациентов (53 – с острым панкреатитом и 17 – с ХП). Из них у 5 (9,4%) пациентов выявлен ПГПТ. На пациентах с высоким уровнем кальция проводили исследование интактного ПТГ методом радиоиммуноанализа и сцинтиграфию с технецием 99m Sestamibi (MIBI-Tc-99m). Всем пациентам была выполнена резекция ПЩЖ и по данным гистологического исследования подтвержден диагноз: аденома ПЩЖ [41]. Кроме того, основываясь на мета-анализе 10 исследований, выполненных Н.Х. Bai et al., объединенные клинические и экспериментальные данные позволяют предположить связь между ПГПТ и панкреатитом с выраженной гиперкальциемией [42].
Заключение
Таким образом, при выявлении гипекальциемии у пациентов с ХП необходимо обязательное проведение дополнительных лабораторных и инструментальных исследований, таких как определение уровня ПТГ, сцинтиграфия ПЩЖ в сочетании с МСКТ. Точность предоперационной локализации аденом ПЩЖ при ПГПТ обеспечивает минимальную инвазивность хирургического лечения и снижает риск рецидива ПГПТ. Единственным методом лечения ПГПТ, позволяющим добиваться нормализации биохимических показателей, является резекция патологических ПЩЖ. Лечение достаточно редкого сочетания ХП с ПГПТ – это слаженная совместная работа междисциплинарной команды, состоящей из гастроэнтерологов, эндокринологов, хирургов и специалистов лучевой диагностики.



