Введение
Феохромоцитома (син. надпочечниковая параганглиома, ФХЦ/ПГ) – нейроэндокринная опухоль мозгового слоя надпочечников. В абсолютном большинстве случаев ФХЦ/ПГ является гормонально-активной опухолью с гиперсекрецией катехоламинов: адреналина, норадреналина, дофамина. Однако в связи с нейроэндокринным происхождением опухоли описаны также крайне редкие случаи эктопической гиперсекреции ФХЦ/ПГ и других пептидных гормонов, например адренокортикотропного гормона (АКТГ), соматостатина, нейропептида Y, метэнкефалина, а также вазоактивного интерстициального пептида (ВИП) [1–4]. G. Viale et al. (1985) впервые иммуногистохимически (ИГХ) подтвердили возможность внеостровково-панкреатической секреции ВИП, соматостатина и кальцитонина ФХЦ у 30-летнего мужчины с клиническими проявлениями синдрома Моррисона–Эллисона. Притом в островках поджелудочной железы при ИГХ отклонений выявлено не было [1].
Классификация новообразований Всемирной организации здравоохранения последнего, четвертого, пересмотра, относит ФХЦ/ПГ к злокачественным новообразованиям с нейроэндокринной дифференцировкой [5]. Широкое внедрение в клиническую практику за последние два десятилетия новых методов визуализации и разработка лабораторного определения содержания метилированных катехоламинов крови и мочи существенно изменили ранее существовавшее представление о заболеваемости ФХЦ/ПГ. По данным аутопсии, ФХЦ/ПГ выявляется в 0,05–0,1% случаев всех вскрытий. Примерно у 1,5–23% пациентов с инциденталомой надпочечника, обнаруженной во время анатомического вскрытия, диагностировали ФХЦ. Распространенность ФХЦ/ПГ среди всех пациентов с гипертензией составляет 0,2–0,6% [6–9].
Около трети всех пациентов с ФХЦ/ПГ имеют наследственные мутации [6], среди которых важное место занимают синдромы множественной эндокринной неоплазии (МЭН) МЭН 2А и МЭН 2Б (МЭН 3) типов, связанные с мутацией RET-протоонкогена.
Наиболее часто встречающуюся опухоль, характерную для данных синдромов и определяющую, как правило, прогноз, представляет медуллярная карцинома щитовидной железы (МКЩЖ), пенетрантность развития которой при обоих типах МЭН приближается к 100%. Основным высокочувствительным и органоспецифичным биохимическим маркером МКЩЖ служит уровень кальцитонина [10]. Определение данного показателя, а также проведение генетического тестирования рекомендованы для всех больных ФХЦ/ПГ с целью исключения синдромов МЭН 2 типа [11, 12]. В связи с высокой органоспецифичностью выявление у пациента с ФХЦ/ПГ повышенного уровня кальцитонина служит основанием заподозрить наличие МКЩЖ и требует проведения ряда диагностических исследований для подтверждения либо исключения этого заболевания.
В данной статье мы представляем очень редкий клинический случай сопутствующей гиперсекреции кальцитонина ФХЦ без МКЩЖ.
Клинический случай
Пациентка Т. 38 лет, экономист, госпитализирована в Клинику высоких медицинских технологий им. Н.И. Пирогова Санкт-Петербургского государственного университета (КВМТ СПбГУ) 18.09.2020 с артериальной гипертензией смешанного типа: на фоне постоянно повышенного уровня артериального давления (АД) до 140–150/90–95 мм рт.ст. развивались типичные симпато-адреналовые кризы с повышением уровня АД до 180/100 мм рт.ст. Кризы характеризовались чрезвычайно сильными пульсирующими давящими головными болями в затылочной области, учащенным сердцебиением, профузной обильной потливостью, чувством страха, ощущением внутренней дрожи, одышкой смешанного характера, эмоциональной лабильностью и слезливостью. Связать развитие эпизодов повышения уровня АД с какими-либо факторами, например ортостазом, физическими нагрузками, приемом пищи, пациентка не могла. В последние месяцы эти эпизоды существенно участились – до 2–3 раз в неделю.
Считает себя больной около 2 лет. Многочисленные обращения к терапевту и кардиологу приводили к многократной смене антигипертензивных препаратов различных групп без значимого клинического улучшения.
В течение последнего года отмечалось умеренное повышение уровня глюкозы плазмы натощак (до 6,2 ммоль/л) при уровне гликированного гемоглобина (HbА1c) 6%.
В августе 2020 г. при скрининговом ультразвуковом исследовании (УЗИ) органов брюшной полости (ОБП) в подпеченочном пространстве справа впервые выявлено образование правильной овоидной формы с четкими контурами, однородной структуры, умеренно гиперэхогенное размером 89×67×66 мм. Образование прилежало и частично деформировало верхний полюс правой почки. Заключение: образование брюшной полости (рис. 1). Рекомендовано проведение магнитно-резонансной томографии (МРТ).
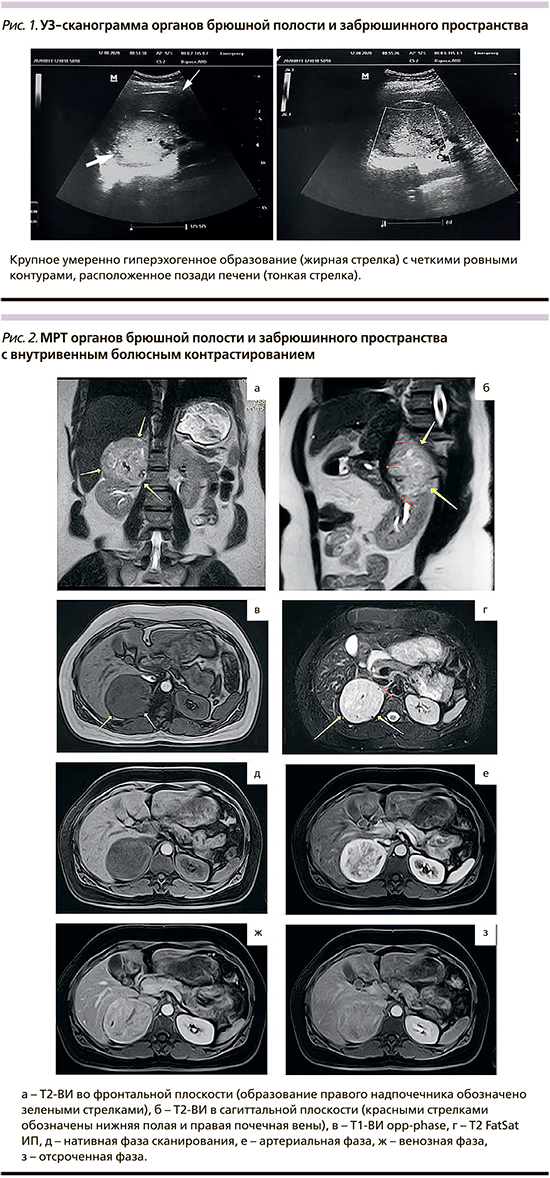
При МРТ ОБП с контрастированием (17.08.2020) установлено, что объемное образование округлой формы размером 72×74×68 мм с ровными, четкими контурами, неоднородным МР-сигналом в центре за счет наличия участков некроза, интенсивно неоднородно накапливающее контрастное вещество (КВ), исходит из правого надпочечника. Инвазии в соседние органы достоверно не определялось. Заключение: образование правого надпочечника – ФХЦ(?), дифференцировать с адренокортикальным раком, вторичные изменения сомнительны (рис. 2).
Консультация эндокринолога. Заключение: новообразование правого надпочечника. ФХЦ? Рекомендовано проведение компьютерной томографии (КТ) ОБП, исследование катехоламинов.
При КТ ОБП (22.08.2020) в проекции правого надпочечника определялось дополнительное гиподенсивное образование с ровным четким контуром размером 76×70×64 мм. Образование активно накапливало контрастное вещество (до +130HU) с последующим быстрым его вымыванием, неоднородно за счет участков жидкостной плотности, вероятно некроза. Также в толще образования выявили извитые контрастированные ветви артерий, одна из которых расширена до 6 мм – средняя либо нижняя надпочечниковая артерия. Объемное образование несколько компримировало правую долю печени с прилежащей стороны и оттесняло верхний полюс правой почки кзади и книзу. Заключение: КТ-картина объемного образования правого надпочечника – ФХЦ.
Консультация онколога: новообразование правого надпочечника. Рекомендовано проведение позитронно-эмиссионной томографии с КТ всего тела с 18F-фтордезоксиглюкозы (ПЭТ/КТ с 18F-ФДГ).
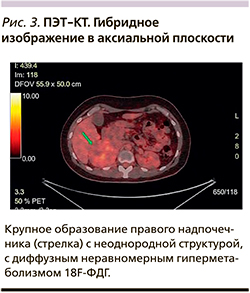 При ПЭТ/КТ всего тела с 18F-ФДГ (24.08.2020) в забрюшинном пространстве справа в проекции надпочечника определялось сόлидное образование округлой формы с четким неровным контуром неоднородной структуры размером 78×70×76 мм с диффузным неравномерным гиперметаболизмом 18F-ФДГ с SUV max=5,98. Образование смещало правую почку книзу, оттесняло правую долю печени, без признаков инвазии. В ротоглотке, миокарде, почках, мочевом пузыре, а также по ходу желудочно-кишечного тракта отмечалось физиологическое накопление РФП. Других очагов гиперфиксации РФП, в т.ч. в ЩЖ и поджелудочной железе, не выявлено. Заключение: метаболически активное образование правого надпочечника (рис. 3).
При ПЭТ/КТ всего тела с 18F-ФДГ (24.08.2020) в забрюшинном пространстве справа в проекции надпочечника определялось сόлидное образование округлой формы с четким неровным контуром неоднородной структуры размером 78×70×76 мм с диффузным неравномерным гиперметаболизмом 18F-ФДГ с SUV max=5,98. Образование смещало правую почку книзу, оттесняло правую долю печени, без признаков инвазии. В ротоглотке, миокарде, почках, мочевом пузыре, а также по ходу желудочно-кишечного тракта отмечалось физиологическое накопление РФП. Других очагов гиперфиксации РФП, в т.ч. в ЩЖ и поджелудочной железе, не выявлено. Заключение: метаболически активное образование правого надпочечника (рис. 3).
При амбулаторном обследовании выявлено повышение уровней свободного метанефрина и свободного норметанефрина в суточной моче до 316 (18–277) мкг/сут и 9164 (42–423) мкг/сут соответственно.
Альдостерон плазмы – 91,7 пг/мл (25,2–392), ренин – 10,7 мкМЕ/мл (4,4–46,1). Экскреция кортизола в суточной моче – 107 нмоль/сут (до 485,6). Ночной подавляющий тест с 1 мг дексаметазона – кортизол сыворотки крови – 0,8 мкг/дл. В итоге сомнений в наличии ФХЦ не было, рекомендовано оперативное лечение в условиях специализированного стационара после проведения медикаментозной пред-операционной подготовки.
С целью предоперационной подготовки пациентке назначен доксазозин в дозе 1 мг/сут с последующим повышением дозировки до 8 мг/сут, которую получала в течение 2 недель до оперативного лечения. На фоне достигнутой α1-блокады к терапии был подключен бисопролол 10 мг/сут. Через неделю комбинированной терапии α1-β-адреноблокаторами отмечено выраженное улучшение самочувствия с показателями АД 100–110/70–80 мм рт.ст., прекратились эпизоды кризового повышения АД с выраженными вегетативными проявлениями.
С учетом молодого возраста, следовательно, высокой вероятности синдромов МЭН 2 типа и ассоциированных с ними заболеваний дополнительно проведено исследованные уровней ионизированного кальция – 1,22 ммоль/л (1,12–1,32) и паратгормона – 5,4 пмоль/л (1,6–6,9), что исключило наличие первичного гиперпаратиреоза. Однако при исследовании уровня кальцитонина крови выявлено его повышение до 28,35 пг/мл (норма для некурящих женщин до 6,4), повторно в другой лаборатории – до 31 пг/мл (норма для некурящих женщин до 5 пг/мл). Пациентка не курит.
С учетом подозрения на наличие МКЩЖ выполнено УЗИ ЩЖ, при котором данных за узловые образования получено не было. В связи с неоднозначностью лабораторных данных стимуляционный тест с глюконатом кальция не проводился. С учетом планируемой госпитализации в специализированный стационар рекомендовано решение вопроса о необходимости выполнения данной пробы с хирургом – эндокринологом центра.
После нормализации уровня АД и стабилизации основных показателей гемодинамики пациентка госпитализирована в отделение эндокринной хирургии КВМТ СПбГУ для оперативного лечения.
При обследовании в клинике: пациентка в удовлетворительном состоянии, без фенотипических признаков, характерных для синдромов МЭН 2 типа (отсутствуют ганглионевромы, лихеноидный амилоидоз на коже, марфаноподобная внешность и др.). Рост – 157 см, масса тела – 70 кг, индекс массы тела – 28,4 кг/м2. Температура тела – 36,7°С. Кожные покровы чистые естественной окраски, обычной влажности. Видимые слизистые оболочки чистые обычной окраски. ЩЖ не увеличена мягко-эластической консистенции, безболезненная при пальпации. Регионарные и периферические лимфоузлы не увеличены. Тоны сердца приглушены, ритмичные, акцент II тона над аортой, систолический шум во всех точках аускультации. Артериальное давление – 130/80 мм рт.ст., пульс – 88 ударов в минуту, ритмичный. Число дыханий – 18 в минуту. Дыхание везикулярное, хрипов нет. При поверхностной пальпации живот мягкий, безболезненный во всех отделах. Глубокая пальпация живота не проводилась в связи с угрозой провоцирования симпатоадреналового криза. Физиологические отправления в норме. Отеков нет.
При лабораторном обследовании в клиническом анализе крови патологических отклонений выявлено не было. В биохимическом анализе крови отмечалось повышение уровня аланинаминотрансферазы (АЛТ) до 44,3 ЕД/л (до 34,0), глюкозы до 6,2 ммоль/л (3,5–6,1), С-реактивного белка до 10,7 мг/л (до 5,0). Остальные показатели находились в пределах референтных значений: аспартатаминотрансфераза (АСТ) – 26,1 ЕД/л (до 31,0), билирубин общий – 9,79 мкмоль/л (1,7–21,0), билирубин прямой – 2,52 мкмоль/л (до 5,13), билирубин непрямой – 7,3 мкмоль/л, амилаза – 45,1 ЕД/л (до 100,0), общий белок – 45,1 ЕД/л (66,0–88,0), креатинин – 69,9 мкмоль/л (44,0–80,0), мочевина – 3,81 ммоль/л (2,8–7,2), калий – 4,5 ммоль/л (3,5–5,1). В коагулограмме все показатели без патологических отклонений: международное нормализованное отношение (МНО) – 0,98 (0,8–1,2), протромбин (по Квиву) – 104,5% (70,0–120,0), протромбиновое время – 11,8 секунды (11,5–14,5), активированное частичное тромбопластиновое время (АЧТВ) – 22,6 секунды (21,1–36,5), фибриноген – 3,5 г/л (1,8–3,5). В общем анализе мочи патологических отклонений выявлено не было. При исследовании онкомаркеров в крови раковый эмбриональный антиген (РЭА) находился в пределах референтных значений и составил 2,6 нг/мл (норма для некурящих до 3,8), тогда как хромогранин А был повышен до 139 мкг/л (0–100).
Данные инструментальных методов обследования:
Фиброгастродуоденоскопия: поверхностный гастродуоденит. Косвенные признаки дискинезии желчного пузыря.
Рентгенография органов грудной клетки: легкие расправлены, очаговые и инфильтративных теней не выявлено. Легочной рисунок не изменен. Корни легких структурны. Купола диафрагмы четкие ровные. Синусы свободные. Сердце не расширено.
При электрокардиографии (ЭКГ) регистрировался синусовый ритм с частотой сердечных сокращений (ЧСС) 75 ударов в минуту. Электрическая ось сердца не отклонена.
Эхокардиография: аорта уплотнена. Аортальный клапан (АК) сформирован как трехстворчатый. Створки АК уплотнены, не утолщены. Гемодинамических изменений на уровне АК нет. Створки митрального клапана и подклапанные структуры не изменены. Митральная регургитация – 0–I степени, небольшая. Трикуспидальная регургитация – I степени. Легочная регургитация – 0–I степени, подклапанная, физиологическая. Перегородки прослеживаются на всем протяжении, достоверных сбросов на их уровне нет. Зоны асинергии не выявлены. Полости сердца не расширены. Размеры левого желудочка (ЛЖ) в четырехкамерной позиции: базальный – 42 мм, средний – 39 мм, вертикальный – 71 мм. Очаговый склероз межжелудочковой перегородки (МЖП). Тенденция к гипертрофии МЖП (толщина МЖП – 11,1 мм). Кинез и глобальная сократимости миокарда ЛЖ достаточные. Фракция выброса по Симпсону – 70%. Систолическая функция правого желудочка в пределах нормы. Диастолическая дисфункция ЛЖ по 1-му типу. Расчетное давление в легочной артерии – 23 мм рт.ст.
Суточное мониторирование ЭКГ: на протяжении всей записи регистрировался синусовый ритм с максимальной частотой сердечных сокращений (ЧСС) 131 удар в минуту, минимальной ЧСС – 73, среднесуточной ЧСС – 88 ударов в минуту. Зарегистрированы наджелудочковые нарушения ритма: 14 одиночных экстрасистол (11 днем и 3 ночью), 1 парная экстрасистола во время сна. Желудочковой эктопической активности не регистрировалось. Удлинения интервала QT не выявлено, атриовентрикулярная блокада 1-й степени не обнаружена. Гемодинамически значимых пауз не выявлено. Диагностически значимого смещения сегмента ST–T не выявлено, ишемические изменения ЭКГ не обнаружены.
При УЗИ сосудов шеи значимых нарушений локальной гемодинамики внутренних яремных вен, внутренних сонных артерий, наружных сонных артерий, позвоночных артерий справа и слева не выявлено. Ход артерий не нарушен. Комплекс интима-медиа не изменен. Консультирована неврологом, данных за очаговую неврологическую патологию не выявлено.
При УЗИ признаков тромбоза глубоких и поверхностных вен правой и левой нижних конечностей не обнаружено.
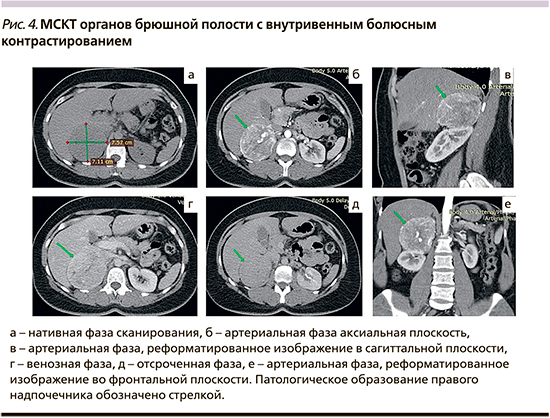
Мультиспиральная КТ органов грудной клетки (ОГК) и ОБП с внутривенным болюсным контрастированием: ОГК без свежих очаговых и инфильтративных изменений. Новообразования легких не лоцируются. На серии МСК томограмм печень обычной формы, размеров, положения, без очагов патологической плотности. Внутрипеченочные желчные протоки и желчевыводящие пути не расширены. Желчный пузырь в размерах не увеличен, рентгеноконтрастных конкрементов не содержит. Поджелудочная железа расположена, обычно имеет однородную структуру. Вирсунгов проток не визуализируется. Очаговых изменений и патологических образований в ткани железы не выявлено. Парапанкреатическая клетчатка не изменена. Селезенка в размерах не увеличена, имеет ровные контуры однородной плотности без очаговых изменений. Почки в размерах не увеличены. Правая почка смещена каудально. Паренхима почек без очагов патологической плотности. Чашечно-лоханочная система почек не расширена. Сосудистые ножки почек структурны. Паранефральная клетчатка не изменена. Надпочечники расположены обычно. Левый надпочечник в размерах не увеличен. Правый надпочечник увеличен в размерах за счет новообразования 75 мм в диаметре с ровными четкими контурами, плотно прилежащего к нижней поверхности правой доли печени, к передней поверхности верхнего отдела правой почки, к нижней полой вене. Нативная плотность +25 HU, накопление контрастного вещества (КВ) в артериальную фазу до +116 HU, в венозную до +105 HU, через 10 минут после введения КВ снижается до +60 HU. В структуре образования определяются крупные сосуды. Образование плотно прилежит к нижней поверхности правой доли печени, к передней поверхности верхнего отдела правой почки, к нижней полой вене. Свободная жидкость в брюшной полости не определяется. Увеличения лимфоузлов брюшной полости и забрюшинного пространства не отмечается. Деструктивных изменений костей в зоне сканирования не отмечается. Заключение: КТ-признаки гиперваскулярного образования правого надпочечника (рис. 4).
С учетом дважды установленного повышения уровня кальцитонина в анамнезе проведены повторное исследование его уровня, а также УЗИ ЩЖ. Узловых образований выявлено не было, уровень кальцитонина крови был повышен до 12,4 пг/мл (норма для некурящих женщин до 5,0). Данные отклонения были расценены как проявление С-клеточной гиперплазии ЩЖ или, что менее вероятно, МКЩЖ малых размеров. Принято решение о проведении стимуляционной пробы с глюконатом кальция в послеоперационном периоде.
Установлен диагноз «ФХЦ правого надпочечника, смешанная форма».
Осложнения: симптоматическая артериальная гипертензия, смешанная форма с кризовым течением. Дисметаболическая (катехоламин-индуцированная) кардиомиопатия. Редкая наджелудочковая экстрасистолия. Хроническая сердечная недостаточность 0–1-й степени (по классификации Нью-Йоркской ассоциации сердца).
Сопутствующие заболевания: хронический гастродуоденит вне обострения. Дискинезия желчевыводящих путей на фоне деформации шейки желчного пузыря. Дегенеративно дистрофическое заболевание позвоночника. Остеохондроз, преимущественно шейного отдела позвоночника.
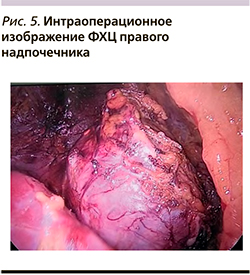 Выполнена однопортовая ретроперитонеоскопическая адреналэктомия справа 21.09.2020 (рис. 5). Длительность операции – 2 часа 25 минут. Гемодинамика во время операции: с начала операции уровень АД – 128–187/60–85 мм рт.ст., после пересечения центральной вены надпочечника – 88–120/53–72 мм рт.ст. Послеоперационный период протекал гладко, без осложнений.
Выполнена однопортовая ретроперитонеоскопическая адреналэктомия справа 21.09.2020 (рис. 5). Длительность операции – 2 часа 25 минут. Гемодинамика во время операции: с начала операции уровень АД – 128–187/60–85 мм рт.ст., после пересечения центральной вены надпочечника – 88–120/53–72 мм рт.ст. Послеоперационный период протекал гладко, без осложнений.
При контроле лабораторных показателей после операции в клиническом анализе крови лейкоцитоз – 12,1×109/л без сдвига лейкоцитарной формулы, остальные показатели без значимых патологических изменений. В биохимическом анализе крови уровень АЛТ составил 25,1 (норма до 35,0), АСТ – 23,8 ЕД/л (норма до 35,0), γ-глутамилтрансфераза – 22,5 ЕД/л (норма до 38,0), билирубин – 10,2 мкмоль/л (5,0–21,0), амилаза – 27,5 ЕД/л (норма до 100,0), креатинин – 83 мкмоль/л (58–96), мочевина – 3,2 ммоль/л (2,8–7,2), в электролитах калий – 3,9 ммоль/л (3,5–5,0), натрий – 134,4 ммоль/л (134,0–148,0), хлориды – 105,1 ммоль/л (97,0–110,0), кальций ионизированный – 1,23 ммоль/л (1,13–1,31).
После операции повторно исследован уровень кальцитонина крови, который резко снизился, составив значение менее 1 пг/мл (норма до 5). В связи с неоднократным повышением уровня базального кальцитонина, по данным предыдущих исследований, выполнена стимуляционная проба с внутривенным введением 20 мл 10%-ного глюконата кальция, c определением уровня кальцитонина крови до инъекции, а также через 1, 2 и 5 минут после введения препарата.
Во всех исследованных пробах крови значение кальцитонина составило менее 1 нг/мл(см. таблицу).
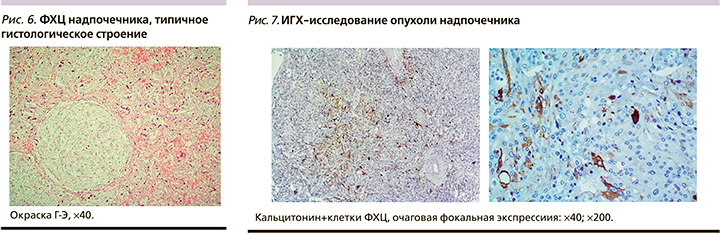
Полученные результаты визуализации и стимуляционного теста с глюконатом кальция позволили убедительно подтвердить наличие гиперпродукции кальцитонина удаленной опухолью надпочечника. Однако для окончательного подтверждения этого гистологический анализ дополнен ИГХ-исследованием. Гистология от 21.09.2020: опухоль надпочечника альвеолярно-гнездного строения, с признаками нейроэндокринной дифференцировки, с выраженным клеточно-ядерным полиморфизмом клеток, обширной, слабой зернистой цитоплазмой, без признаков капсулярной и сосудистой инвазии. При ИГХ-исследовании от 24.09.2020: опухолевые клетки интенсивно экспрессируют хромогранин A, немногочисленные клетки фокально интенсивно экспрессируют кальцитонин и не экспрессируют мелан A. Индекс пролиферативной активности Ki-67 низкий (в 1–2% клеток). Заключение: гистологическая картина и иммунофенотип опухоли правого надпочечника соответствуют кальцитонин-продуцирующей ФХЦ без признаков капсулярной и сосудистой инвазии (рис. 6, 7).
Пациентка направлена на молекулярно-генетическое исследование, по результатам которого патогенные мутации RET-протоонкогена обнаружены не были.
Обсуждение
Согласно рекомендациям Евро-пейского эндокринологического общества и Российской ассоциации эндокринологов, всем пациентам с ФХЦ рекомендовано генетическое исследование для исключения наличия наследственных форм, в т.ч. в составе синдрома МЭН 2 типа [12]. В качестве предварительного более простого и дешевого метода у пациентов данной группы определяют уровень базального кальцитонина, кальция и паратгормона. Данный тест имеет высокую чувствительность при выявлении МКЩЖ, однако его специфичность не так высока и зависит от амплитуды повышения уровня кальцитонина [10]. По данным УЗИ никаких изменений в ЩЖ выявлено не было.
В описываемом нами случае не столь значительное повышение уровня кальцитонина требовало дальнейшего диагностического поиска. Прежде всего, были исключены заболевания, которые могут сопровождаться повышением уровня кальцитонина: гиперпаратиреоз, алкогольный цирроз пече-ни, тиреоидиты, болезнь Педжета, рак молочной железы, панкреатит, мегалобластная анемия, лейкемия. Редкой причиной гиперпродукции кальцитонина могут быть также нейроэндокринные опухоли, локализованные вне ЩЖ. Наиболее распространенными локализациями кальцитонинпродуцирующих опухолей вне ЩЖ являются новообразования поджелудочной железы [13], реже – легких [14, 15].
По данным МСКТ ОГК и ОБП пациентки Т. не выявлено новообразований легких и поджелудочной железы. Отсутствовали и какие-либо клинические и рентгенологические признаки синдрома Золлингера–Эллисона.
В то же время в правом надпочечнике обнаружена большая опухоль диаметром 75 мм, имеющая признаки ФХЦ. Диагноз был подтвержден клинически и лабораторными данными. Возникло предположение о продукции кальцитонина ФХЦ. Поставить точный диагноз до операции не представлялось возможным, потому что такая же продукция кальцитонина возможна и при С-клеточной гиперплазии ЩЖ. Стимуляционная проба с введением глюконата кальция для дифференциальной диагностики в таких случаях большого смысла не имеет, потому что повышения продукции кальцитонина при этих состояниях не будет.
Она была проведена после удаления ФХЦ и подтвердила отсутствие других причин продукции кальцитонина.
Известно, что продукция того или иного гормона не является стабильным параметром нейроэндокринной опухоли. Такие новообразования могут секретировать несколько биологически активных веществ, не свойственных клеткам, из которых они происходят. При этом по мере роста опухоли спектр продуцируемых веществ зачастую подвергается изменениям.
Описанный случай представлял сложность в дифференциальной диагностике в связи с возможной гиперсекрецией кальцитонина МКЩЖ малых размеров, что может быть характерно для синдрома МЭН 2 типа Отсутствие данных о генетическом тестировании до операции не позволяло исключить наследственные синдромы, при которых даже малое повышение уровня кальцитонина при исключении других причин может свидетельствовать о развитии злокачественного процесса в ЩЖ. Тем не менее значимое снижение уровня кальцитонина до неопределяемых величин после удаления надпочечника с опухолью подтвердило гипотезу о продукции кальцитонина ФХЦ.
Подобный случай был описан H. Hearth и A.J. Edis (1979), при котором гиперсекреция кальцитонина опухолью была подтверждена забором крови из периферической и надпочечниковой вен, а также снижением его уровня после адреналэктомии [16]. У 55-летней пациентки A. Kanamori et al. (1977) анамнестическое повышение уровня кальцитонина привело к тиреоидэктомии вторым этапом после удаления ФХЦ, несмотря на падение уровня кальцитонина после первой операции. При этом гистологически ни МКЩЖ, ни С-клеточной гиперплазии выявлено не было [17].
В представленном нами случае гиперсекреция кальцитонина была подтверждена не только по результатам лабораторных тестов в послеоперационном периоде, включая стимуляционный тест с глюконатом кальция, но и наличием экспрессии кальцитонина клетками удаленной ФХЦ по данным ИГХ-исследования. Кроме того, впоследствии был выполнен генетический тест, по результатам которого характерных для синдромов МЭН 2 типа мутаций выявлено не было, что позволило полностью исключить риск развития семейной формы МКЩЖ.
Выводы
В доступной литературе на русском и английском языках мы нашли только четыре случая описания секреции кальцитонина ФХЦ надпочечниковой локализации [1, 3, 16, 17]. В обзоре J. Kirkby-Bott et al. (2012) указано только три случая, один из которых опубликован на японском языке. Редкость данной патологии представляет интерес для практических врачей, особенно в вопросе дифференциальной диагностики с синдромом МЭН 2 типа.
Эктопическая продукция кальцитонина ФХЦ надпочечников не характерна и встречается крайне редко, однако ее развитие возможно, что следует учитывать при получении его повышенного уровня у пациентов с ФХЦ.
Предоперационное генетическое исследование больных ФХЦ/ПГ в подобных случаях значительно облегчает диагностический поиск, существенно снижая риск развития МКЩЖ у пациентов без наследственного синдрома МЭН 2 типа.
Информированное согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме.



